复合益生菌固态发酵白酒糟条件的研究
2023-02-08梅世慧朱鸣鸣何广霞曾成容张峻杰王开功周碧君
梅世慧 朱鸣鸣 王 微 何广霞 曾成容 张峻杰 陈 超* 王开功,2 文 明,2 周碧君,2*
(1.贵州大学动物科学学院,贵阳 550025;2.贵州大学动物疫病研究所,贵阳 550025)
据报道,近10年来我国饲料自给率将下降至85%以下,因此,解决饲料短缺问题刻不容缓。我国酒糟年产量巨大,每年酒糟生产量高达5 866万t,其中白酒糟的产量达到了15万t以上[1-2]。大量研究证明,白酒糟中含有丰富的粗蛋白质、粗脂肪、无氮浸出物等营养物质,还含有β-葡聚糖和甘露寡糖等免疫激活剂和活性因子[3]。但在生产实际中,由于酒糟含水量高、酸度高,贮藏过程中易发生霉变,难以保存,以及粗纤维含量高、不利于畜禽消化吸收等特点,大大限制了酒糟资源的利用。并且酒糟堆放时渗滤液中含有大量的高酸度污染物,会对环境造成严重污染[4-5],因此,解决酒糟再利用问题具有重要意义,既能实现废弃资源的再利用、减少环境污染,又能开发饲料资源。
目前,酒糟作为饲料利用的方式主要有直接利用、干燥处理、发酵处理和混合青贮4种方式,由于酒糟不易贮藏,管理不当易产生霉菌毒素,直接利用有导致畜禽中毒的风险;干燥处理成本较高且处理后酒糟内粗纤维含量仍然较高,不利于动物对营养物质的消化吸收;发酵处理和混合青贮能较好地延长酒糟营养物质的贮藏时间、一定程度上降低酒糟中的粗纤维含量,是目前研究酒糟饲料化利用的热点,其中以益生菌发酵酒糟饲料研究较多[6]。
目前已有益生菌发酵啤酒糟、白酒糟的研究,但是针对白酒糟进行益生菌发酵以优化益生菌发酵白酒糟的条件进而提高白酒糟发酵品质的研究较少。因此,本试验选用黑曲霉、粪肠球菌、植物乳杆菌、酿酒酵母进行复合益生菌发酵白酒糟,优化复合益生菌发酵白酒糟的发酵条件,为酒糟资源的合理利用提供理论依据。
1 材料与方法
1.1 试验材料
白酒糟由贵州省某集团股份有限公司提供,其中水分含量为48.92%,粗蛋白质含量为18.40%,酸性洗涤纤维含量为49.57%,中性洗涤纤维含量为64.94%,粗脂肪含量为9.26%,粗灰分含量为6.24%,钙含量为0.34%,磷含量为0.65%。玉米粉、麦麸、菜籽粕购于某面粉集团有限公司。白酒糟、玉米粉、麦麸、菜籽粕统一保存于-20 ℃冰箱中。植物乳杆菌(ACCC11095)、黑曲霉(CICC2377)购自上海保藏生物技术中心,酿酒酵母、粪肠球菌分离鉴定保藏于贵州大学。MRS培养基、PDA培养基购自北京索莱宝科技有限公司,YPD培养基由动物疫病研究所自制。
1.2 试验方法
1.2.1 菌种活化及扩培
植物乳杆菌、粪肠球菌接种于MRS肉汤培养基,37 ℃恒温培养箱静置培养12 h,酿酒酵母接种于YPD肉汤培养基,30 ℃、220 r/min摇床培养24 h,作为一级种子液。按照2%的接种量将一级种子液接入相应的肉汤培养基进行扩培,植物乳杆菌、粪肠球菌置于37 ℃恒温培养箱静置,酿酒酵母置于30 ℃、220 r/min摇床,均培养12 h,浓度调整至1×108CFU/mL,作为二级种子液,备用。黑曲霉接种于PDA斜面培养基,置于30 ℃恒温培养箱培养3~5 d至菌丝铺满整个斜面。最后利用磷酸缓冲液冲洗孢子制成孢子悬液,血球计数板调整孢子悬液浓度至1×108CFU/mL,备用。
1.2.2 菌种间拮抗关系
利用十字划线法将4株菌接种在同一培养皿(YPD)上,于37 ℃恒温培养箱有氧培养24 h,观察十字交叉处是否发生菌落萎缩和消失的现象以判断各菌株间拮抗关系。
1.2.3 发酵基料的优化
固定发酵温度为30 ℃、初始pH为5、发酵时间为3 d、接菌量为10%、菌种接种比例为1∶1∶1∶1。固定每袋发酵基料量为500 g,每组3个重复,装入自封袋排气后密封,最后放入恒温培养箱进行发酵。以发酵后白酒糟的粗蛋白质、中性洗涤纤维、酸性洗涤纤维含量和活菌数为指标,对发酵基料进行优化。
1)玉米粉添加量的确定。玉米粉按照0(对照)、3%、6%、9%的比例替换白酒糟,制备白酒糟发酵基料,筛选最佳玉米粉添加比例。
2)麦麸添加量的确定。根据1)的结果添加玉米粉后,麦麸按照0(对照)、1%、3%、5%的比例替换白酒糟,制备发酵基料,筛选最佳麦麸添加比例。
3)菜籽粕添加量的确定。根据1)、2)的结果添加玉米粉和麦麸后,菜籽粕按照0(对照)、6%、9%、12%的比例替换白酒糟,制备发酵基料,筛选最佳菜籽粕添加比例。
1.2.4 发酵条件的优化
固定每袋发酵基料量为500 g,每组3个重复,装入自封袋排气后密封,最后放入恒温培养箱进行发酵。以发酵后白酒糟的粗蛋白质、中性洗涤纤维、酸性洗涤纤维含量和pH降低值为指标,对发酵条件进行优化。
1)发酵时间的优化。固定菌种接种比例1∶1∶1∶1、接菌量为10%、初始pH为5、发酵温度为30 ℃。发酵时间选择1、3、5、7、9 d,筛选出最佳发酵时间范围。
2)发酵温度的优化。固定菌种接种比例1∶1∶1∶1、接菌量为10%、初始pH为5、发酵时间为3 d。发酵温度选择28、30、32、35、37 ℃,筛选出最佳发酵温度范围。
3)初始pH的优化。固定菌种接种比例1∶1∶1∶1、接菌量为10%、发酵温度为30 ℃、发酵时间为3 d。初始pH选择5、6、7、8,筛选出最佳初始pH发酵范围。
4)接菌量的优化。固定菌种接种比例1∶1∶1∶1、发酵温度为30 ℃、初始pH为5、发酵时间为3 d。接菌量选择0、6%、8%、10%、12%,筛选出最佳接菌量范围。
5)正交试验优化发酵条件。根据单因素试验结果,采用正交设计进一步对发酵初始pH(A)、接菌量(B)、发酵时间(C)进行优化,筛选出最优发酵条件(菌种接种比例1∶1∶1∶1),复合益生菌发酵条件正交试验因素水平结果见表1。
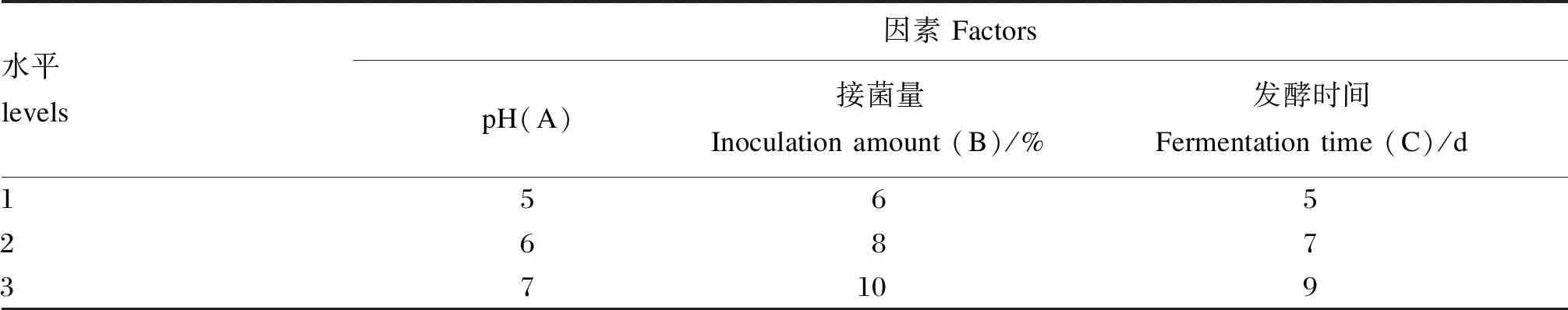
表1 复合益生菌发酵条件正交试验因素水平表[L9(33)]Table 1 Factor level table of orthogonal test of compound probiotic fermentation conditions [L9(33)]
1.3 测定指标及方法
粗蛋白质含量按照GB/T 6432—2018《饲料中粗蛋白质的测定》中的凯氏定氮法测定;菌落计数参照GB 4789.15—2016《食品微生物学检验:霉菌和酵母计数》和GB 4789.35—2016《食品微生物学检验:乳酸菌计数》的方法;中性洗涤纤维含量按照GB/T 20806—2006《饲料中中性洗涤纤维的测定》的方法测定;酸性洗涤纤维含量按照NY/T 1459—2007《饲料中酸性洗涤纤维的测定》的方法测定;pH使用酸度计测定。硫代葡萄糖苷和植酸含量采用分光光度法测定;单宁含量采用紫外分光光度法测定。
1.4 数据统计与分析
试验数据采用SPSS 26.0软件进行方差分析,采用Duncan氏法进行多组样本间差异显著性分析。P≤0.01表示差异极显著,P≤0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 菌种间拮抗关系的结果
由图1、2可知,划线处株菌生长状态良好,均未出现肉眼可见的菌落萎缩和消失现象,所以植物乳杆菌、黑曲霉、粪肠球菌、酿酒酵母各株菌间基本无拮抗作用。

图1 菌种拮抗试验结果Fig.1 Results of bacterial species antagonism test
2.2 发酵基料的优化
2.2.1 玉米粉添加量对复合益生菌发酵白酒糟的影响
由图3可知,与对照组相比,添加玉米粉极显著提高发酵白酒糟粗蛋白质含量(P<0.01),极显著降低了发酵白酒糟的中性洗涤纤维含量(P<0.01)和酸性洗涤纤维含量(P<0.01)。与对照组相比,粗蛋白质含量增长差异最显著的为3%组,其次为6%组和9%组,但3%组和6%组粗蛋白质含量差异不显著(P<0.05);与对照组相比,中性洗涤纤维含量下降差异最显著的为6%组,其次为3%组和9%组;酸性洗涤纤维含量下降差异最显著的为6%组,其次为9%组和3%组。随着玉米粉添加量的增加,活菌数呈现先上升后下降的趋势,当玉米粉添加量为6%时,发酵白酒糟活菌数达到最大值,极显著高于其他组(P<0.01)。综合考虑,复合益生菌发酵白酒糟中最佳玉米粉添加量确定为6%。

图2 菌种拮抗试验结果Fig.2 Results of bacterial species antagonism test

不同大写字母表示差异极显著(P≤0.01),不同小写字母表示差异显著(P≤0.05),无字母或相同字母表示差异不显著(P>0.05)。下图同。Different capital letters indicate extremely significant difference (P≤0.01),different lowercase letters indicate significant difference (P≤0.05),while no letter or the same letter indicate no significant difference (P>0.05).The same as below.图3 玉米粉添加量对复合益生菌发酵白酒糟的影响Fig.3 Effects of corn meal addition on distiller’s grains fermented by compound probiotics
2.2.2 麦麸添加量对复合益生菌发酵白酒糟的影响
由图4可知,与对照组相比,添加麦麸后发酵白酒糟粗蛋白质含量差异不显著(P>0.05),中性洗涤纤维含量除5%组极显著低于对照组(P<0.01)外,其余组均与对照组差异不显著(P>0.05),酸性洗涤纤维含量除了5%组与对照组差异不显著(P>0.05)外,其余组均极显著高于对照组(P<0.01)。随着麦麸添加量的增加,活菌数呈现先下降后上升的趋势,当麦麸添加量为5%时,发酵白酒糟活菌数达到最大值,显著高于对照组(P<0.05),极显著高于1%组和3%组(P<0.01)。综合考虑,复合益生菌发酵白酒糟中最佳麦麸添加量确定为5%。
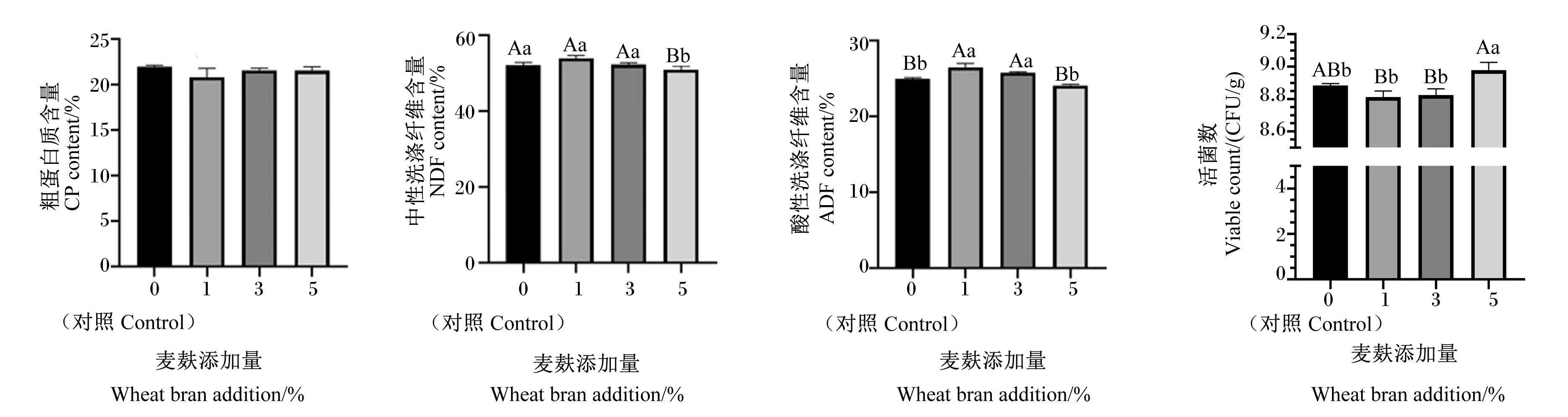
图4 麦麸添加量对复合益生菌发酵白酒糟的影响Fig.4 Effects of wheat bran addition on distiller’s grains fermented by compound probiotics
2.2.3 菜籽粕添加量对复合益生菌发酵白酒糟的影响
由图5可知,与对照组相比,除12%组显著提高发酵白酒糟粗蛋白质含量(P<0.05)外,剩余组粗蛋白质含量较对照组无显著差异(P>0.05);酸性洗涤纤维含量除12%组极显著降低(P<0.01)外,剩余组较对照组有所提高;所有添加菜籽粕组中性洗涤纤维含量较对照组有所提高,但差异不显著(P>0.05)。随着菜籽粕添加量的增加,活菌数呈现先上升后下降再急剧上升的趋势,当菜籽粕添加量为12%时,发酵白酒糟活菌数达到最大值,极显著高于其他组(P<0.01)。综合考虑,复合益生菌发酵白酒糟中最佳菜籽粕添加量确定为12%。
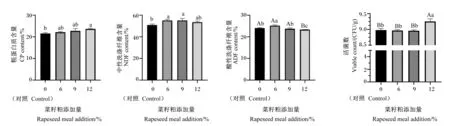
图5 菜籽粕添加量对复合益生菌发酵白酒糟的影响Fig.5 Effects of rapeseed meal addition on distiller’s grains fermented by compound probiotics
2.3 发酵条件的优化
2.3.1 发酵时间对复合益生菌发酵白酒糟的影响
由图6可知,随着发酵时间的延长,复合益生菌发酵白酒糟中的粗蛋白质含量、pH降低值呈现先增长后下降的趋势,其中在发酵第5天时,粗蛋白质含量达到最高点,其次为第7天,且发酵第5天与第7天粗蛋白质含量差异不显著(P>0.05)。在发酵第7天时,pH降低值达到最高点,其次为第5天,且发酵第7天与第5天的pH降低值差异不显著(P>0.05)。中性洗涤纤维和酸性洗涤纤维含量均呈现先下降再上升的趋势,其中在发酵第7天时,中性洗涤纤维含量达到最低点,其次为第5天,且发酵第7天与第5天中性洗涤纤维含量差异不显著(P>0.05)。在发酵第5天时,酸性洗涤纤维含量达到最低点。综合考虑,复合益生菌发酵白酒糟最佳发酵时间确定为5 d。

图6 发酵时间对复合益生菌发酵白酒糟的影响Fig.6 Effects of fermentation time on distiller’s grains fermentation by compound probiotics
2.3.2 发酵温度对复合益生菌发酵白酒糟的影响
由图7可知,不同温度发酵组中性洗涤纤维和酸性洗涤纤维含量差异不显著(P>0.05)。但随着发酵温度的升高,复合益生菌发酵白酒糟的粗蛋白质含量呈现先下降后升高的趋势,其中在37 ℃时粗蛋白质含量达到最高点,其次为28 ℃,且28 ℃组与37 ℃组粗蛋白质含量差异不显著(P>0.05)。复合益生菌发酵白酒糟后的pH降低值呈现先上升后下降的趋势,其中在30 ℃时pH降低值达到最高点,其次为28 ℃,且28 ℃组与30 ℃组pH降低值差异不显著(P>0.05)。综合考虑,复合益生菌发酵白酒糟最佳发酵温度确定为28 ℃。
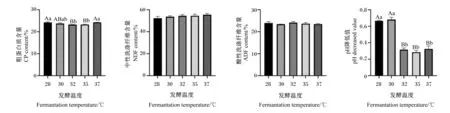
图7 发酵温度对复合益生菌发酵白酒糟的影响Fig.7 Effects of fermentation temperature on distiller’s grains fermented by compound probiotics
2.3.3 初始pH对复合益生菌发酵白酒糟的影响
由图8可知,随着发酵初始pH降低值的提高,复合益生菌发酵白酒糟的粗蛋白质含量、pH降低值、酸性洗涤纤维含量呈直线下降趋势,其中当初始pH 5时。粗蛋白质含量、pH降低值达到最高点,当初始pH 8时,酸性洗涤纤维含量达到最低点。随着发酵初始pH的提高,中性洗涤纤维含量呈先下降后上升的趋势,其中当初始pH 6时,中性洗涤纤维含量达到最低点,其次为初始pH 5组,且初始pH 6组与初始pH 5组中性洗涤纤维含量差异不显著(P>0.05)。综合考虑,复合益生菌发酵白酒糟最佳发酵初始pH确定为5。
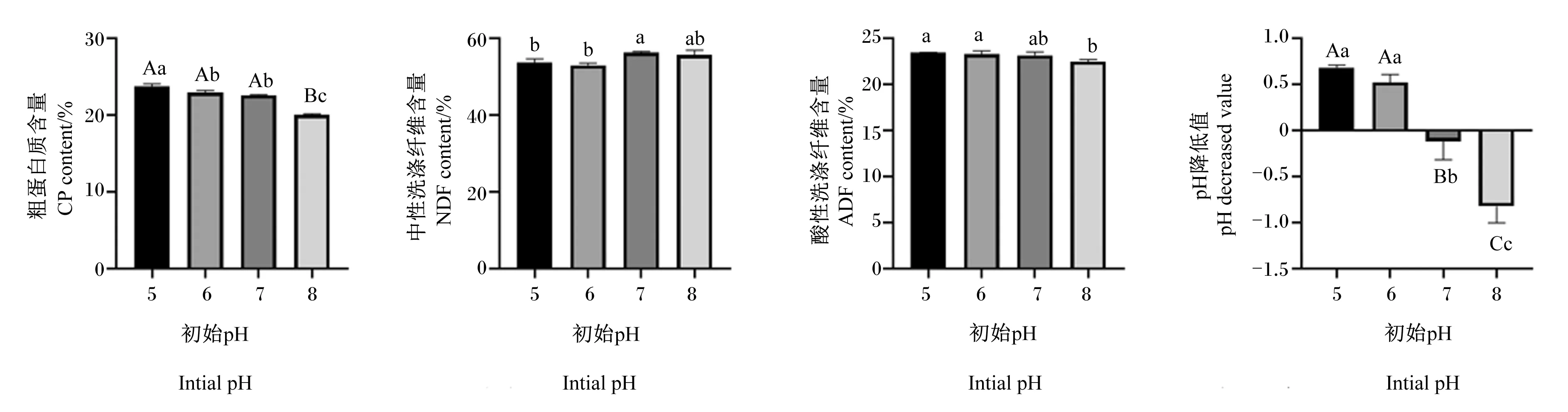
图8 初始pH对复合益生菌发酵白酒糟的影响Fig.8 Effects of initial pH on distiller’s grains fermented by compound probiotics
2.3.4 接菌量对复合益生菌发酵白酒糟的影响
由图9可知,随着接菌量的提高,复合益生菌发酵白酒糟的粗蛋白质含量、pH降低值大体呈先上升后下降再上升后下降的趋势,其中当接菌量为6%时,粗蛋白质含量达到最高点,其次为10%组,且6%组与10%组中性洗涤纤维含量差异不显著(P>0.05)。当接菌量为10%时,pH降低值达到最高点,其次为6%组,且6%组与10%组pH降低值差异显著(P<0.05)。随着接菌量的提高,复合益生菌发酵白酒糟的中性洗涤纤维、酸性洗涤纤维含量呈先下降后上升的趋势,其中当接菌量为8%时,中性洗涤纤维含量达到最低点,其次为10%组,且8%组与10%组中性洗涤纤维含量差异不显著(P>0.05)。当接菌量为6%时,酸性洗涤纤维含量达到最低点,其次为8%组、10%组,且6%组与8%组、10%组酸性洗涤纤维含量差异不显著(P>0.05)。综合考虑,复合益生菌发酵白酒糟最佳发酵接菌量确定为10%。
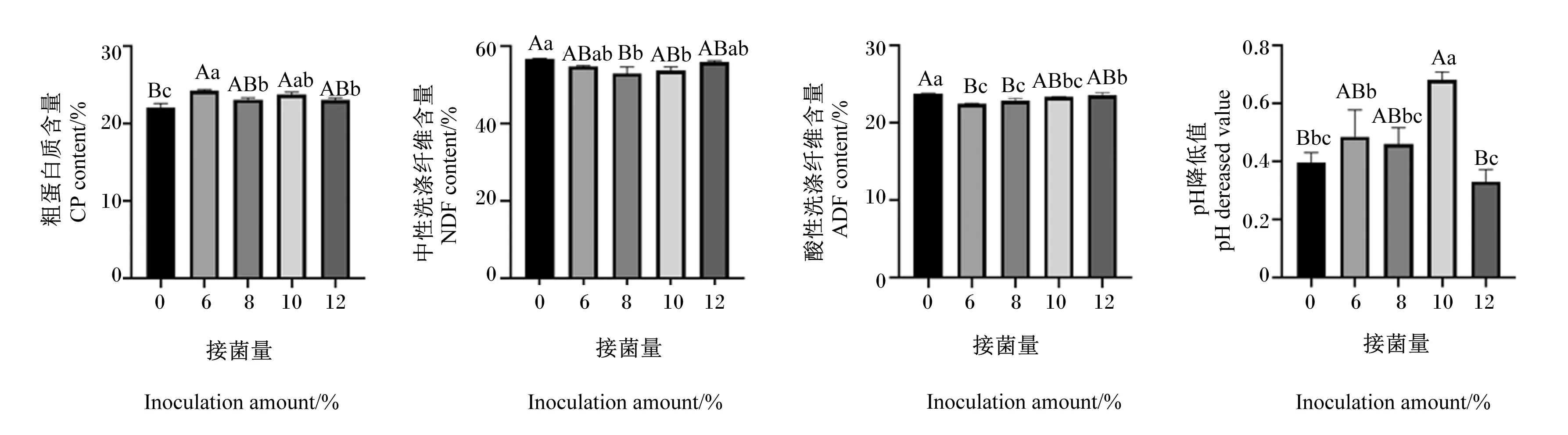
图9 接菌量对复合益生菌发酵白酒糟的影响Fig.9 Effects of inoculation amount on fermented distiller’s grains by compound probiotics
2.3.5 正交试验结果
在单因素试验基础上,设计关于初始pH、接菌量、发酵时间3个因素的L9(33)正交试验,以优化复合益生菌发酵白酒糟的发酵条件,结果见表2。
由表2可知,影响粗蛋白质含量的因素为:B>C>A,影响中性洗涤纤维含量的因素为:C>A>B;影响酸性洗涤纤维含量的因素为:A>B>C;影响pH降低值的因素为:A>B>C。以粗蛋白质、中性洗涤纤维、酸性洗涤纤维含量和pH降低值为指标时,得出的最优发酵条件分别为:A2B1C2、A2B1C3、A2B2C1、A3B3C2。

表2 正交试验结果与分析Table 2 Orthogonal test results and analysis
2.3.6 正交试验验证结果
由于A2B1C2、A3B3C2包含在表2中,所以只需要进行A2B1C3和A2B2C1组合试验即可确定最优发酵条件,结果见表3。4个优化组合中,A2B2C1组合粗蛋白质含量最高且中性洗涤纤维和酸性洗涤纤维含量最低,A3B3C2组合pH降低值最高。综合考虑,最终选择了A2B2C1(即初始pH为6、接菌量为8%、发酵时间为5 d)为复合益生菌发酵白酒糟的最优发酵条件,其粗蛋白质含量高于其余3组,中性洗涤纤维、酸性洗涤纤维含量低于其余3组,pH降低值适中。

表3 复合益生菌发酵白酒糟的最优发酵条件筛选Table 3 Screening of optimal fermentation conditions for distiller’s grains fermentation by compound probiotics
2.3.7 优化前后白酒糟品质的比较
由表4可知,与优化前白酒糟相比,经复合益生菌优化发酵后的白酒糟,粗蛋白质含量提高34.46%,中性洗涤纤维含量降低35.28%,酸性洗涤纤维含量降低54.02%。同时,白酒糟基料内菜籽粕抗营养因子硫代葡萄糖苷和植酸含量经复合益生菌优化发酵后分别降低22.92%和 22.19%。
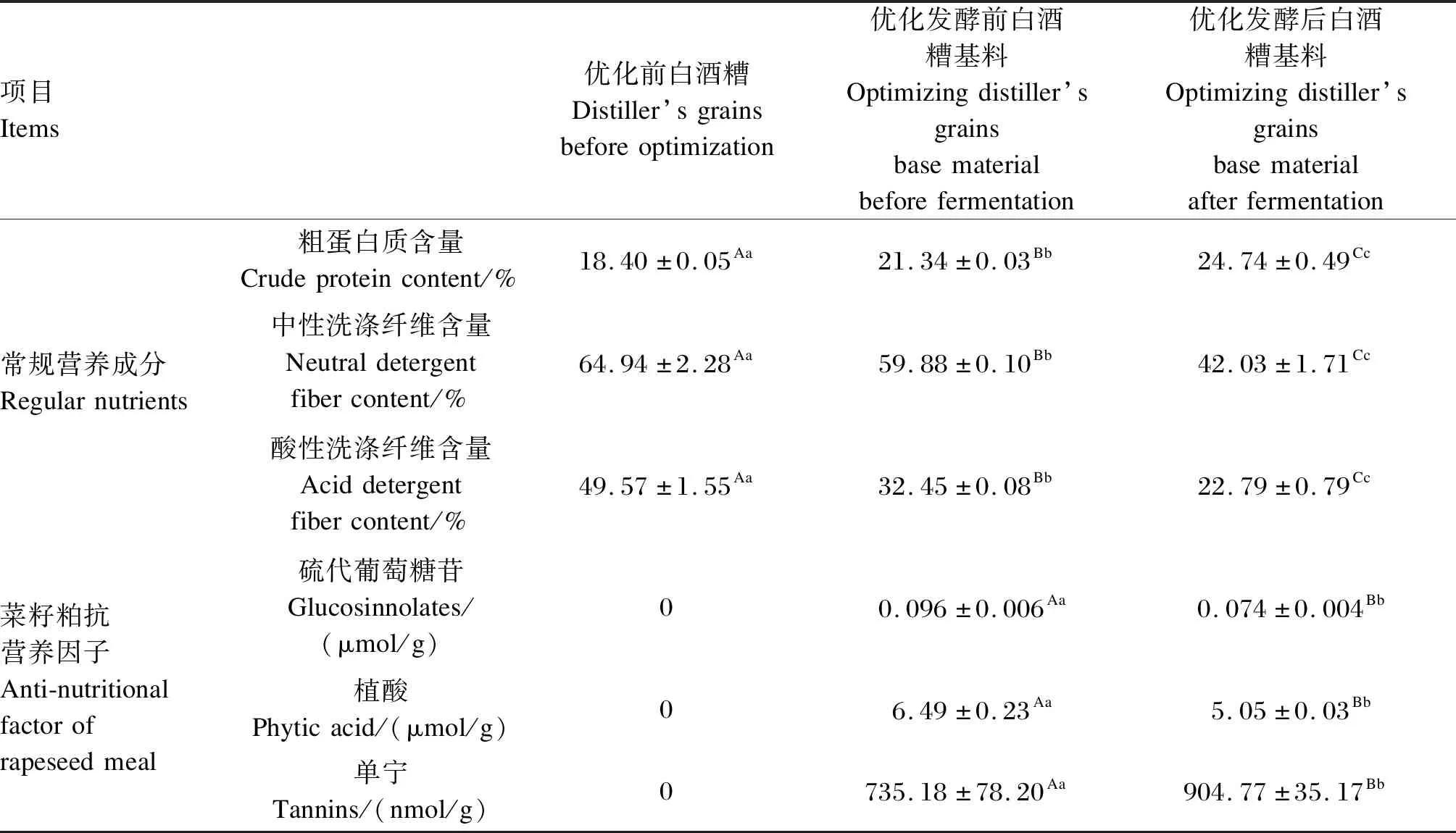
表4 白酒糟优化前后比较Table 4 Comparison of distiller’s grains before and after optimization
3 讨 论
3.1 发酵基料对白酒糟的影响
微生物正常生长繁殖、代谢及合成产物都需供给相应的营养,酒糟氮源含量丰富,但缺乏含碳物质,结合生产实际,本研究选用玉米粉和麦麸作为酒糟内补充碳源。菜籽粕是油菜籽加工后的副产品,粗蛋白质含量高达35%~45%,每年约产700万t[7]。然而,由于菜籽粕中含有硫代葡萄糖苷、植酸、单宁、粗纤维等抗营养因子,限制了菜籽粕的开发利用,目前利用微生物发酵以降解菜籽粕中的毒性物质为研究热点[8]。因此,本试验在添加玉米粉和麦麸的基础上,向酒糟内添加一定量的菜籽粕,以求进一步提高酒糟发酵品质,同时降低菜籽粕中的抗营养因子。本试验利用复合益生菌发酵白酒糟后发现,随着发酵基料的变化,白酒糟内各项指标发生变化,大体趋势为随着活菌数的增加,白酒糟内粗蛋白质含量升高,中性洗涤纤维和酸性洗涤纤维含量降低。张玉诚[9]利用复合益生菌发酵白酒糟,研究发现在白酒糟内加入10%麸皮和5%玉米粉时粗蛋白质含量从16.32%提高到24.34%,粗纤维含量从34.90%降解至20.06%。范恩帝等[10]研究酿酒酵母、产朊假丝酵母、植物乳杆菌等复合益生菌对白酒糟的影响,发现当麸皮添加量为10%时,酒糟粗蛋白质含量提高最多,当添加量为20%时,酒糟粗纤维含量降解率最高。宋善丹等[11]利用米曲霉、黑曲霉和酵母菌发酵白酒糟,发现当麦麸添加量达25%时,粗蛋白质含量增加22.32%,中性洗涤纤维和酸性洗涤纤维含量分别为25.23%和28.45%。本试验条件下,当玉米粉、麦麸和菜籽粕添加量分别为6%、5%和12%时,白酒糟的粗蛋白质含量由18.40%提高到23.68%,中性洗涤纤维含量由64.94%降低至53.63%,酸性洗涤纤维含量由49.57%降低至23.40%,与张玉诚[9]、范恩帝等[10]、宋善丹等[11]研究结果一致,且麦麸添加量与张玉诚[9]相比较低,进一步降低了发酵成本。本试验条件下,发酵基料内菜籽粕硫代葡萄糖苷含量降低22.92%,植酸含量降低22.19%,降解效果明显,但单宁含量由735.18 nmol/g增加到904.77 nmol/g。单宁含量过高时主要会影响饲料的适口性,降低饲料利用率,但适量单宁能防止反刍动物瘤胃中膨胀病的发生[12],本试验发酵基料内菜籽粕添加量仅为12%,且单宁含量在菜籽粕中较低,因此,发酵过程中单宁含量升高对白酒糟发酵饲料影响较小。但是本研究未对比各组基料发酵前后营养指标的变化情况,无法确定是发酵过程中益生菌起主要作用还是各组基料配方组合不同而影响各组营养指标的变化,因此存在不足之处,需要进一步试验确定。
3.2 发酵条件对白酒糟的影响
不同生长条件会对微生物的生长繁殖、代谢产物的合成和积累产生直接影响。发酵温度和pH会影响微生物的酶活性、生长代谢速度及其对各类营养元素的吸收[13];发酵时间和接种量会影响活菌数目进而影响发酵效果,发酵时间过长甚至会增加染菌机会[14]。司维江等[15]利用混菌发酵白酒糟的最佳发酵条件为38 ℃、55%含水量发酵5 d,该条件下白酒糟的真蛋白质含量显著提升。李虓等[16]利用3株枯草芽孢杆菌发酵白酒糟,最优发酵条件为接种量5%、34 ℃发酵5 d,发酵后粗蛋白质含量提高82.80%。刘鹏[17]利用混菌发酵白酒糟的最佳发酵条件为初始含水量40%,初始pH 5.5,发酵时间5 d,酒糟粗蛋白质含量提高了48.83%。本试验利用黑曲霉、粪肠球菌、植物乳杆菌、酿酒酵母固态发酵白酒糟,利用单因素试验和正交试验进行优化,最终确定最优发酵条件为初始pH为6、接种量为8%、发酵时间为5 d,与发酵前白酒糟基料相比,粗蛋白质含量提高15.93%,中性洗涤纤维含量降低29.81%,酸性洗涤纤维含量降低28.04%,与司维江等[15]、李虓等[16]、刘鹏[17]研究结果一致。该条件下,发酵白酒糟中粗蛋白质含量为24.74%,中性洗涤纤维含量为42.03%,酸性洗涤纤维含量为22.79%,pH降低为0.745。
4 结 论
复合益生菌发酵白酒糟能有效改善白酒糟的发酵品质,结合粗蛋白质、中性洗涤纤维和酸性洗涤纤维含量、活菌数等指标综合分析得出:
① 本试验条件下,复合益生菌发酵白酒糟的最优发酵基料组合为77%白酒糟+6%玉米粉+5%麸皮+12%菜籽粕。
② 最优发酵条件为发酵初始pH 6、接种量8%、发酵时间5 d。该发酵条件有效改善白酒糟的发酵品质,有效降低发酵基料中菜籽粕的硫代葡萄糖苷、植酸含量,为白酒糟及菜籽粕的开发利用提供一定的理论依据。
