维生素C有效期的快速测定
2023-02-08王晓辉史小琴庄文昌董黎明李靖蔡可迎
王晓辉*,史小琴,庄文昌,董黎明,李靖,蔡可迎
徐州工程学院材料与化学工程学院(徐州 221111)
物理化学动力学是药物配方设计、制剂稳定性评价、药代动力学研究与药物有效期预测的理论基础。药物有效期的预测方法有留样观察法和经典加速法。前者于室温储存至失效,需要至少1年。经典加速法采用加热加速分解反应,可以缩短测定的时间,代表性的案例如阿司匹林有效期的测定[1-2]*。维生素C是药食同源的水溶性营养补充剂,在生活环境中不太稳定,分解产物较多[3-4]*。以维生素C水溶液为研究对象,针对复杂反应体系,以导数光谱为依据,消除共存组分对维生素C测定中的背景干扰,测定维生素C的含量,为推动维生素C的应用研究提供依据。
1 材料与方法
1.1 试验原理
阿司匹林的水解反应仅为一步[1-2]*,还原型维生素C(抗坏血酸,AA)的降解途径、过程和产物随外界条件有所不同。在15~95 ℃、pH 3.2~8.6,较为公认地遵循一级反应模型,可能的主要产物有氧化型维生素C(脱氢抗坏血酸,DHA)、糠醛类物质(F,包括糠醛、5-羟甲基糠醛)、2, 3-二氧代-L-古洛糖酸(DKA)[4-6]*。根据Arrhenius定律,随着温度的降低,生成上述产物的各步反应活性逐渐减弱,温度降低至室温附近时,以AA与DHA之间的可逆转化为主[4,*7]*,见图1。

图1 AA的降解途径和产物
研究表明,AA、DHA、DKA与F的吸收分别位于紫外光区的190~320,190~255,190~240与190~320 nm[8-10]*。在AA的最大紫外吸收波长266 nm处,干扰测定的只有F。在试验中发现,随着温度的降低,生成F的速率有降低趋势,温度降至40 ℃时,F不再生成,以此寻找到能消除F对AA在266 nm处产生干扰的上临界温度,这使AA简便、准确、快速定量并预测有效期成为可能。
AA降解的一级反应速率方程为:

式中:CAA为AA在时间t时的质量浓度,mg/mL;t为反应时间,min;K为表观反应速率常数,min-1*。
对式(1)积分得到:

式中:C0为AA的初始质量浓度,mg/mL;A0、At为反应液在初始和时间t时266 nm处的吸光度。
将ln(At/A0)对t作图,得一直线,直线的斜率为反应速率常数K。同理可以得到不同温度时的对数吸光度-时间关系曲线(式3)。

依据Arrhenius方程由拟合直线斜率得到的lnK对1/T作图。将式(3)外推至298.15 K即可计算25 ℃时的表观反应速率常数值。
根据一级反应的有效期公式τ0.9=ln 10/9/(K298.15K)计算出AA的有效期。
1.2 仪器和试剂
恒温水浴6套,紫外分光光度计1台,分析天平1台,50 mL烧杯1只,超声波仪1台,秒表5块,100 mL磨口锥形瓶5套,移液枪5只,1 000 mL容量瓶1套。AA标准品。
1.3 试验方法
准确称取7.0 mg AA标准品于蒸馏水中超声溶解并定容于1 000 mL容量瓶,配成0.007 0 mg/mL AA的标准溶液,以蒸馏水为空白对照,测定其吸光度,同时作为反应液,冷藏现用。
将0.007 0 mg/mL AA水溶液分装于100 mL磨口锥形瓶内,用保鲜膜套住塞好瓶塞的瓶口,并用橡皮筋固定(防止瓶塞受压弹出)后,分别置于恒温水浴中,静置,计时进行加速试验。
每隔10 min取样1次,将石英样品池迅速放入冰水中冷却1 min,以终止反应。测定反应液的吸光度。
2 数据记录及处理
在反应60 min时,采用Origin 8.0软件绘制所测不同温度的AA水溶液的相对吸光度-波长及其一阶、二阶导数关系曲线。由图2(a)可见,在300~360 nm左右为分光光度计的紫外、可见光源信号切换区,所测吸光度不太稳定。由图2(b)可见,在50 ℃和60 ℃时,AA的紫外吸收主峰区域(220~300 nm)的一正一负的一次导数峰有2个,位于220~275 nm和275~300 nm,说明重叠峰个数为2,分别对应于AA和F(糠醛、5-羟甲基糠醛中的一种)。随着反应温度的降低,到40 ℃时,后者消失。对比图2(c)发现,相应区域处不规则的二正一负的二次导数峰也消失。这是因为F(糠醛、5-羟甲基糠醛)的特征吸收波长在276 nm和284 nm[10]*,与AA在266 nm的中心峰位不重合,并且在所研究区域具有完整的紫外吸收峰,导数峰的消失提示反应液中F的浓度为0,继续降低温度,F不再生成,不再对266 nm处AA的测定产生干扰。过低的温度也不利于保证适宜的反应速率和更好地控制反应液浓度,试验温度选择在30~40 ℃之间进行。
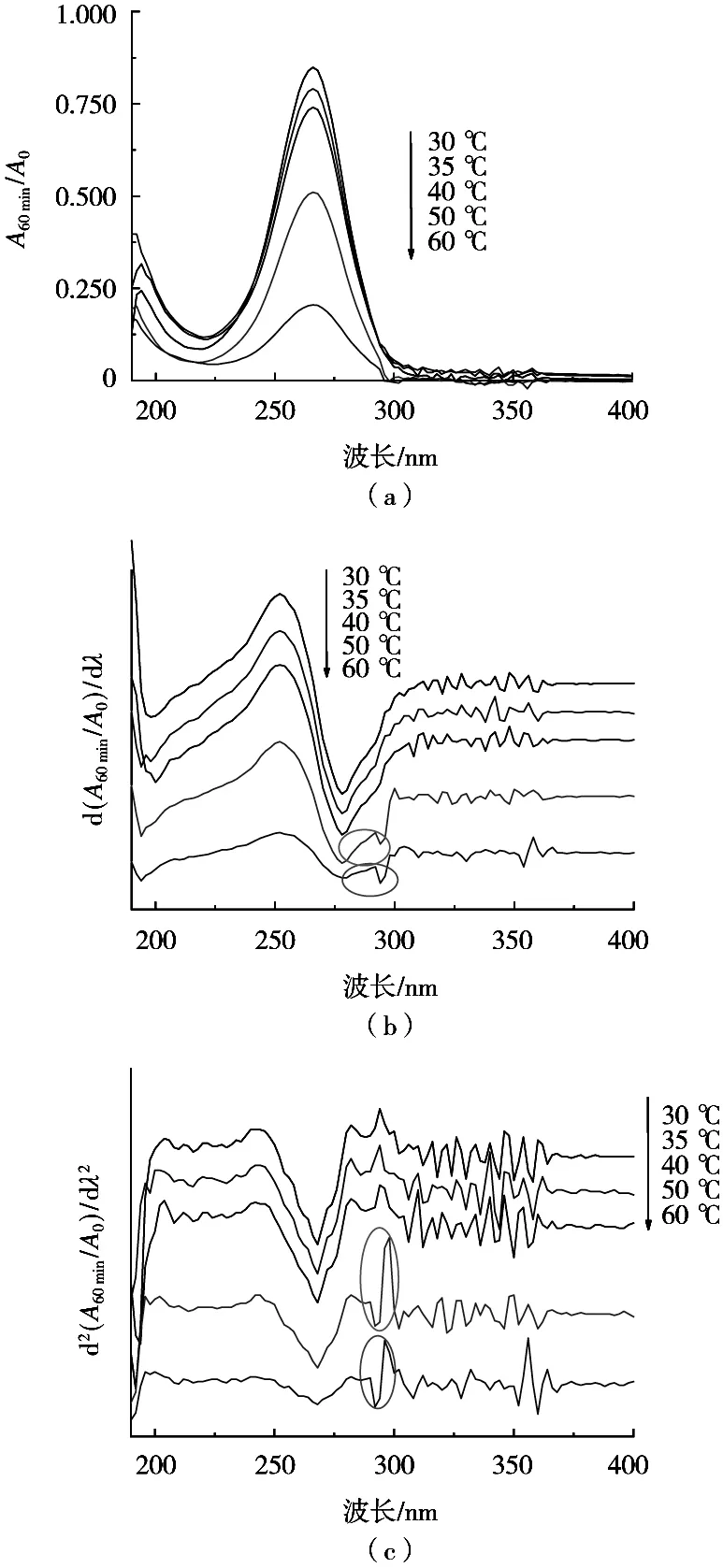
图2 AA水溶液的紫外光谱(a)、一阶(b)和二阶(c)导数光谱
记录不同温度的AA反应液在266 nm波长处的吸光度,见表1,并计算在时间t时的ln(At/A0)。
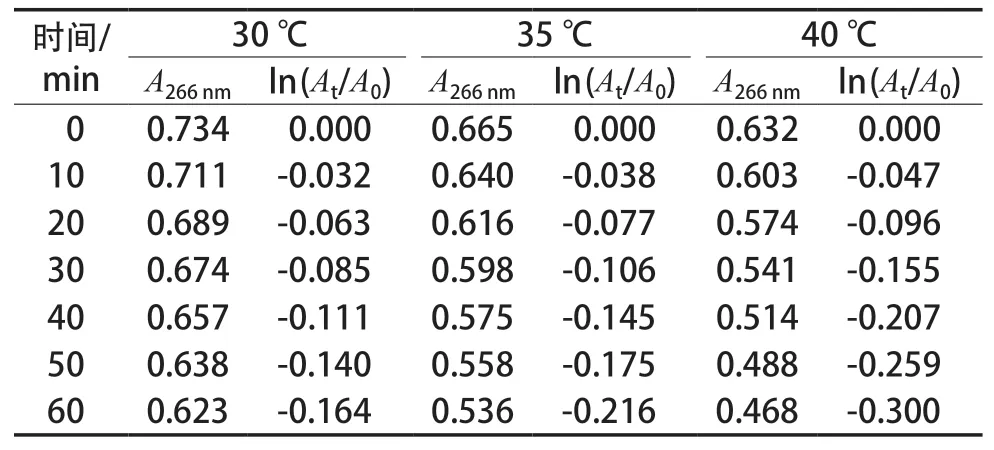
表1 反应液中AA在266 nm的吸光度和ln(At/A0)
将表1的ln(At/A0)对t作图,可以得到不同温度时的对数吸光度-时间关系曲线,如图3所示。结果显示,30,35和40 ℃的表观反应速率常数分别为0.002 3,0.003 4和0.005 0 min-1*。
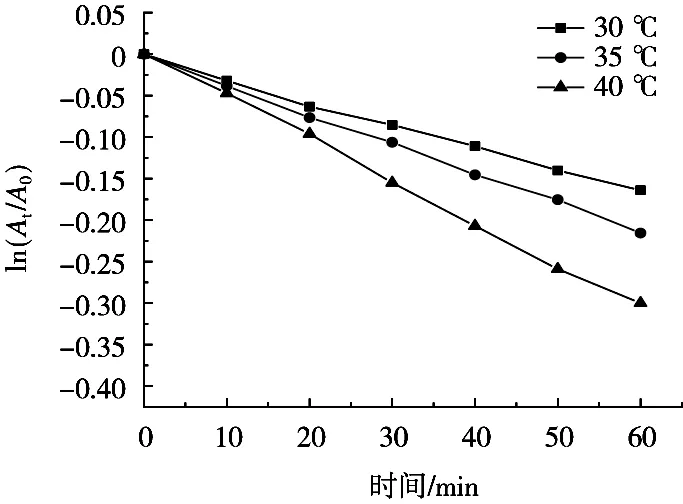
图3 ln(At/A0)和t的关系
由拟合直线斜率得到的lnK对1/T作图,如图4所示。拟合直线的线性回归系数R2*为0.997,能很好地吻合Arrhenius方程,将式(3)外推至298.15 K即可计算25 ℃时的表观反应速率常数值,K298.15K为0.001 8 min-1*。
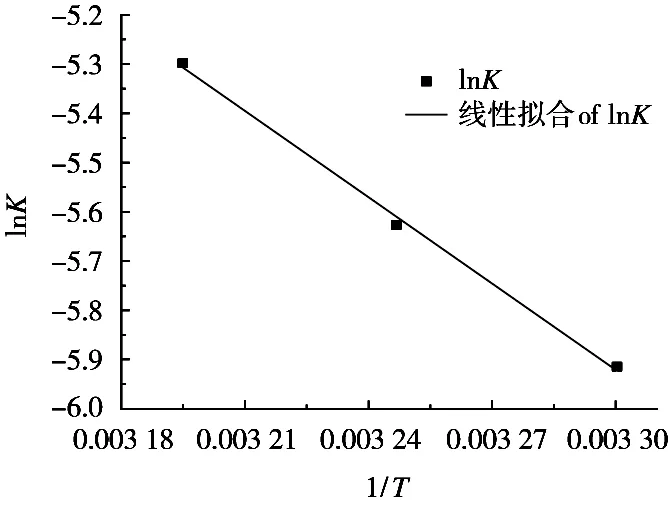
图4 lnK和1/T的关系
根据一级反应的有效期公式τ0.9=ln 10/9/(K298.15K),计算出AA水溶液在25 ℃时的有效期τ0.9为68.7 min,约1.1 h。
3 结论
以导数光谱为依据,消除F在AA的最大紫外吸收波长266 nm处的背景吸收对AA定量测定的干扰,确定试验温度30~40 ℃。采用经典加速法测定AA的分解速率常数,根据Arrhenius公式,计算AA在25 ℃时的有效期约1.1 h。所建的降解动力学理论模型较为理想。经试验证实,该设计不需大型仪器设备,方法简单、准确、节约、高效,结果与实际吻合。结合分解途径看,试验对AA的配方设计和贮存环境的选择具有指导意义。
