外源蛋白对白鲢鱼糜肌原纤维蛋白结构及其结合特征腥味物质能力的影响
2023-02-07王玉栋
严 浩,王玉栋,钟 武,庄 洋,杨 宏,
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
白鲢具有较高的营养价值,且其价格低廉易养殖,常被用来制作鱼糜,但由于脂肪氧化、酶促反应的影响,会产生难闻的腥味,已有多项研究证明己醛、壬醛和1-辛烯-3-醇是鲢鱼腥味的主要来源[1-3]。目前已有许多方法用于水产品腥味的去除,如活性炭吸附等物理方法[4],双氧水漂洗、酸碱漂洗等化学方法[5-6],以及生物发酵去腥[7],但前者更适用于液体以及气体,化学方法去腥则可能导致鱼糜中化学成分发生改变,生物发酵去腥则会使蛋白变性使水产品的理化性质发生改变[2]。
大豆分离蛋白(soy protein isolate,SPI)、蛋清蛋白(egg white protein,EWP)、乳清分离蛋白(whey protein isolate,WPI),由于其多种功能特性(如起泡性、凝胶性、黏着性等),被广泛的应用于鱼糜凝胶中。研究表明,一定pH值下,WPI含量的增加能增强对己醛、1-辛烯-3-醇的结合[8];汪娟[9]研究发现,SPI对己醛、壬醛具有较好的结合能力,但会增强1-辛烯-3-醇的释放;而有关EWP对挥发性风味物质结合能力的研究较少。挥发物质与蛋白质的结合主要通过可逆的疏水相互作用,其他的结合方式包括氢键、范德华力、离子键以及不可逆的化学共价交联,如醛酮类物质主要与蛋白质的疏水区域通过疏水相互作用结合,而醇类物质则可通过氢键与蛋白质的羟基发生可逆结合[10]。另外不同种类蛋白质对风味物质的结合能力也存在差异,如小麦蛋白对醛酮类物质的结合能力远高于油菜蛋白以及豌豆蛋白[11]。
目前已有关于肌原纤维蛋白(myofibrillar protein,MP)结合己醛、壬醛、1-辛烯-3-醇的研究,MP浓度[12]、pH值[13-14]、盐离子强度及种类[15]、蛋白氧化[16]、外源添加物[2]等因素均可对其结合能力产生影响,如在Xue Chao[17]和Zhang Huimin[2]等的研究中发现,酵母β-葡聚糖可通过提升白鲢MP结合己醛、壬醛、1-辛烯-3-醇的能力抑制白鲢的腥味。而有关于外源蛋白对MP的研究,多是集中于凝胶性能的研究,有关外源蛋白对MP结合腥味物质能力的研究鲜有报道。本研究通过顶空固相微萃取-气相色谱-质谱研究SPI、EWP、WPI添加量对白鲢鱼糜MP结合己醛、壬醛、1-辛烯-3-醇能力的影响,并探究不同外源蛋白添加量下MP结构变化与其结合能力的关系,可为调控白鲢鱼糜的腥味提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
冷冻白鲢鱼糜(AA级) 洪湖市井力水产食品股份有限公司;SPI 河南万邦实业有限公司;EWP安徽省亳州市众意蛋业有限责任公司;WPI 美国希尔玛奶酪公司;己醛、壬醛、1-辛烯-3-醇(均为色谱级)上海源叶生物科技有限公司;甲醇(色谱级) 德国CNW科技有限公司。
1.2 仪器与设备
XHF-DY高速分散器 宁波新芝生物科技股份有限公司;X-30RC高速离心机 美国Beckman Coulter公司;UV-1700紫外-可见分光光度计 日本岛津公司;F-4600荧光光谱仪 日本日立公司;ZS90纳米粒度电位分析仪 英国Malvern公司;7000D气相色谱-质谱联用仪、HP-5色谱柱(30 m×0.25 mm,0.25 μm)美国Agilent公司;50/30 μm DVB/CAR/PDMS纤维萃取头美国Supeleo公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 MP提取
参考Fan Mingcong等[18]的方法略作修改。称取2.5 g鱼糜,加入4 倍体积低盐缓冲液(0.05 mol/L NaCl、3.38 mmol/L NaH2PO4、15.5 mmol/L Na2HPO4,pH 7.5),9000 r/min均质1 min,4 ℃静置15 min,4 ℃、10000 r/min离心10 min,重复提取3 次,取沉淀。将沉淀溶于4 倍体积的高盐缓冲液(0.45 mol/L NaCl、3.38 mmol/L NaH2PO4、15.5 mmol/L Na2HPO4,pH 7.5),9000 r/min均质1 min,4 ℃放置22 h后12000 r/min离心10 min(4 ℃),取上清液用10 倍体积的冷凝水沉淀30 min,10000 r/min离心10 min(4 ℃),取沉淀用15 mL溶解液溶解(0.6 mol/L NaCl、20 mmol/L Tris-HCl、pH 7.5),即得MP溶液。
1.3.1.2 样品溶液制备
参考Xue Chao[17]和夏培浩[19]等的方法略作修改。将MP稀释至4 mg/mL,向溶液中添加溶解好的SPI、EWP、WPI 4 ℃条件下用溶解液溶解12 h后,离心取上清液,使其添加量为MP的2%、4%、6%。
1.3.1.3 特征腥味物质溶液制备
将己醛、壬醛和1-辛烯-3-醇标准品用少量色谱级甲醇溶解,混匀后用超纯水稀释,使三者的质量浓度分别为0.5、0.1、0.5 g/100 mL,用棕色小瓶保存待用。
1.3.2 分析检测
1.3.2.1 表面疏水性
参考Jia Na等[20]的方法略作修改。取1 mL 4 mg/mL的MP悬浮液添加200 μL 1 mg/mL溴酚蓝(bromophenol blue,BPB),混合均匀后室温下反应2 h,6000 r/min离心15 min(4 ℃)。将上清液用溶解液稀释10 倍,在波长595 nm处测定吸光度,每个样品测定3 次平行。BPB结合量按式(1)计算:
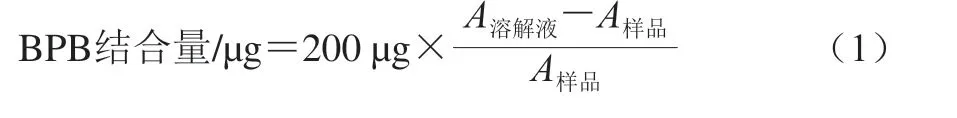
式中:A溶解液为溶解液的吸光度;A样品为样品的吸光度。
1.3.2.2 浊度
将MP质量浓度调节至1 mg/mL,采用紫外分光光度计在波长350 nm处测量透过率(T),每个样品测定3 次平行,按式(2)计算浊度[21]:

1.3.2.3 粒径和Zeta电位
参考Zheng Jiabao等[21]的方法略作修改。将MP稀释至0.1 mg/mL和0.01 mg/mL,纳米粒径电位分析仪分别测定样品的粒径以及电位。样品粒径在25 ℃通过配备4 mW氦/氖激光器的动态光散射测量,波长输出为633 nm,并在173°的检测角下进行反向散射校准。Zeta电位在25 ℃下使用电泳迁移率池(DTS1070)测定。每个样品测定3 次平行。
1.3.2.4 内源荧光光谱
参考Liu Qian等[22]的方法略作修改。将MP稀释至0.1 mg/mL,转移至光程为1 cm的石英比色皿,使用荧光光谱仪进行测定。样品在波长280 nm处被激发,发射光谱在300~400 nm范围内记录,激发和发射狭缝的宽度均为5 nm的固定值,扫描速率为60 nm/min,电压为400 V。每个样品测定3 次平行。
1.3.2.5 紫外全扫描
参考Wang Yu等[23]的方法略作修改。将MP稀释至0.3 mg/mL,转移到光程为1 cm的石英比色皿,采用紫外分光光度计在波长230~400 nm内进行测定。每个样品测定3 次平行。
1.3.2.6 顶空固相微萃取-气相色谱-质谱
参考An Yueqi等[1]的方法略作修改。取5 mL样品溶液于15 mL顶空瓶中,并添加5 μL配制好的特征腥味物质溶液,4 ℃放置12 h后,采用气相色谱-质谱法进行分析。40 ℃平衡10 min后采用50/30 μm DVB/CAR/PDMS萃取头顶空吸附30 min,将萃取头插入气相色谱进样口,250 ℃解吸5 min。
气相色谱条件:H P-5 毛细管色谱柱(30 m×0.25 mm,0.25 μm);升温程序最初为40 ℃,保持4 min,之后以4 ℃/min的恒定速率升温至250 ℃,保持2 min。进样口温度为250 ℃,载气为氦气,流量为恒定速率1.0 mL/min,采用不分流模式进样。
质谱条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;检测器温度250 ℃;气质接口温度280 ℃;检测器电压1.2 kV;扫描范围40~350 u,扫描速率2.0 scans/s。
MP对腥味物质的结合能力用游离挥发性化合物的百分比表示,每个样品测定3 次平行,按式(3)计算:
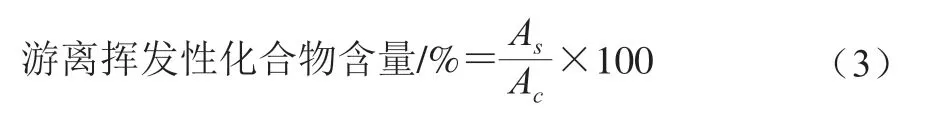
式中:Ac为MP挥发性化合物的峰面积;As为添加不同质量浓度外源蛋白后挥发性化合物的峰面积。
1.4 数据处理
采用Microsoft Excel 2018整理数据,IBM SPSS Statistics 26进行显著性分析,Origin 2017进行绘图。
2 结果与分析
2.1 外源蛋白对肌原纤维蛋白表面疏水性的影响
Bertsch等[24]的研究中证明BPB分子可以与蛋白表面的疏水位点结合,因此可通过BPB结合量表征白鲢鱼糜MP表面疏水性的变化。如图1所示,外源蛋白添加量增加,MP的BPB结合量先增大后减小,添加4% SPI、2% EWP和4% WPI时MP的BPB结合量显著高于组内其余样品(P<0.05),表明此添加量下样品具有最大的表面疏水性,MP解折叠程度最大。表面疏水性的增强可归结于外源蛋白与MP产生的相互作用,Herrero等[25]的研究中SPI可以减少MP中α-螺旋的含量,促使MP展开,暴露出更多的疏水基团,同样一定量的EWP也能够促进MP的展开[26]。表面疏水性的下降可能是由于当蛋白浓度超过一定临界限时,不同大分子蛋白由于其大分子质量以及热力学不相容性,容易发生相分离形成单独的相,从而使蛋白的疏水位点被包埋[27]。另外,相较于其他2 组样品,添加EWP的样品BPB结合量更低,这是因为蛋清蛋白中主要的蛋白质卵白蛋白的疏水性氨基酸残基均位于蛋白的内部[28]。
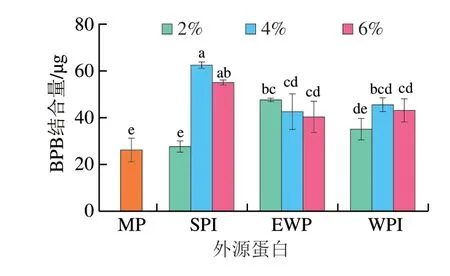
图1 外源蛋白对MP BPB结合量的影响Fig.1 Effects of external proteins on the BPB binding ability of MP
2.2 外源蛋白对肌原纤维蛋白浊度的影响
如图2所示,在添加SPI、EWP、WPI后,样品的浊度皆大于对照组,这与蛋白质聚集体的存在有关,表明可能形成了不溶性聚集体,降低了溶解度,这是由于蛋白内部疏水性氨基酸残基的暴露,蛋白之间的疏水相互作用增强,从而导致MP的聚集程度加深[13]。研究表明非共价相互作用力是蛋白质聚集的直接驱动力,疏水基团的暴露有助于蛋白质的聚集[22],在Shen Hui等[13]的报道中,在pH 5~7的范围内,pH值可增强MP表面疏水性,MP溶液的浊度随之上升。可以看到添加SPI、WPI的样品浊度变化规律与图1表面疏水性的结果一致,而对于添加EWP的样品,随着蛋白添加量的增加,样品的浊度变化较小,这可能是由于蛋白的进一步展开导致α-螺旋减少,蛋白内部的氢键遭到破坏,暴露出蛋白表面的氢键结合位点,水分子羟基通过氢键增强与蛋白质之间的相互作用,两者的亲和力增强,形成的聚集体更容易溶解在溶液中[29-30]。
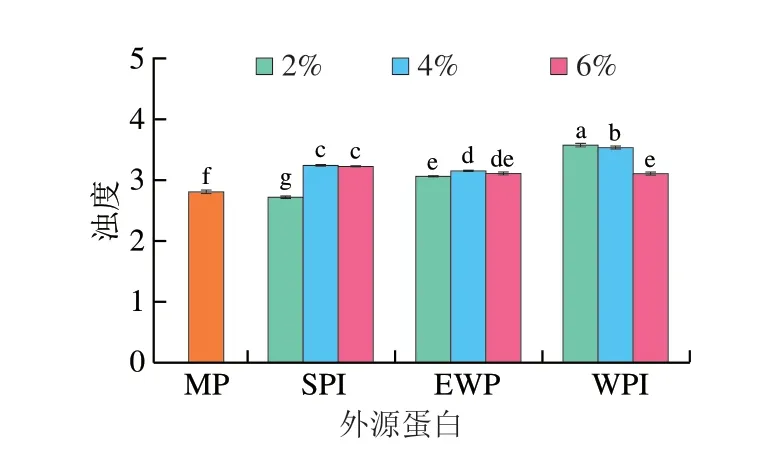
图2 外源蛋白对MP浊度的影响Fig.2 Effects of external proteins on the turbidity of MP
2.3 外源蛋白对肌原纤维蛋白平均粒径的影响
粒径的大小与蛋白分子内或分子间的交联相关,而疏水相互作用增强有助于蛋白分子的交联以及聚集体的形成,另外蛋白质分子间的静电相互作用也与蛋白质聚集体的形成有关[13]。如图3所示,随着外源蛋白添加量的增加,MP的平均粒径呈现先上升后下降的趋势,其中添加4% SPI、2% EWP、2% WPI的样品平均粒径显著高于组内其余样品(P<0.05),可归结于显著增加的表面疏水性引起了蛋白之间的强相互作用使蛋白质聚集程度增加,而粒径的减小则是由于蛋白分子之间的静电引力不足,使蛋白分子的聚集程度降低[13]。另外,当外源蛋白添加过多时,不同大分子蛋白由于其大分子质量以及热力学不相容性,会使不同的蛋白质自聚集形成单独的相,此时蛋白质的粒径也会有所降低[31]。
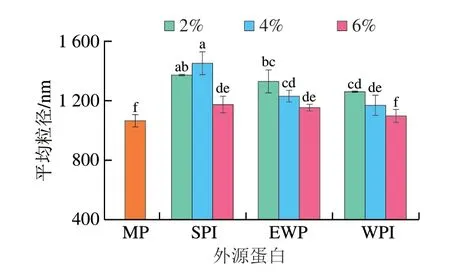
图3 外源蛋白对MP平均粒径的影响Fig.3 Effects of external proteins on the average particle size of MP
2.4 外源蛋白对肌原纤维蛋白Zeta电位的影响
蛋白质的分散、聚集均会影响其表面电荷的变化[13]。如图4所示,所有样品的Zeta电位值均为负值,表明蛋白表面均带负电荷。3 种混合溶液的Zeta电位随着外源蛋白添加量的增加先增大后减小,在SPI、EWP、WPI添加量分别为4%、2%、4%时,样品的Zeta电位显著高于组内其余样品(P<0.05)。Zeta电位增加,表明蛋白分子间的静电引力大于静电斥力,此时的静电相互作用能够促使蛋白质分子发生聚集;而随外源蛋白添加量进一步增加,MP的Zeta电位显著降低(P<0.05),此时蛋白分子间静电斥力更大,分子间静电斥力会降低蛋白质间的聚集度[21],进一步解释了图3中外源蛋白添加过量后蛋白分子平均粒径有所下降的现象。
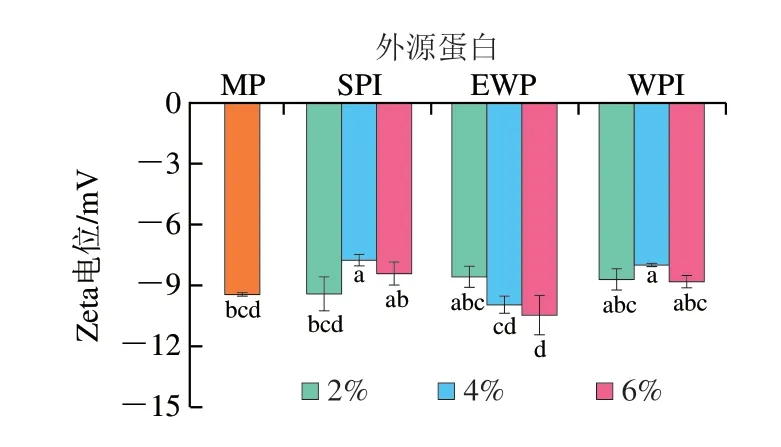
图4 外源蛋白对MP Zeta电位的影响Fig.4 Effects of external proteins on the zeta potential of MP
2.5 外源蛋白对肌原纤维蛋白内源荧光强度的影响
内源荧光光谱对色氨酸残基所处微环境的极性变化极其敏感,是评价蛋白分子三级结构变化的重要方法,通常蛋白在折叠状态下,色氨酸残基处于蛋白质内部的疏水环境中,蛋白溶液具有较高的荧光强度,此时,蛋白质表面具有较多的亲水基团,表面疏水性较低[22,32]。如图5所示,添加4% SPI的样品荧光强度明显低于组内其余样品,最大吸收峰略微红移,这表明SPI添加量为4%时能够促进MP展开,色氨酸残基暴露到更加亲水的环境中[22],这与图1表面疏水性的结果一致。而添加EWP后,MP的荧光强度明显降低,但随着添加量的增加MP荧光强度的变化并不明显,表明EWP能够促使MP展开,但其含量的增加对MP三级结构的影响不大。而对于添加WPI的样品,随着WPI添加量的增加,蛋白溶液的荧光强度呈现先下降后上升的趋势,WPI添加量为4%时具有最低的荧光强度,此时由于蛋白展开,暴露出的色氨酸基团引起了荧光猝灭现象;添加量继续增大,MP的荧光强度明显下降,其最大吸收峰略微蓝移,表明蛋白质发生聚集,色氨酸残基被重新包埋进蛋白内。
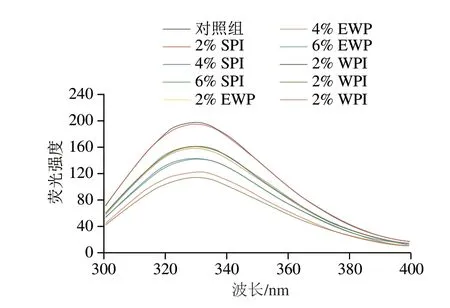
图5 外源蛋白对MP内源荧光强度的影响Fig.5 Effects of external proteins on the intrinsic fluorescence intensity of MP
2.6 外源蛋白对肌原纤维蛋白紫外吸收光谱的影响
紫外吸收光谱能够识别3 种芳香族氨基酸残基(苯丙氨酸、色氨酸、酪氨酸),尤其是酪氨酸残基所处微环境的变化,可用来辨别蛋白质的构象变化[23]。由图6可知,所有样品均在波长275 nm左右观察到吸收峰,表明酪氨酸的存在[33]。而在添加SPI、EWP以及WPI后,样品溶液的吸光度均高于对照组,表明外源蛋白能促进MP展开,暴露出更多酪氨酸残基。此外,随着SPI添加量的增加,MP最大吸收峰略微蓝移,表明SPI与MP之间产生相互作用促使酪氨酸残基所处环境的极性增加。MP的内源荧光光谱以及紫外吸收光谱的结果表明,外源蛋白的添加能使色氨酸、酪氨酸残基所处环境的极性增强,表明外源蛋白能够促使MP展开。
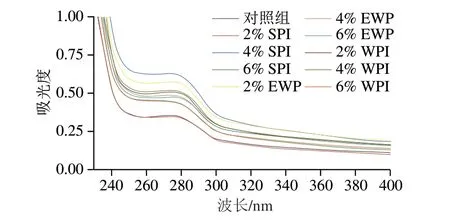
图6 外源蛋白对MP紫外吸收光谱的影响Fig.6 Effects of external proteins on the UV absorption spectrum of MP
2.7 外源蛋白对肌原纤维蛋白结合特征腥味物质能力的影响
如图7A、B所示,MP溶液中游离己醛、壬醛含量变化基本一致,随着外源蛋白添加量的增大,MP溶液中己醛、壬醛的含量均呈现先减小后增大的趋势,添加量为4%时,溶液中游离的己醛、壬醛含量显著低于组内其余样品(P<0.05),仅添加6% EWP的样品在组内具有最大的壬醛结合能力,表明3 种外源蛋白均能增强MP对己醛、壬醛的结合能力。通常,蛋白对醛类物质的结合能力与其表面疏水性呈正相关,其结合能力的增强可归结于蛋白展开暴露出更多的疏水结合位点[10]。而图1和图5显示,随着外源蛋白添加量的增加,MP展开,蛋白的表面疏水性增强,醛类物质与暴露出来的疏水位点以及巯基相结合,此时释放出的己醛、壬醛的含量显著降低。而随着添加量的进一步增大,MP对己醛、壬醛的结合能力下降,这可归结于蛋白分子由于相分离而发生自聚集,疏水基团重新嵌入蛋白中,从而导致MP表面疏水性下降所致。图3、5显示:外源蛋白添加量过高时,蛋白质的聚集程度增大,但粒径反而减小,在Sow等[31]的研究中,这是由于相分离导致的自聚集造成的,此时疏水基团被重新包埋,不利于MP与风味物质的结合。此外,由于相分离的发生,外源蛋白会作为惰性填料填充在MP蛋白之间,这可能会阻碍蛋白质间的静电相互作用,从而减小挥发性物质与蛋白质之间的离子相互作用,使通过静电相互作用结合的挥发性物质重新释放出来[27,34],而图4中Zeta电位的下降也证实了这一结论。
另外,在同样的处理条件下,MP对壬醛的吸收效果明显高于己醛,这与Xue Chao等[17]的研究一致。研究表明,较大风味分子的结构所产生的构象阻碍效应,可以阻止庚醛和辛醛靠近蛋白的疏水结合位点,降低蛋白与两者的亲和力[35]。与此类似,MP对己醛的结合量较之壬醛更低,可能归因于壬醛化学结构所产生的构象阻碍效应。另外,有研究表明MP对碳链更长的醛类有更好的结合效果,其结合能力的增强是由于长链醛类与蛋白质产生的疏水相互作用更强[14]。
如图7C所示,MP对醇类物质的结合能力通常与氢键以及弱疏水相互作用相关,EWP、WPI添加量增加,MP溶液中游离1-辛烯-3-醇的含量随之降低,表明MP结合1-辛烯-3-醇的能力增强,而这与图1中MP表面疏水性的变化并不一致,表明疏水相互作用并不是促使EWP、WPI改变MP结合1-辛烯-3-醇的能力的原因。图5、6结果表明,添加2% EWP和4% WPI时,MP的展开程度最大,有研究表明蛋白展开可导致蛋白内部的氢键遭到破坏,增加了氢键结合位点,从而使醇类物质的羟基通过氢键与MP结合,增强了两者之间的亲和力[30];而当EWP、WPI的添加量继续增加,游离1-辛烯-3-醇含量进一步降低,表明MP结合1-辛烯-3-醇的能力进一步增强,这可能是由于蛋白自聚集,增加了表面的亲水基团,通过氢键与1-辛烯-3-醇相结合。而添加6% SPI后,游离的1-辛烯-3-醇含量反而增加,这可能是由于SPI中本身具有一定量的1-辛烯-3-醇所致[9]。
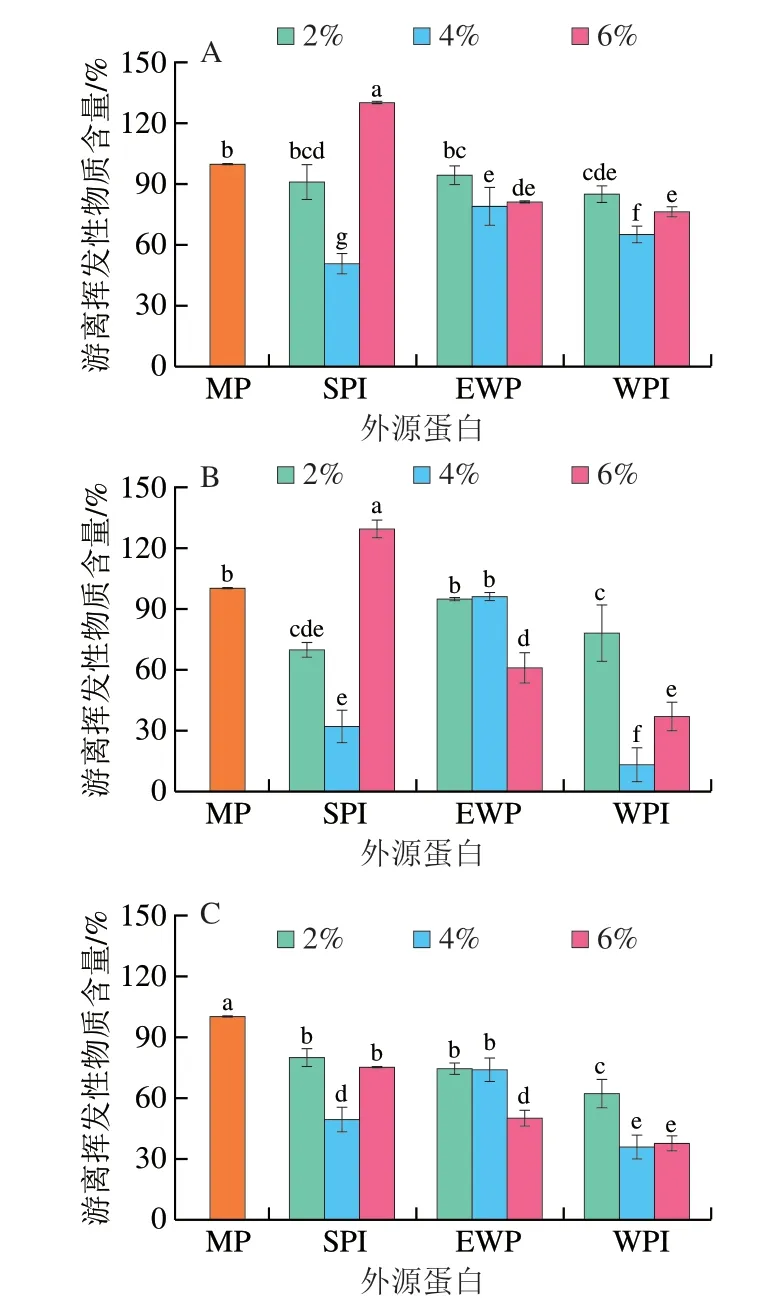
图7 外源蛋白对MP结合特征腥味物质能力的影响Fig.7 Effects of external proteins on the binding capacity of MP to fishy-odor compounds
此外,添加不同外源蛋白的MP溶液结合能力也存在差异,添加WPI的样品中游离的己醛、壬醛和1-辛烯-3-醇3 种腥味物质含量显著低于SPI组以及EWP组,表明添加WPI的MP溶液对3 种腥味物质均具有最强的结合能力。这可能是由于3 种外源蛋白不同的空间排列结构所造成的[11]。SPI主要由7S(β-伴大豆球蛋白)和11S(大豆球蛋白)构成,其中11S是由6 个亚基通过6 个二硫键以及少量的非共价相互作用构成[36]。而WPI中主要的蛋白为β-乳球蛋白,其桶状结构由2 个二硫键连接而成,并含有一个游离巯基[37]。相较于WPI,SPI含有更多的二硫键,蛋白亚基之间的联系更加紧密,产生的空间位阻会减少风味物质进入疏水核心的可能性,而WPI二硫键较少可减少风味物质进入蛋白疏水区域的阻碍,同时WPI中含有的游离巯基,也能够增强其对醛酮类物质的吸收[11]。而蛋清蛋白中卵白蛋白占其含量的一半以上,含有386 个氨基酸残基,并且多为疏水性氨基酸,但这些氨基酸均分布于卵白蛋白内部,其疏水区域并不能与风味物质结合[11,28]。
3 结论
外源蛋白可通过改变MP三级结构影响MP的结合能力。添加适量外源蛋白能促进蛋白展开,增强MP表面疏水性,形成更大的聚集体,溶液浊度也随之增加,此时MP具有较强的己醛、壬醛结合能力;添加量过高,MP疏水基团被重新包埋,结合己醛、壬醛的能力随之下降。同时,EWP、WPI添加量的增大可增强MP结合1-辛烯-3-醇的能力,这可归结于蛋白氢键结合位点的增加;而随SPI添加量的增加,MP对1-辛烯-3-醇的结合能力先上升后下降。此外,添加WPI的样品对3 种腥味物质的结合能力强于添加SPI、EWP的样品。但对于这3 种外源蛋白在鱼糜制品中是否能起到同样的作用,仍需进一步研究。
