固相萃取-同位素稀释/超高效液相色谱-串联质谱法测定蜂蜜中甲硝唑、二甲硝咪唑和洛硝哒唑
2023-02-07张阳阳肖全伟万渝平
林 浩,刘 川,张阳阳,肖全伟,毛 锐,万渝平,戴 琴
(成都市食品检验研究院,四川 成都 611130)
硝基咪唑类药物是临床常用的广谱抗生素,由于其杀菌作用强、疗效好、价格低廉,被广泛应用于治疗原虫感染、厌氧菌感染等疾病,并具有较好的抗肿瘤、抗病毒、抗结核等作用[1]。如甲硝唑(metronidazolem,MNZ)、洛硝哒唑、塞克硝唑等在细菌感染、滴虫病等方面疗效显著,已成为预防和治疗人类、畜禽等生物体感染该类疾病主要的药物[2-3]。然而,由于硝基咪唑类药物对哺乳动物具有致畸、致癌及遗传毒性等作用,对人类健康构成潜在威胁[4],美国和欧盟等国家已规定在食品中禁用该类物质[5-6],我国已制定GB 31650—2019《食品中兽药最大残留限量》、农业农村部公告第250号《食品动物中禁止使用的药品及其他化合物清单》等相应国家标准对其严格监管[7-8]。
硝基咪唑类药物是一类具有咪唑环和硝基取代基结构的化合物,根据取代基种类和位置差异可分为不同化合物,主要包括MNZ及其代谢产物羟基甲硝唑、二甲硝咪唑(dimetridazole,DMZ)及其代谢产物羟甲基甲硝咪唑、洛硝哒唑(ronidazole,RNZ)、异丙硝唑等[9]。由于硝基取代基具有生物还原特性,被还原为硝基自由基时,能与DNA、蛋白质等生物分子发生多种相互作用[10],使硝基咪唑类衍生物与生物体内酶、受体、DNA等许多大分子发生超分子结合,产生抗寄生虫、抗癌、抗感染等医药活性[11]。目前硝基咪唑类残留物的检测方法较多,已有针对不同基质建立的方法,如:GB/T 21318—2007《动物源食品中硝基咪唑残留量检验方法》[12]、SN/T 1928—2007《进出口动物源性食品中硝基咪唑残留量检测方法 液相色谱-质谱/质谱法》[13]、SN/T 2624—2010《动物源性食品中多种碱性药物残留量的检测方法 液相色谱-质谱/质谱法》等[14],测定方法主要包括酶联免疫吸附法、滴定法、液相色谱法、气相色谱法、液相色谱-串联质谱法、气相色谱-串联质谱法等[15],其中液相色谱-串联质谱法具有高效、高灵敏度、高特异性等特点[16],为常用方法。
蜂蜜是由蜜蜂采集的花蜜、蜜露等酿造而成的天然食品,具有改善人体代谢、提高免疫能力等作用,倍受人们青睐[17]。作为有机生命体,蜜蜂因细菌、真菌或病毒侵袭而导致疾病,药物防治是控制蜜蜂病虫害的主要技术之一[18],如MNZ作为抗感染一线药物,被普遍用于控制和预防蜜蜂微孢子虫病等。但蜂群中药物滥用可能会导致蜂蜜中药物积累,增加蜂蜜及相关制品对人体的危害性,已有相关报道显示蜂蜜中的确存在氯霉素、MNZ等抗生素蓄积案例[19]。目前蜂蜜中硝基咪唑类物质常用检测方法为GB/T 23410—2009《蜂蜜中硝基咪唑类药物及其代谢物残留量的测定 液相色谱-质谱/质谱法》[20],该方法使用二甲硝咪唑-D3(dimetridazole-D3,DMZ-D3)作为DMZ和MNZ的内标,二甲硝咪唑代谢物-D3作为RNZ的内标,但检测时发现,不同蜂蜜的基质效应对各目标物的影响存在差异,使用以上定量方法会对MNZ和RNZ的定量结果产生偏离,导致测定结果不准确。该方法前处理中并无净化过程,导致在定性定量过程中,容易受到蜂蜜杂质干扰而影响结果准确性,降低检测效率。本实验对蜂蜜中MNZ、DMZ、RNZ测定方法进行研究,优化前处理工艺和定量方法,建立对蜂蜜具有普遍适用性的测定方法,使测定结果更加准确。
1 材料与方法
1.1 材料与试剂
蜂蜜样品均为市购。
MNZ(纯度99.5%) 北京曼哈格生物科技有限公司;DMZ(纯度99.46%)、氘代二甲硝咪唑-D3(99.23%)、氘代洛硝哒唑-D3(100.04 μg/mL)美国Dr.Ehrenstorfer公司;RNZ(99.0%)、氘代甲硝唑-D4(100.5 μg/mL) 北京曼哈格生物科技有限公司。
PCX阳离子交换柱、PEP固相萃取柱 天津博纳艾杰尔科技有限公司;C18固相萃取柱 美国Water公司;甲酸、甲醇、乙腈、乙酸铵、乙酸乙酯(均为色谱纯)德国Merck公司;浓盐酸、氨水(均为分析纯) 重庆川东化工集团有限公司;实验用水符合GB/T 6682—2008《分析实验室用水规格和试验方法》实验室一级用水。
1.2 仪器与设备
QTRAP5500 三重四极杆串联质谱仪美国AB SCIEX公司;Centrifuge 5810 R高速离心机德国Eppendorf公司;Milli-Q超纯水仪 美国Millipore公司;ASPE-24固相萃取仪、MTN-2800W氮吹浓缩仪天津奥特赛恩斯公司;Multi reax全能型振荡器 德国Heidolph公司;BP211D型天平 德国Sartorius公司。
1.3 方法
1.3.1 标准物质的配制
1.3.1.1 标准溶液配制
准确称取MNZ、DMZ、RNZ标准品各10 mg(准确至0.01 mg)于3 个10 mL棕色容量瓶中,用甲醇溶解并定容至刻度,摇匀,配制质量浓度为1000 μg/mL的标准储备液,4 ℃避光保存,有效期6 个月[20]。
准确移取各标准储备液100 μL于同一10 mL棕色容量瓶中,用甲醇稀释并定容至刻度,摇匀,得质量浓度为10 μg/mL混合标准中间溶液。
分别准确移取2 mL、200 μL和20 μL混合标准中间溶液于3 个10 mL棕色容量瓶中,甲醇稀释并定容至刻度,摇匀,得质量浓度为2 μg/mL、200 ng/mL和20 ng/mL混合标准工作溶液。
1.3.1.2 同位素内标标准溶液配制
准确称取DMZ-D3标准品10 mg(准确至0.01 mg)于10 mL棕色容量瓶中,用甲醇溶解并定容至刻度,摇匀,配制质量浓度为1000 μg/mL的DMZ-D3标准储备液。
准确移取上述DMZ-D3标准储备液1 mL至10 mL棕色容量瓶中,用甲醇稀释并定容至刻度,摇匀,配制质量浓度为100 μg/mL的DMZ-D3标准中间溶液。
准确移取上述DMZ-D3标准中间溶液、MNZ-D4标准溶液、RNZ-D3标准溶液各100 μL至同一10 mL棕色容量瓶中,用甲醇稀释并定容至刻度,摇匀,得质量浓度为1 μg/mL混合同位素内标标准工作溶液。
1.3.1.3 标准工作曲线配制
分别准确移取20 ng/mL混合标准工作溶液50、100、250、500 μL和200 ng/mL混合标准工作溶液100、250、500 μL置于1 mL容量瓶中,再分别加入混合同位素内标标准工作溶液50 μL,用20%甲醇溶液稀释并定容至刻度,摇匀,得标准工作曲线,质量浓度分别为1.0、2.0、5.0、10.0、20.0、50.0、100.0 ng/mL,内标终质量浓度50 ng/mL。
1.3.2 样品前处理
1.3.2.1 样品提取
1.3.2.2 直接上机测定
向1.3.2.1节中氮吹管中加入1 mL 20%甲醇溶液复溶,涡旋1 min,过0.22 μm有机滤膜测定。
1.3.2.3 PCX固相萃取小柱净化
向1.3.2.1节中氮吹管中加入5 mL 0.1 mol/L盐酸溶液复溶,涡旋1 min,倾入已用5 mL甲醇和5 mL 0.1 mol/L盐酸溶液活化的PCX固相萃取小柱中,用5 mL 0.1 mol/L盐酸溶液和5 mL甲醇淋洗,最后用5 mL洗脱液(甲醇-水-氨水,16∶3∶1,V/V)洗脱至接收管中,40 ℃氮吹至近干,1 mL 20%甲醇溶液复溶,涡旋1 min,过0.22 μm有机滤膜测定。
1.3.3 基质效应考察
1.3.3.1 制备空白基质
准确称取混合均匀的同一阴性蜂蜜样品10 份,每份10 g分别置于50 mL具塞离心管中,均加入超纯水5 mL,摇匀后加入10 mL乙酸乙酯提取,涡旋5 min,10000 r/min离心5min,取乙酸乙酯层至氮吹管,残渣中加入10 mL乙酸乙酯重复提取1 次,合并乙酸乙酯层,40 ℃氮吹至干,向氮吹管中加入1 mL 20%甲醇溶液复溶,涡旋1 min,过0.22 μm有机滤膜,合并10 份滤液,摇匀,即得蜂蜜空白基质。分别制备枸杞、野花、洋槐、枇杷、油菜花和益母草6 种不同蜂蜜基质。
4.额外量价格指导下,炼厂出口成品油将由过去的减利因素反转为增利因素,增加出口的积极性。基础量政策未实施前,炼厂测算出口价格比留国内出厂价低600 元/吨。基础量政策实施后,炼厂测算出口价格将比额外量价格高1000 元/吨,出口远好于留国内作额外量。国内竞争对手的经验也验证了此结论:2016 年中化泉州炼厂因出口200 万吨汽油,较留国内批发增利20 亿元。
1.3.3.2 制备高质量浓度混合外标溶剂曲线
分别准确移取200 ng/mL混合标准工作溶液50、100、250、500 μL和2 μg/mL混合标准工作溶液100、250、500 μL置于1 mL容量瓶中,用20%甲醇溶液稀释并定容至刻度,摇匀,即得高质量浓度混合外标溶剂曲线,质量浓度分别为10、20、50、100、200、500、1000 ng/mL。
1.3.3.3 制备基质及溶剂外标曲线
分别准确移取1.3.3.2节中高质量浓度混合外标溶剂曲线各质量浓度点100 μL置于1 mL容量瓶中,再用1.3.3.1节中空白基质分别稀释并定容至刻度,摇匀,即得蜂蜜基质曲线,质量浓度分别为1.0、2.0、5.0、10.0、20.0、50.0、100.0 ng/mL。按上述方法分别制备枸杞、野花、洋槐、枇杷、油菜花和益母草6 个实验组的混合外标(MNZ、DMZ、RNZ)基质曲线。以及使用20%甲醇溶液制备同质量浓度外标溶剂曲线。
1.3.3.4 基质效应计算
考察不同种类蜂蜜的基质效应强弱,以曲线斜率计算基质效应,按式(1)[21]计算:
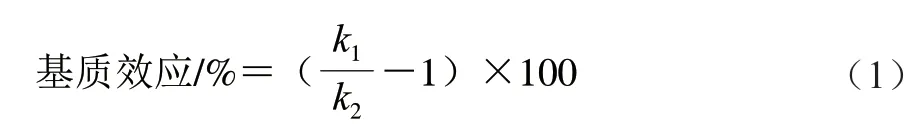
式中:k1为基质匹配标准曲线斜率;k2为溶剂标准曲线斜率。
当基质效应绝对值小于15%时,则表明不存在基质效应,当基质效应绝对值超过20%,则表明存在明显的基质效应[22-23],绝对值越大则基质效应越强。若基质效应值为正值,则存在基质增强效应,若为负值,则存在基质抑制效应。
1.3.4 检测条件
1.3.4.1 色谱条件
ACQUITY UPLC BEH C18色谱柱(3.0 mm×100 mm,1.7 μm);流速0.40 mL/min;柱温35 ℃;进样量2 μL。流动相体系:A为甲醇、B为0.1%甲酸溶液;梯度洗脱程序见表1。

表1 MNZ、DMZ、RNZ分离的梯度洗脱程序Table 1 Gradient elution program for the separation of MNZ,DMZ and RNZ
1.3.4.2 质谱条件
电喷雾离子源正离子模式;气帘气压力20 psi;离子化电压5500 V;温度550 ℃;喷雾气压力50 psi;辅助加热气压力60 psi;喷撞气:中等;扫描方式为多反应监测;监测离子参数见表2。
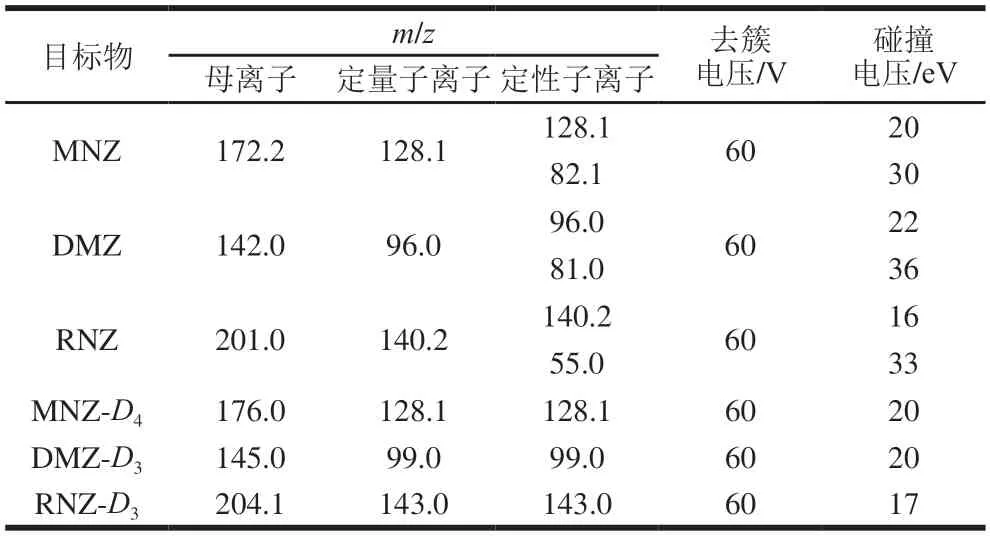
表2 MNZ、DMZ、RNZ特征离子质谱条件Table 2 Mass spectrometric parameters for MNZ,DMZ and RNZ
2 结果与分析
2.1 基质效应考察结果
以质量浓度为横坐标,标准物质响应为纵坐标作图,绘制曲线图,各曲线线性方程相关系数R均大于0.99,线性回归曲线见表3。根据基质效应计算公式,各蜂蜜基质效应对目标物的影响见图1。由图1可知,6 种蜂蜜对MNZ、DMZ、RNZ均存在基质抑制效应,且各目标物所受抑制效应的强度也存在差异。
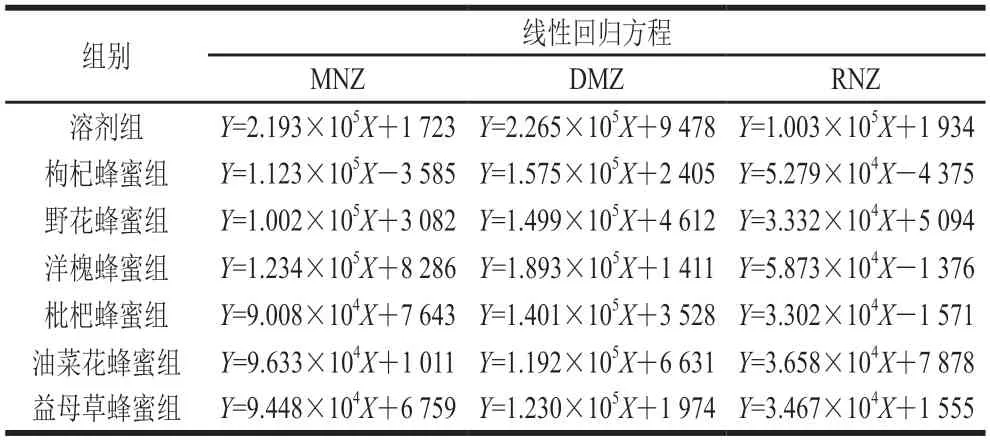
表3 各蜂蜜中目标物基质曲线线性方程Table 3 Calibration equations for MNZ,DMZ and RNZ in honeys from different floral origins
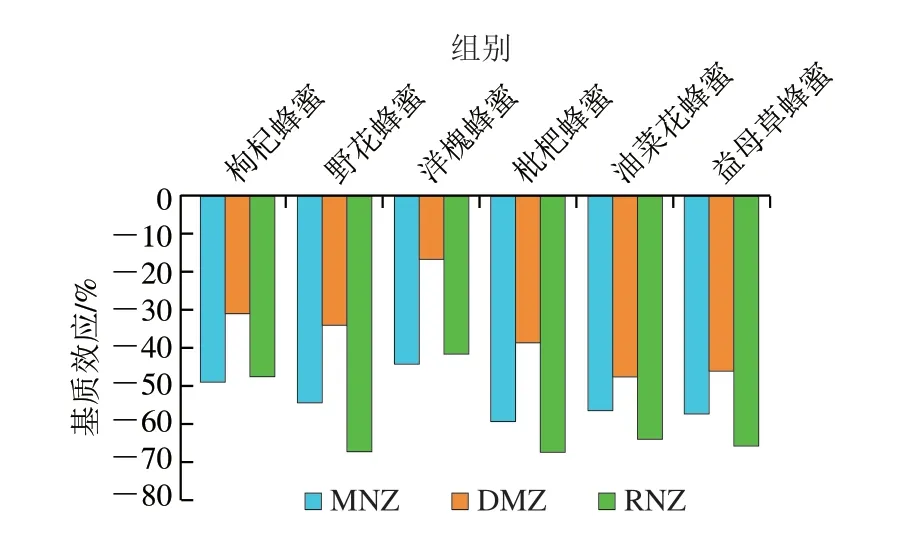
图1 不同蜂蜜的基质效应对目标物的影响Fig.1 Matrix effect of honeys from different floral origins
2.2 流动相考察
由于酸性色谱条件有利于正离子模式下的离子化[24],对色谱条件流动相进行考察,筛选乙腈-水(含0.1%甲酸)系统、乙腈-5 mmol/L乙酸铵溶液(含0.1%甲酸)系统、甲醇-5 mmol/L乙酸铵溶液(含0.1%甲酸)系统和甲醇-水(含0.1%甲酸)系统,并优化流动相梯度。结果发现,4 种流动相系统对目标物的测定并无明显影响。因此,选择对色谱柱损耗较小的甲醇-水(含0.1%甲酸)流动相系统,优化后的图谱见图2。
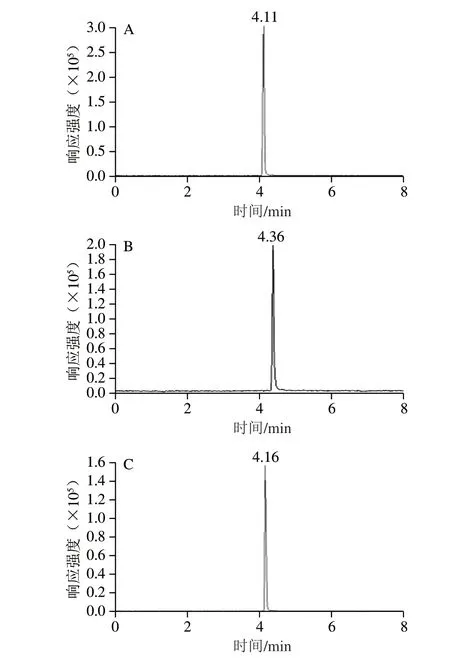
图2 目标化合物离子通道图Fig.2 Chromatograms of MNZ,DMZ and RNZ using methanol-0.1%formic acid solution as mobile phase
2.3 线性关系、检出限和定量限结果
配制目标化合物溶剂曲线,以MNZ-D4、DMZ-D3、RNZ-D3分别作为MNZ、DMZ、RNZ的内标进行定量分析,MNZ、DMZ、RNZ在1.0~100.0 ng/mL质量浓度范围内线性关系良好,相关系数R均大于0.99。通过梯度稀释标准溶液法[25],获得色谱信噪比为3时的目标化合物质量浓度作为仪器检出限(limit of detection,LOD),信噪比为10时的目标化合物质量浓度作为仪器定量限(limit of quantitation,LOQ)。通过仪器检测,LOD为0.7 ng/mL,即0.07 μg/kg。LOQ为2 ng/mL,即0.2 μg/kg。
2.4 前处理优化
蜂蜜中含有氨基酸、糖类、有机酸和少量蛋白质等成分,不但会污染质谱离子源,而且会影响目标化合物的测定[26]。在日常检测中,蜂蜜的基质干扰对硝基咪唑类目标物的测定具有较大影响,需要不断更改流动相系统或梯度优化分离效果,并用标准溶液重新校正,使测定工作变得繁琐。为了提高检测效率,节约成本,在乙酸乙酯提取基础上,设置净化流程降低蜂蜜中杂质干扰,以杂质干扰较为严重的枇杷蜂蜜作为基质,考察用C18、PEP、PCX三种固相萃取小柱对蜂蜜基质0.5 μg/kg加标的乙酸乙酯提取液中目标化合物的净化效果,筛选最佳净化方法。各固相萃取柱净化情况见图3。
由图3可知,3 种净化小柱对蜂蜜中MNZ和RNZ均有一定的净化效果,但经C18和PEP小柱净化所得图谱依然存在较为明显的杂峰干扰,而PCX小柱净化对MNZ、DMZ和RNZ的蜂蜜杂峰消除更为明显,已基本无任何杂质干扰。这可能与固相萃取柱填料性质及吸附作用有关。C18柱为十八烷基键合硅胶柱,对脂类、色素及芳香族化合物成分具有明显吸附作用[27-28]。PEP柱为官能化聚苯乙烯/二乙烯苯萃取柱,表面同时具有亲水性和憎水性基团,对各类极性、非极性化合物具有较均衡的吸附作用。PCX柱为混合型阳离子交换柱,是以阳离子交换混合机理的水可浸润型聚合物为基质的固相萃取柱,能提供双重保留模式:即离子交换与反相保留,填料为C18非极性/丙基苯磺酸基聚合而成,在pH 0~14.0范围内都很稳定,具有较大的结合容量[29]。与C18柱和PEP柱相比,PCX柱兼有吸附和反相吸附混合作用力,在离子交换作用力的基础上还增加了非极性作用力,具有更好的净化效果[30],因此,本方法设计PCX固相萃取柱净化有利于提升检验方法的专属性。
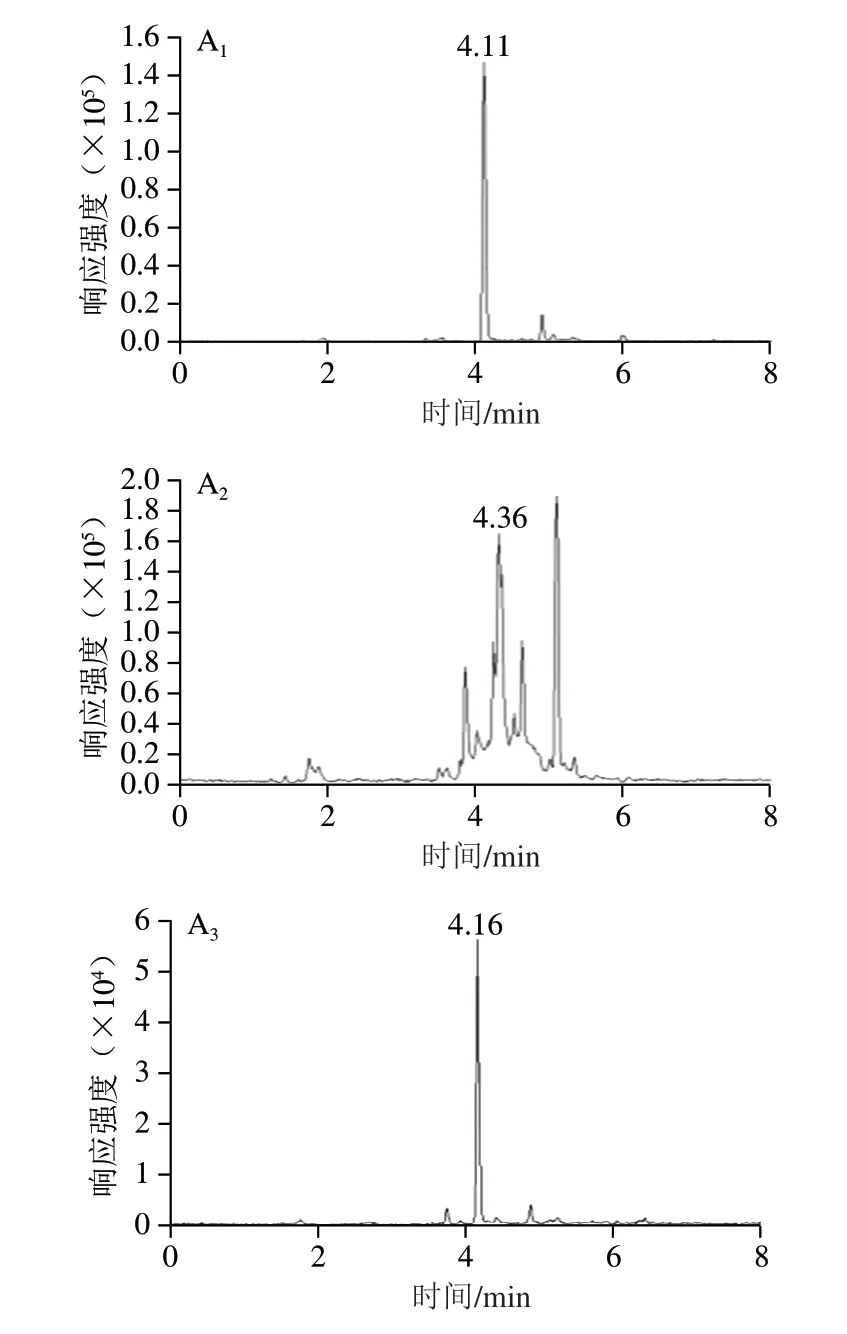
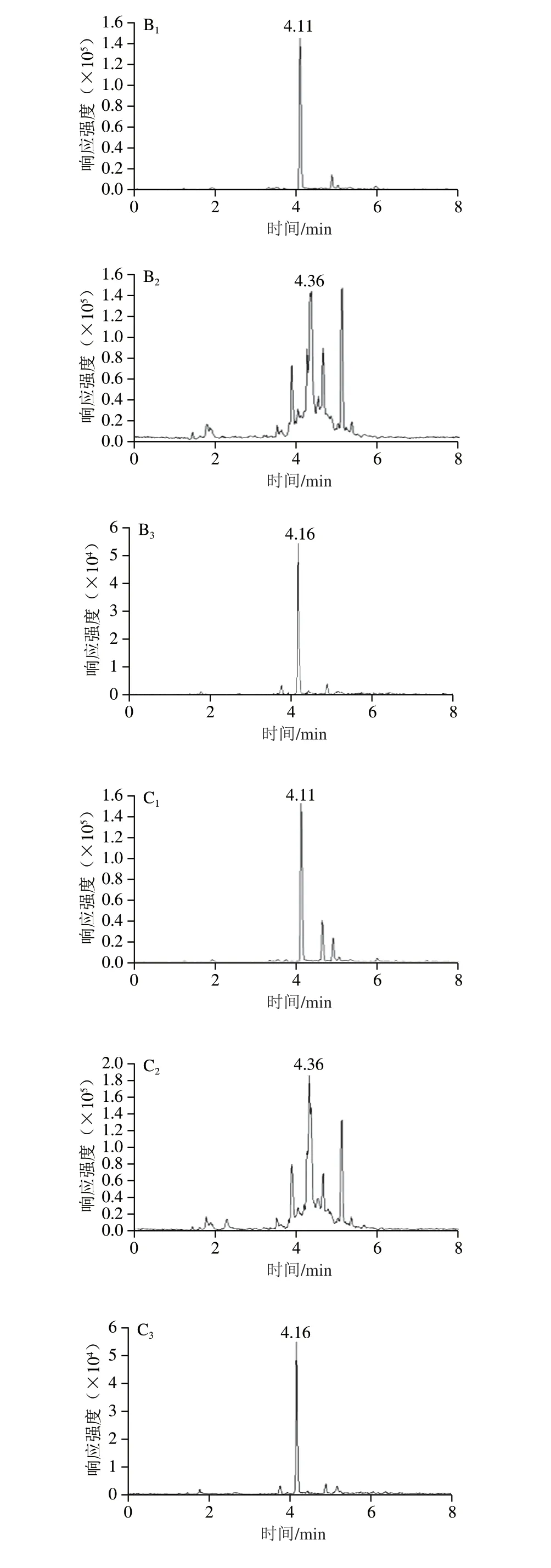
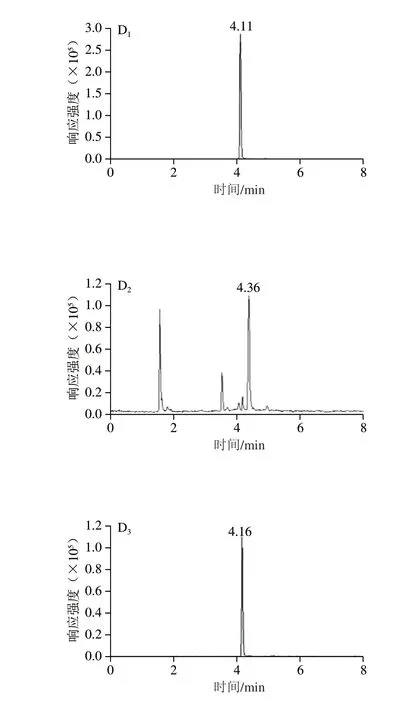
图3 目标化合物定量离子通道图Fig.3 Effect of different solid phase extraction cartridges on the purification of MNZ,DMZ and RNZ
2.5 加标回收实验
以MNZ、DMZ、RNZ检测均为阴性且基质抑制效应较为明显的枇杷蜂蜜为基质,设定回收加标量0.2、1.0、2.0、5.0 μg/kg,每组每个添加水平平行6 份,按1.3.2.1节和1.3.2.3节方法进行前处理。实验回收率和精密度测定结果见表4。MNZ回收率范围为95.0%~101.0%,DMZ回收率范围为95.7%~101.4%,RNZ回收率范围为96.0%~100.7%。以MNZ-D4、DMZ-D3、RNZ-D3分别作为MNZ、DMZ、RNZ的内标进行定量分析,受基质效应的影响更小,测定结果更加准确,且相对标准偏差小于5%,具有良好的精密度。

表4 实验回收率和精密度Table 4 Recoveries and precision for spiked loquat honey
2.6 实际样品测定
2021年10—12月,本实验组用此方法对市场购买的蜂蜜样品进行MNZ、DMZ、RNZ残留量检测,共计50 批次,结果均为未检出,定性结果与平行实验室相同。50 批次蜂蜜检测图谱均无明显杂质峰干扰,无需更换流动相系统或梯度,既提高检测效率,又确保了测定结果的准确性。
3 结论
采用超高效液相色谱-串联质谱法建立一种蜂蜜中MNZ、DMZ、RNZ的测定方法,在GB/T 23410—2009《蜂蜜中硝基咪唑类药物及其代谢物残留量的测定 液相色谱-质谱/质谱法》方法的基础上,选用混合阳离子交换柱净化提取液,并优化液相条件。以MNZ-D4和RNZ-D3分别作为MNZ和RNZ的内标进行定性定量测定,该方法在1.0~100.0 ng/mL质量浓度范围内线性关系良好,LOD为0.07 μg/kg,LOQ为0.2 μg/kg,标准添加量在0.2、1.0、2.0、5.0 μg/kg时,MNZ、DMZ、RNZ的加标平均回收率为95.0%~101.4%,表明测定结果受蜂蜜基质效应影响较小,结果更加准确。且相对标准偏差为1.6%~3.7%,具有良好的精密度。结果表明,该方法操作简便,具有较高的灵敏度和准确度,能够满足蜂蜜中MNZ、DMZ和RNZ的日常检测。
