冻结过程中面筋蛋白分子结构与水分分布的原位表征与分析
2023-02-07张予涵刘兴丽张艳艳
张 华,张 普,张予涵,刘兴丽,张艳艳
(郑州轻工业大学食品与生物工程学院,食品生产与安全河南省协同创新中心,河南省冷链食品质量安全控制重点实验室,河南 郑州 450000)
我国冷冻食品行业蓬勃发展,其产值居食品工业的首位[1]。虽然冷冻保藏可以很好保持食品的新鲜度,但冻结过程对面制品品质的损伤是公认的,其中面筋蛋白网络结构和分子结构发生变化是引起面团品质劣变的主要原因。冻结过程中,冰晶生长以及冰晶大小不均会引起面筋蛋白二硫键断裂并与淀粉颗粒发生分离,导致面筋蛋白流变学性质下降,进而导致面团强度下降[2];此外,冻结过程中水分迁移、冰晶的重结晶以及自由水含量的增加会改变面筋蛋白分子结构并破坏面筋网络结构,导致质构性能变差,从而使面制品后续加工性能变差[3]。因此,控制冻结过程中冰晶生长对面团中面筋蛋白分子结构的损伤是提升冷冻食品加工与贮藏性能及其食用品质的关键所在,也是冷冻产品加工业面临的重大科学技术难题。
面团形成过程是指面粉与水在搅拌混合过程中,面团内部的面筋蛋白与水分发生水合作用和剪切作用并伴随着能量的输入,从而形成包含完整面筋网络结构并具有一定弹性和延展性的面团[4]。大量研究表明,面团形成过程中,面团加水量对面制品结构、物化性质及感官品质有很大影响[5-6],但有关加水量对冷冻面团产品品质的影响研究较少[7]。因此,研究冷冻过程中不同水分含量面团面筋蛋白分子结构的变化规律对揭示水分含量和水分分布对冷冻面团最终品质的影响机制有重要意义。
现有的关于冷冻对面团中冰晶和蛋白分子结构影响的研究主要采用了冷冻干燥、蛋白质分离提取等样品处理方法[8-9]。由于样品离开了冷冻环境或采取了分离提取手段,所以测量的蛋白结构信息不能准确反映样品的真实变化[10]。因此,对冷冻样品采用原位表征并实时监测面筋蛋白的结构变化,有助于更加真实、准确地揭示冷冻对面筋蛋白结构变化的影响。
本研究采用激光共聚焦显微拉曼光谱仪和低场核磁共振成像分析仪对冻结过程中面团面筋蛋白分子结构、水分分布和核磁共振成像的实时变化进行原位监测,从微观尺度和分子水平揭示面团冻结过程中面筋蛋白结构和水分分布的变化规律并研究加水量对其的影响,以阐明面团冻结过程中品质劣变的机理,为控制冻结过程中面团品质劣变提供一定理论依据。
1 材料与方法
1.1 材料与试剂
金苑精制粉(蛋白质含量11.1%,脂肪含量2%,含水量11.5%) 河南金苑粮油有限公司。
1.2 仪器与设备
HA-3480AS和面机 克莱美斯机电科技(深圳)有限公司;DZM-140电动压片机 浙江省永康市海鸥电器有限公司;inVia激光共聚焦显微拉曼光谱仪 英国Renishaw公司;NMI20低场核磁共振成像分析仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 面团的制备
准确称取300 g面粉4 份,分别加入面粉质量40%、45%、50%及55%的蒸馏水,置于和面机中,60 r/min搅拌10 min使其形成质地均匀的面团。使用电动压片机反复压延面团5 次,形成大小为30 cm×7 cm×0.8 cm、加水量分别为40%、45%、50%及55%的面团,醒发60 min后用于后续实验。
1.3.2 面团冻结过程中拉曼光谱的原位采集
分别取大小为0.5 cm×0.5 cm×0.2 cm的面团样品置于冷冻平台,将平台固定于显微镜载物台上。用激光光源进行激光聚焦,使用冷冻平台控制系统以10 ℃/min的速率进行梯度降温,分别在25(室温)、0、-3、-6、-9、-12、-15 ℃和-18 ℃(冻结终点)进行拉曼光谱采集。拉曼光谱采集参数:激发波长785 nm;激光功率250 mW,使用100%的能量进行激发;扫描范围300~4000 cm-1;数据采集时间10 s;分辨率2 cm-1。
1.3.3 低场核磁共振测定冷冻面团水分分布
参考范金磊[11]的方法并略作改动。将25、0、-3、-6、-9、-12、-15 ℃和-18 ℃的冷冻面团样品制成高2 cm、半径0.25 cm的圆柱体置于核磁管中,采用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的横向弛豫时间(T2)。采集参数:回波个数1200;采样点数166446;重复扫描16 次;半回波时间0.208 ms。
1.3.4 冷冻面团核磁共振成像分析
选用MSE(Multi Spin-Echo-Sequence)脉冲对冷冻面团进行2D质子密度成像扫描。将25、0、-3、-6、-9、-12、-15 ℃和-18 ℃的冷冻面团样品制成高2 cm、半径0.25 cm的圆柱体置于核磁管中,放置于磁场射频线圈的中心,进行核磁共振成像成像,参数为:选层层厚4 mm;层间隙3 mm;重复时间300 ms;回波时间20 ms;采集次数20。使用Osiris软件处理图像,并以标准BMP格式保存。
1.4 数据处理
2 结果与分析
2.1 面团冻结过程中面筋蛋白分子结构的原位分析
拉曼光谱在识别分子结构以及蛋白质二、三级结构的定性与定量分析方面具有很强的技术优势[12]。如图1a所示,拉曼光谱中,500~550 cm-1处属于二硫键(S—S),在此特征谱带区间二硫键主要存在3 种构型:gauche-gauche-gauche(g-g-g)构型、gauchegauche-trans(g-g-t)构型和trans-gauche-trans(t-g-t)构型[13],3 种构型峰面积的变化可以表征二硫键的变化,其特征频率分别出现在500~510、515~525 cm-1和535~545 cm-1。拉曼光谱也可以检测氨基酸侧链的微环境,如图1b所示,酪氨酸双链的峰强度比值(830 cm-1和850 cm-1处,I850/830)被称为费米共振,可以提供酚羟基氢键的信息[14]。1004 cm-1处的苯丙氨酸因吸收稳定可以作为归一化因子,740 cm-1处色氨酸残基吸收峰强度与1004 cm-1处吸收峰强度比值(I740/1004)的变化可以用来表征色氨酸残基微环境的变化[15]。如图1c所示,1600~1700 cm-1区间为酰胺I带的特征峰,酰胺I带特征峰面积的变化可以用来表征蛋白二级结构的变化。使用Peakfit 4.12软件对拉曼图谱进行去高斯卷积,然后进行二阶导数处理,最后进行峰的归属。其中,α-螺旋在1645~1660 cm-1子峰,无规卷曲在1660~1670 cm-1子峰,β-折叠在1670~1680 cm-1子峰,β-转角在1680~1690 cm-1子峰[16]。
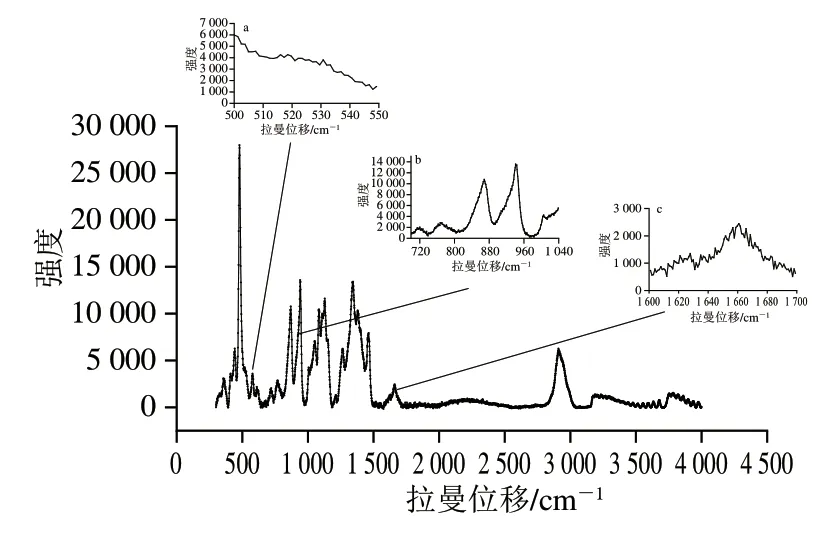
图1 面团拉曼光谱图Fig.1 Raman spectrum of dough
2.2 面团冻结过程中面筋蛋白二硫键构型的原位分析
随着吸收频率的升高,二硫键结构逐渐不稳定,g-g-g构型是稳定的二硫键构型,g-g-t和t-g-t构型是较不稳定的二硫键构型[17]。
由图2a可知,冻结终点时,随着加水量的增加,冷冻面团面筋蛋白二硫键g-g-g构型的相对含量呈先上升后下降趋势,并在加水量45%时达到了最高,为46.97%,这代表面筋蛋白网络结构在加水量45%时最为稳定。冻结过程中由于冰晶生长破坏了面筋蛋白的网络结构,进而使维持面筋蛋白三级结构的二硫键被破坏,面筋蛋白网络结构的持水力随即下降,会形成更多更大的冰晶从而加剧对网络结构的破坏;而过高的加水量使冰晶对面筋蛋白网络结构的破坏更加剧烈,加剧了这种现象[18]。由图2b可知,45%加水量的面团冻结过程中,二硫键g-g-g构型的相对含量在25~-15 ℃温度区间无显著变化,在-15~-18 ℃温度区间显著降低了4.33%。随着温度的下降,二硫键g-g-g构型向g-g-t和t-g-t不稳定构型转变,二硫键的稳定性发生下降,影响了面筋蛋白的网络结构,从而使面团品质下降。这可能是因为冻结过程中,自由水转化为冰晶,冰晶的生长破坏了面筋蛋白的网络结构,使分子间作用力下降,给面团的品质造成了不可逆的影响[19]。

图2 加水量(a)和温度(b)对冷冻面团面筋蛋白二硫键构型的影响Fig.2 Effects of water addition (a) and temperatures (b) on disulfide bond configuration of gluten in frozen dough
2.3 面团冻结过程中面筋蛋白氨基酸侧链的原位分析
如表1所示,I740/1004在加水量达到45%之后趋于稳定,说明冻结终点时色氨酸残基的微环境达到稳定的状态,不会随着加水量的增加而变化。这可能是因为冻结终点时,大量的水由液态转为固态,形成的冰晶破坏了维持面筋蛋白三级结构的作用力,改变了面筋蛋白三级结构,所以加水量的增加不会影响冻结终点时氨基酸侧链的微环境。
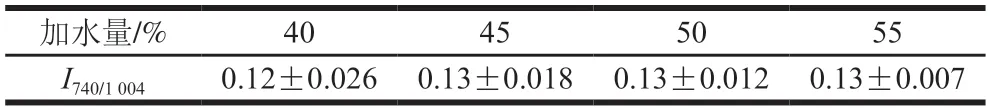
表1 加水量对冻结终点时冷冻面团面筋蛋白氨基酸侧链的影响Table 1 Effect of water addition on amino acid side chains of gluten proteins in frozen dough at the end of freeze
由图3可知,加水量45%的面团冻结过程中,随着温度的下降,面筋蛋白氨基酸侧链的I740/1004值缓慢下降,表明埋藏的色氨酸在冻结过程中逐渐“暴露”,疏水基团不断外露[20]。这是因为冻结过程中冰晶逐渐长大,破坏了蛋白的网络结构,增大了对氢键的破坏,面筋蛋白三级结构随之改变,这会使面筋蛋白的表面疏水性增大、持水性降低,从而影响面团的品质。此外,由图1b可知,冷冻面团I850/830值远大于普通面团中的正常值(0~1.45),推测可能是被870 cm-1处的强吸收峰掩盖,导致结果异常[21]。
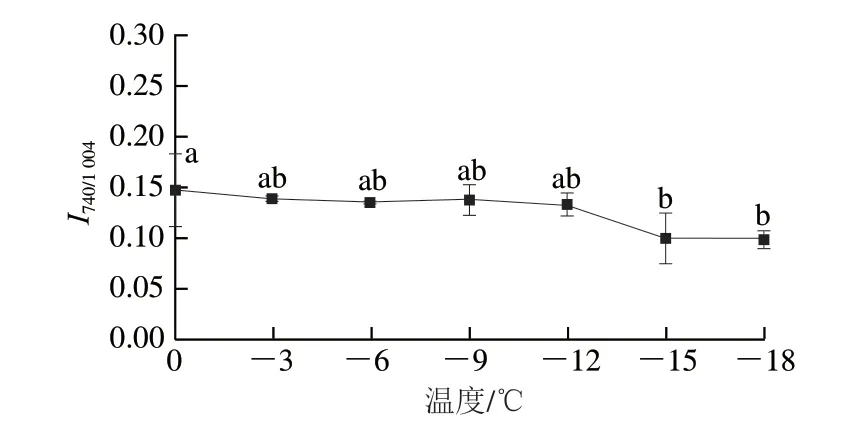
图3 温度对45%加水量冷冻面团面筋蛋白氨基酸侧链的影响Fig.3 Effect of temperature on amino acid side chains of gluten proteins in frozen dough with 45% water added
2.4 面团冻结过程中面筋蛋白二级结构的原位分析
如图4所示,在冻结终点,不同加水量冷冻面团的α-螺旋相对含量无明显差异。45%加水量面团冻结过程中,面筋蛋白α-螺旋相对含量逐渐下降,β-折叠相对含量无显著变化(除-9 ℃),β-转角和无规卷曲相对含量整体呈波动上升趋势。
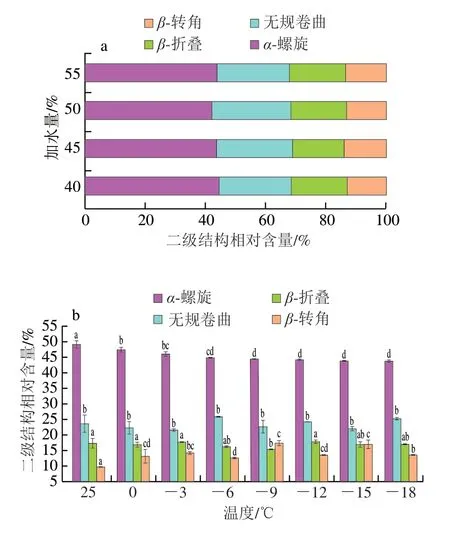
图4 加水量(a)和温度(b)对冷冻面团面筋蛋白二级结构的影响Fig.4 Effects of water addition (a) and temperature (b) on the secondary structure of gluten in frozen dough
α-螺旋是蛋白质二级结构中较为稳定有序的结构,其含量越多,说明蛋白越稳定[22]。本实验冻结过程中α-螺旋相对含量随着温度下降逐渐下降了3.63%,说明冷冻会使面筋蛋白的二级结构变得无序。这是因为随着温度的下降,冰晶逐渐生长,破坏了面筋蛋白的网络结构,使氢键的相互作用逐渐下降。由此可知,α-螺旋逐渐转化为无规卷曲等稳定性较低的结构,面筋蛋白的螺旋结构舒展,这会使蛋白中的疏水基团暴露,从而导致面筋蛋白的表面疏水性增大、持水性降低[23]。
2.5 面团冻结过程中水分分布的变化
共振图谱(图5)中出现了3 个峰并记为T21、T22和T23,当0.18 ms<T2<4.00 ms时,这部分水为与面筋蛋白中氨基、羧基、羟基等以氢键作用结合的水,流动性差,被称为强结合水;当4.00 ms<T2<37.00 ms时,这部分水的流动性较结合水更弱但比自由水强,被称为弱结合水;当T2>37.00 ms时,这部分水为自由水[24]。此外,出峰面积代表了不同流动性水分的含量[25]。
由图5a可知,冷冻终点时,不同加水量冷冻面团之间水分状态无明显差别,这可能是因为冻结过程中,淀粉被破坏,淀粉的吸水率增加,减弱了加水量对于冷冻面团水分分布的影响[26]。由图6可知,面团中强结合水相对含量随温度的下降发生剧烈下降并在-6 ℃时未能检出,弱结合水相对含量随着温度的下降出现先急剧升高后逐渐稳定的趋势,自由水相对含量也在冻结过程中整体有所升高。此过程中,强结合水相对含量逐渐下降,表示冻结过程中面团的持水性逐渐减弱。推测冻结过程中,随着冰晶的生长,非极性基团周围的水分聚集,破坏了面筋蛋白的网络结构,导致面团的品质发生劣变[27]。
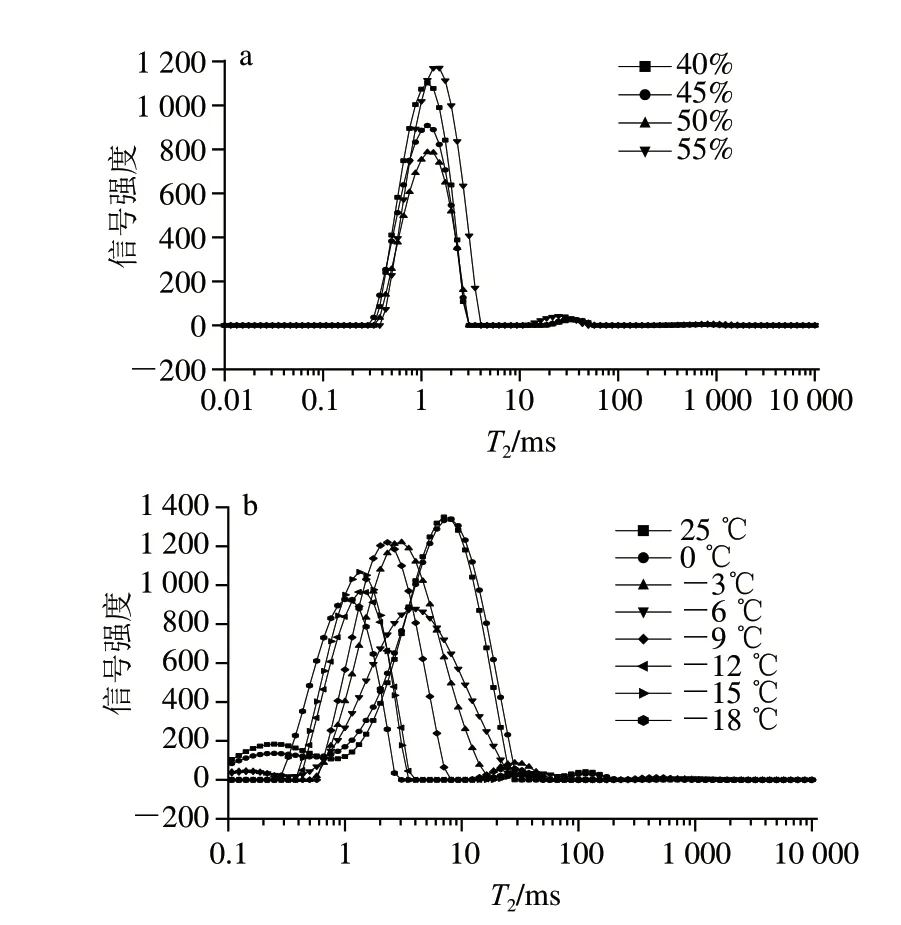
图5 加水量(a)和温度(b)对冷冻面团水分分布的影响Fig.5 Effects of water addition (a) and temperature (b) on water distribution in frozen dough
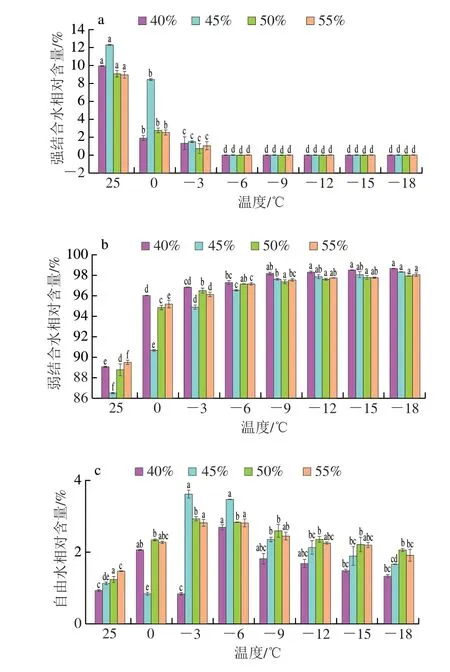
图6 面团冻结过程中强结合水(a)、弱结合水(b)和自由水(c)的相对含量变化Fig.6 Changes in relative contents of strongly bound water (a),weakly bound water (b) and free water (c) during dough freezing
2.6 面团冻结过程中核磁共振成像的变化
核磁共振成像技术能够直观地表现出面团在冻结过程中水分分布的变化及迁移[28]。不同加水量的面团在冻结过程中的伪彩图如图7所示,红色部分越多(即氢质子信号越强)表示此部分水分含量较高,反之,蓝色部分越多表示水分含量较少[29]。
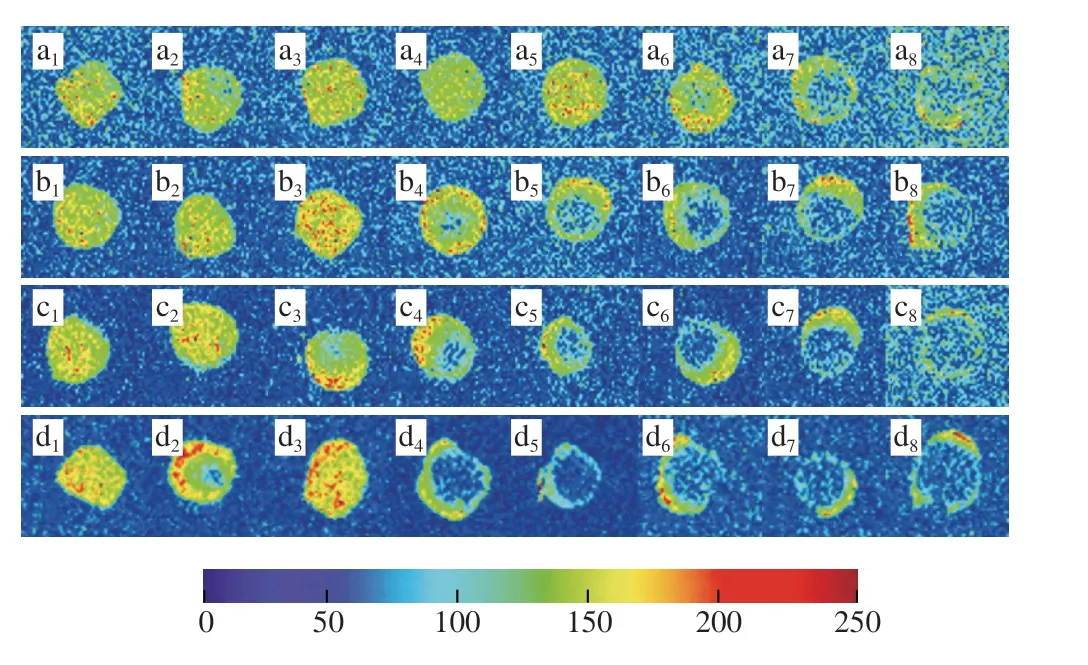
图7 面团冻结过程中加水量40%(a)、45%(b)、50%(c)、55%(d)的核磁共振成像分析Fig.7 Nuclear magnetic resonance imaging analysis of doughs with different water contents during freezing
由图7可知,冻结过程中,水分逐渐向面团表面迁移,随着加水量的增加,这种现象越明显。加水量40%的面团在-15 ℃时出现明显迁移,而加水量55%的面团在-6 ℃出现此现象。水分发生明显迁移前,冻结过程中面团核磁共振成像出现部分区域氢质子信号明显升高的现象:加水量40%的面团在-9 ℃时出现、加水量45%的面团、加水量50%及55%加水量面团在-3 ℃时出现。推测此时为强结合水转化为弱结合水和自由水阶段,此过程促进了冰晶的生长,冰晶生长过程中产生的热量使水分向外迁移,从而出现氢质子信号在面团中由内向外逐渐增强的现象[30]。
3 结论
采用激光共聚焦显微拉曼光谱仪和低场核磁共振成像仪对冻结过程中面团面筋蛋白分子结构、水分分布和核磁共振成像的实时变化进行原位监测,从微观尺度和分子水平揭示面团冻结过程中面筋蛋白结构和水分分布的变化规律并研究加水量对其的影响。结果表明:面团加水量45%时,面团体系最为稳定,此时面筋蛋白二硫键中g-g-g构型相对含量最高,且I740/1004达到最大值0.13,氨基酸侧链微环境最为稳定,而不同加水量之间二级结构无明显差异。随着温度的下降,面团体系稳定性降低,品质持续劣变,具体表现为二硫键构型中较稳定的g-g-g构型逐渐转化为较不稳定的g-g-t和t-g-t构型,I740/1004从0 ℃开始持续下降,氨基酸侧链逐渐“暴露”于极性环境中,二级结构中较有序的α-螺旋也逐渐向无规卷曲等较无序的结构转化。水分分布的结果也印证了这一结论,冻结过程进行的同时,强结合水相对含量持续下降,冰晶的生长迫使水分逐渐向面团表面迁移。冷冻面团品质劣变主要由冰晶生长导致的面筋蛋白网络结构被破坏而引起,因此控制面团中加水量及水分分布是改善面团品质劣变的重要举措。
