日本百脉根LjbHLH34基因克隆及耐旱功能鉴定
2023-02-07刘福陈诚张凯旋周美亮张新全
刘福,陈诚,张凯旋,周美亮*,张新全
(1.四川农业大学草业科技学院,四川 成都 611130;2.中国农业科学院作物科学研究所,北京 100081)
日本百脉根(Lotus japonicus)是一种百脉根属豆科牧草,与百脉根(Lotus corniculatus)、细叶百脉根(Lotus tenuis)和湿地百脉根(Lotus uliginosus)等百脉根属植物亲缘关系很近[1]。日本百脉根完整的遗传图谱、EST序列和参考基因组已经建立,在其响应不同环境变化、与微生物共生方面有较深入的研究[2-4]。百脉根属的牧草品种在土壤贫瘠地区具有较好的适应性,耐热性强,是温凉湿润地区的优良豆科牧草[5]。干旱胁迫严重影响植物生产,引起牧草生产力和品质的显著下降。因此,挖掘日本百脉根抗旱耐旱的关键基因,从分子水平上揭示日本百脉根抗旱机制,对培育百脉根属抗逆品种,促进我国畜牧业健康可持续发展具有重要意义。
干旱胁迫会对植物的生长、发育和生产力产生不利影响,当植物受到其胁迫时,会产生相应的应答机制来消除或减弱干旱造成的伤害;而这些应答反应的产生涉及多个基因、多种信号途径及不同的代谢产物,其中转录调控在这个过程中起承上启下的作用[6-8]。一些被广泛研究的转录因子AP2、bZIP、NAC、NF-Y和bHLH在遭受干旱胁迫时都会显著上调[9]。其中bHLH类转录因子是存在于所有真核生物中的一类转录因子,因其表达蛋白序列含有碱性螺旋-环-螺旋结构域而得名,该结构域高度保守,大约包含60个氨基酸,一般由两个在功能上完全不同的区域组成:碱性区域和螺旋-环-螺旋结构域,常以二聚体的形式行使功能;除了存在bHLH结构域之外,bHLH家族蛋白往往还包含了其他的功能结构域如ZIP结构域,这些结构域在蛋白与蛋白相互作用、蛋白二聚化中发挥作用[10-12]。
研究表明,bHLH类转录因子参与调节信号转导、植物的生长发育及逆境胁迫,例如苹果(Malus pumila)MdCIB1(cryptochrome-interacting bHLH 1)与MdCRY2互作,参与蓝光响应和开花时间调控,该基因也受聚乙二醇(polyethylene glycol,PEG)诱导,过表达MdCIB1的苹果愈伤组织对PEG处理的耐受性增强,同时在拟南芥中(Arabidopsis thaliana)异位表达MdCIB1提高其抗旱性,表现为在干旱胁迫下根系较长、抗氧化酶活性增强等[13-14]。对bHLH类转录因子参与植物非生物逆境胁迫调控研究发现bHLH转录因子可能从气孔发育、根毛形成及对脱落酸(abscisic acid,ABA)的敏感性等方面参与植物对干旱胁迫的响应[15-17]。拟南芥bHLH122转录因子在干旱胁迫下的表达量呈现显著上调,通过GUS(β-glucuronidase)分析显示其表达部位主要在维管组织及保卫细胞;在干旱条件下,过量表达bHLH122会使植物体内的ABA含量升高,同时bHLH122过表达拟南芥相比野生型拟南芥对干旱胁迫有更好的耐受性[18]。在拟南芥中,bHLH转录因子RD22和AtAIB的表达量受ABA和PEG诱导,同时与野生型拟南芥相比,过表达RD22和AtAIB植株对干旱胁迫的耐受性更强[17,19]。拟南芥AtbHLH34受非生物胁迫调控,在甘露醇和ABA处理下上调;同时过表达AtbHLH34能增加拟南芥对渗透胁迫的耐受性,对外源ABA的敏感性低于野生型和RNA沉默株系[20]。水稻(Oryza sativa)OsbHLH148基因的表达量受茉莉酸、ABA、极端温度和干旱胁迫的诱导,在水稻中过表达可提高转化植株对干旱的抗性[21]。
干旱是影响环境和农业生产的重要因素,尽管bHLH转录因子在调控植物耐旱性方面的研究报道很多,但针对该转录因子家族在日本百脉根抗旱方面的研究报道较少。在本研究中,克隆到日本百脉根LjbHLH34,揭示了其序列特征,明确了该基因在日本百脉根中的组织表达特异性以及在ABA及干旱胁迫条件下的表达特征,确定LjbHLH34蛋白的亚细胞定位和转录激活活性;此外,本研究将LjbHLH34转入野生型拟南芥中,并对其阳性转基因植株进行干旱处理,进而初步分析该基因在干旱胁迫过程中的功能,为将来百脉根属抗旱育种提供理论支撑。
1 材料与方法
1.1 试验材料
试验所用的材料日本百脉根(MG-20)、拟南芥(WT)、大肠杆菌感受态细胞DH5α、农杆菌菌株GV3101、酵母菌株PJ69-4A和所有使用到的载体均由中国农业科学院植物科学研究所荞麦(Fagopyrum esculentum)基因创新研究组保存提供,植物材料于2021年种植于实验室的温室内,培养条件为22℃、16 h光照/8 h黑暗、湿度75%~80%。
1.2 试验方法
1.2.1 日本百脉根LjbHLH34的克隆 以拟南芥AtbHLH34蛋白序列为参考,在日本百脉根参考基因组网站(http://www.kazusa.or.jp/lotus/index.html)中找到一个同源基因LjbHLH34(Lj3g3v1545570.1),根据该基因序列设计特异性引物T-LjbHLH34-F/R(表1),以日本百脉根的cDNA为模板,进行PCR扩增,琼脂糖凝胶电泳检测得到目的条带,切胶回收,将回收产物连接到pTOPO-Blunt Simple载体(北京金百特生物技术有限公司),得到pLjbHLH34-T载体,转化大肠感受态细胞DH5α,挑取单克隆用引物M13-F/T-LjbHLH34-R(表1)进行菌液PCR鉴定后测序,通过序列比对得到正确的pLjbHLH34-T载体质粒。
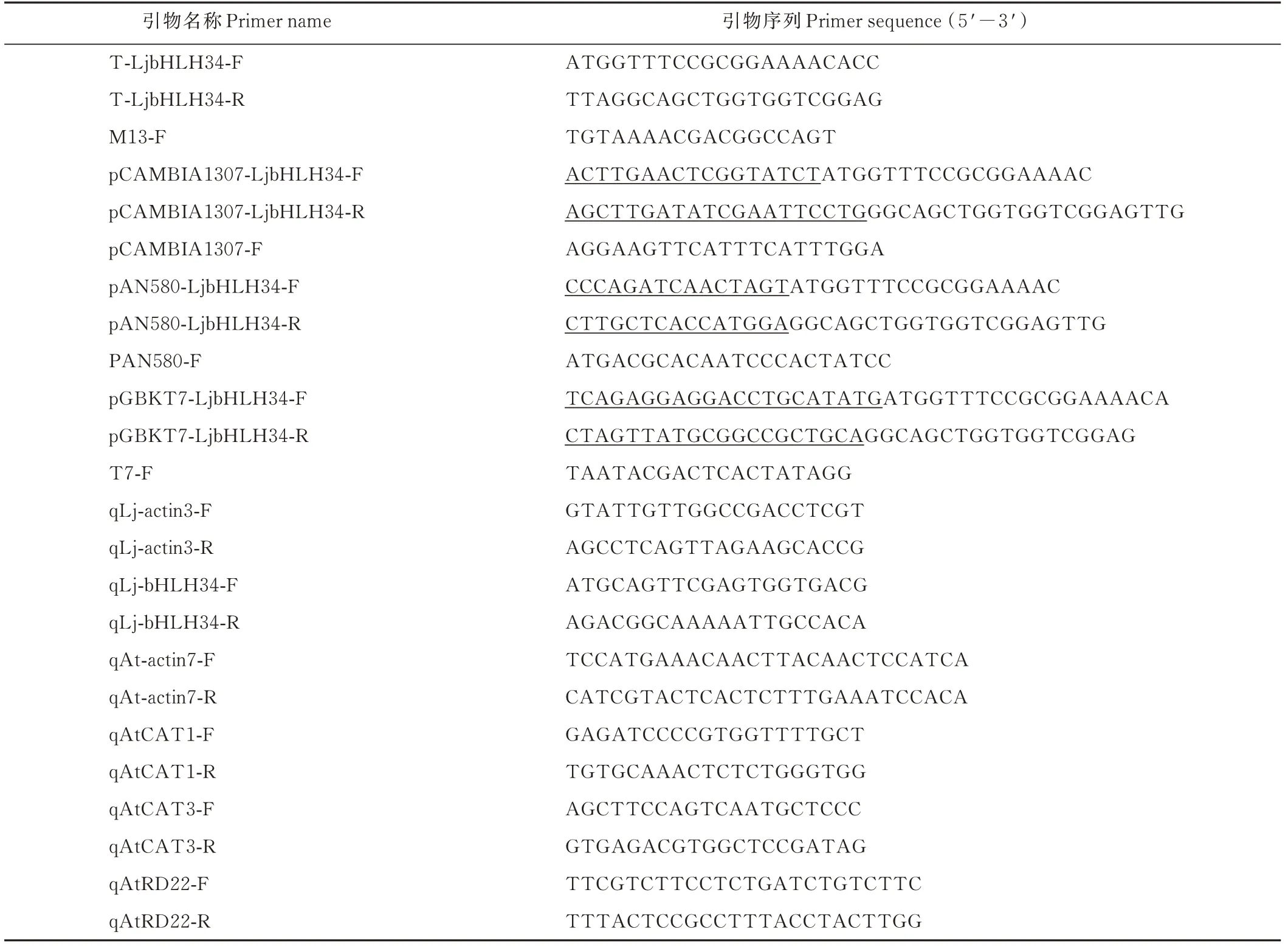
表1 引物序列Table 1 Primer list
1.2.2LjbHLH34生物信息学分析 对测序得到的正确序列进行生物信息学分析,首先通过ExPASy网站(http://web.expasy.org/protparam/)预测LjbHLH34基因编码氨基酸的数目、蛋白相对分子质量和等电点,利用在线网站NCBI:Conserved Domain Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/)分析LjbHLH34基因编码的氨基酸序列的保守结构域;用MEGA 7.0软件使用邻接法(neighbor-joining,NJ)将LjbHLH34蛋白与拟南芥中的bHLH蛋白进行进化树分析,采用DNAMAN 8.0软件进行同源蛋白序列分析。
1.2.3LjbHLH34基因的亚细胞定位 根据基因序列设计含有酶切位点XbaI和PstI亚细胞定位载体pAN580-LjbHLH34-F/R引物(表1),以pLjbHLH34-T质粒为模板,进行PCR扩增,将扩增产物连接到pAN580载体上,获得pAN580-LjbHLH34重组质粒,并转化到大肠杆菌感受态细胞DH5α中,挑取单克隆用引物pAN580-F/pAN580-LjbHLH34-R(表1)进行菌液PCR鉴定后测序,将测序正确的菌液用于质粒提取,转化拟南芥叶片原生质体进行瞬时表达,然后通过激光共聚焦显微镜(LSM 980,德国)观察,使用AtH2B-Mcherry载体作为核定位Marker。拟南芥叶片原生质体转化方法和试剂配制参考Chen等[22]:将培养1月龄左右未开花的拟南芥叶片放入配制好的酶解液中进行酶解,然后加W5溶液[2 mmol·L-1pH=5.7的吗啉乙磺酸(morpholine ethyl sulfonic acid,MES),154 mmol·L-1NaCl,125 mmol·L-1CaCl2和5 mmol·L-1KCl]用细胞筛(70 mm)过滤,334 r·min-1进行离心,吸去上清液,用W5溶液洗涤2次,吸去上清液,根据需要加入MMG溶液[4 mmol·L-1pH=5.7的MES,0.4 mol·L-1D-甘露醇(D-Mannitol)和15 mmol·L-1MgCl2]悬浮制成原生质体。在2.0 mL离心管依次加入重组质粒(10 μg)、核定位Marker(10 μg)、原生质体(100 μL)和PEG-calcium溶液(体积为:重组质粒+定位Marker+100 μL原生质体;配方为20% PEG 4000,0.2 mol·L-1D-Mannitol和100 mmol·L-1MgCl2),静置10 min,加入1 mL W5溶 液清洗1~2次,最后加入1 mL W1(20 mmol·L-1pH=5.7的MES,0.4 mol·L-1D-Mannitol和20 mmol·L-1KCl)溶液,室温暗培养过夜,在激光共聚焦显微镜下观察。
1.2.4 转录激活活性分析 为了研究LjbHLH34的转录激活能力,设计含有pGBKT7载体上的NdeI和PstI酶切位点的pGBKT7-LjbHLH34-F/R引物(表1),以pLjbHLH34-T质粒为模板,进行PCR扩增,将扩增产物连接到pGBKT7载体上,获得pGBKT7-LjbHLH34重组质粒,并转化到大肠杆菌感受态细胞DH5α中,用T7-F/pGBKT7-LjbHLH34-R(表1)进行菌液PCR鉴定,测序正确之后提取质粒。将重组质粒pGBKT7-LjbHLH34+pGADT7空载和pGADT7+pGBKT7空载转入酵母PJ69-4A感受态细胞中,涂布至SD-Leu/-Trp缺陷筛选培养基上,28℃培养箱中培养2~3 d,挑取单克隆进行PCR鉴定,将阳性菌液稀释至10-1、10-2和10-33个浓度梯度,各取10 μL分别点在SD-Leu/-Trp和SD-Trp/-His/-Ade缺陷筛选培养基上,28℃培养箱中倒置培养。pGADT7+pGBKT7作为阴性对照。
1.2.5 表达分析 取5周龄的日本百脉根的根、茎、叶和整株,3个重复。提取总RNA并反转录成cDNA,对LjbHLH34基因在日本百脉根各个组织的表达量进行分析。将5周龄生长良好、大小一致的日本百脉根无菌苗放入加有100 μmol·L-1ABA和20% PEG-6000的MS液体培养基中,室温振荡处理0、6、12和24 h后取材,分析在ABA和PEG处理下LjbHLH34基因表达量变化。以日本百脉根的qLj-actin3-F/R(表1)作为内参基因,根据基因序列设计荧光定量引物qPCR-F/R(表1),应用Taq Pro Universal SYBR qPCR Master Mix荧光定量试剂盒(南京诺唯赞生物技术有限公司)进行实时荧光定量PCR,采用RQ=2-ΔΔT的算法,计算目标基因的相对表达量。
1.2.6 过表达载体的构建及拟南芥遗传转化 设计含有XbaI和PstI酶切位点的pCAMBIA1307-LjbHLH34-F/R引物(表1),以pLjbHLH34-T质粒为模板,进行PCR扩增。将扩增产物连接到pCAMBIA1307表达载体上,转化DH5α感受态细胞,挑取单克隆用引物pCAMBIA1307-F/pCAMBIA1307-LjbHLH34-R(表1)进行菌液PCR检测及测序比对后,得到过表达载体pCAMBIA1307-LjbHLH34质粒用于转化农杆菌GV3101侵染野生型拟南芥(WT)花序。
1.2.7 转基因拟南芥的筛选及转基因植株的检测 将收获到的拟南芥T0代种子消毒后播种在含有潮霉素(40 mg·L-1)抗性的MS培养基上,筛选出转基因拟南芥株系并用引物pCAMBIA1307-F/pCAMBIA1307-LjbHLH34-R(表1)对这些株系进行PCR鉴定,同时提取RNA反转录为cDNA进行实时荧光定量PCR检测。将阳性转基因株系OE-1、OE-2和OE-3进行繁种,获得T2代种子用于后续试验。
1.2.8 转基因拟南芥株系耐旱性鉴定 将拟南芥过表达株系和野生型拟南芥经消毒吹干铺在MS培养基上,4℃暗培养3 d,转入温室竖直培养3 d后,选取生长一致的幼苗移入含有200 mmol·L-1的MS培养基和对照MS培养基上竖直培养10 d后统计根长,每个处理设置3个重复。将50颗左右的过表达株系种子和WT撒在含有蛭石∶营养土=1∶1的培养盆中,每个处理设置3个重复。正常生长两周后,分为两组,一组正常浇水作为对照,另一组不浇水进行干旱处理,15 d后观察其表型变化并取样。测定对照组和处理组的相对含水量、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量。相对含水量的测定方法是称取叶片0.2 g,记为Wf,之后将叶片浸入水中8 h,称其饱和鲜重Wt,再于105℃烘箱中杀青15 min,75℃条件下烘干至恒重,称干重,记为Wd,按照公式计算相对含水量:相对含水量(%)=(Wf-Wd)/(Wt-Wd)×100[23];SOD和MDA采用超氧化物歧化酶活性检测试剂盒(BC0170)和丙二醛活性检测试剂盒(BC0025)检测。同时对干旱处理后的拟南芥进行复水3 d观察其表型变化。
1.2.9 转基因拟南芥相关基因的表达分析 对正常生长和干旱处理15 d后的野生型和转基因拟南芥取样提取总RNA并反转录为cDNA。通过qRT-PCR技术检测几个逆境相关基因的表达量。
1.3 数据统计与分析
采用Excel和GraphPad Prism 8对数据进行统计分析并制图。
2 结果与分析
2.1 日本百脉根LjbHLH34的生物信息学分析
对获得的LjbHLH34基因序列(GenBank:Lj3g3v1545570.1)进行生物信息学分析,该基因包含一个711 bp的碱基序列,可编码236个氨基酸,蛋白质的分子量为25777.16 Da,理论等电点6.19,含有两个结构域:bHLH_AtILR3_like(79-154)和BRLZ(139-172)(图1A)。进化树分析结果表明,LjbHLH34与拟南芥bHLHⅣ亚家族聚为一类,并与拟南芥中的AtbHLH34和AtbHLH104亲缘关系较近(图1B)。多重序列比对结果表明,LjbHLH34与其他植物中的同源蛋白都具有保守的bHLH结构域(图1C)。

图1 LjbHLH34蛋白序列分析Fig.1 Sequence analysis of LjbHLH34
2.2 日本百脉根LjbHLH34基因的亚细胞定位
将融合表达载体pAN589-LjbHLH34-GFP和核定位MarkerAtH2B-Mcherry共转化拟南芥叶片原生质体进行瞬时表达。通过激光共聚焦显微镜观察,结果显示融合表达载体pAN589-LjbHLH34-GFP仅在细胞核中存在绿色荧光(green fluorescent protein,GFP),与核标记Marker重叠。综上可知LjbHLH34定位于细胞核中(图2)。

图2 LjbHLH34的亚细胞定位Fig.2 Subcellular localization of LjbHLH34
2.3 LjbHLH34基因的表达特性
通过检测LjbHLH34在日本百脉根不同组织中的表达情况,发现该基因在日本百脉根幼苗的根系、茎和叶片中均有不同程度的表达,其在根中的表达量最高,其次是叶,在茎中表达量最少(图3A)。对ABA和PEG处理0、6、12和24 h之后的日 本 百脉根的 总RNA进行qRT-PCR分 析 的结果显 示:LjbHLH34基因 随 着ABA和PEG处理时间的增加呈现先上调后下调的表达趋势,且均在12 h表达量最高(图3B,C)。

图3 LjbHLH34在日本百脉根中的表达模式Fig.3 Expression pattern of LjbHLH34 in L.japonicus
2.4 LjbHLH34转录激活活性分析
为了研究LjbHLH34是否有转录激活活性,将构建好的重组质粒pGBKT7-LjbHLH34+pGADT7空载、pGADT7+pGBKT7空载转入酵母PJ69-4A感受态中,在SD-Leu/-Trp和SD-Trp/-His/-Ade缺陷筛选培养基上观察酵母菌株的生长情况。结果显示,在SD-Leu/-Trp培养基上转入重组质粒pGBKT7-LjbHLH34+pGADT7空载质粒、pGADT7+pGBKT7空载质粒的酵母菌株都能够正常生长,而转入重组质粒pGBKT7-LjbHLH34+pGADT7空载质粒的酵母菌株在SD-Trp/-His/-Ade缺陷筛选培养基正常生长,转入pGADT7+pGBKT7空载质粒的酵母菌株不能生长(图4),表明LjbHLH34转录因子具有转录激活活性。

图4 LjbHLH34转录因子转录激活活性Fig.4 Transcriptional activation activity of LjbHLH34 transcription factor
2.5 转LjbHLH34基因拟南芥的鉴定
采取花序浸染法转化野生型拟南芥(WT),通过筛选获得4个转基因株系,并对这几个转基因株系的DNA进行PCR检测,结果显示野生型拟南芥没有扩增出目的条带,而转基因株系均扩增出目的条带(图5A);利用qRTPCR对过表达植株进行表达量检测,得到3个过表达OE-1、OE-2和OE-3转基因拟南芥株系(图5B)。

图5 转LjbHLH34基因拟南芥的鉴定Fig.5 Identification of transgenic A.thaliana with LjbHLH34

续图1 LjbHLH34蛋白序列分析Continued Fig.1 Sequence analysis of LjbHLH34
2.6 干旱胁迫下转LjbHLH34基因拟南芥的耐旱性表型
根是植物吸收水分和营养物质的主要器官,也是植物最早对干旱胁迫信号作出反应的部分。本研究通过甘露醇(D-Mannitol)模拟干旱条件对LjbHLH34转基因拟南芥株系的根长进行检测。将转基因拟南芥株系和野生型拟南芥在普通MS和含有200 mmol·L-1D-Mannitol的MS固体培养基上竖直培养10 d,发现在普通MS培养基中,转基因株系与对照的根长没有明显区别(图6A);而在200 mmol·L-1D-Mannitol处理下,3个转基因株系的根长明显长于野生型,分别是野生型的1.41、1.50和1.52倍(图6A,B)。
此外,本研究还对转基因拟南芥进行了土壤干旱试验,进一步了解其抗旱能力。将正常生长的拟南芥幼苗进行干旱处理15 d后,3个转基因株系(OE-1,OE-2和OE-3)和野生型拟南芥在正常浇水的情况下生长无明显差异;在干旱胁迫下,野生型拟南芥地上部分的萎蔫程度比转基因株系严重;复水后,野生型和转基因株系慢慢转绿,但转基因株系的叶片明显比野生型绿(图7)。从LjbHLH34转基因株系在干旱胁迫下的表型可以得出LjbHLH34能提高植物的耐旱性。

图7 干旱胁迫后拟南芥表型Fig.7 Phenotypic of A.thaliana under drought stress
2.7 在干旱胁迫下LjbHLH34转基因拟南芥的生理指标变化
相对含水量可以反映植物体内水分情况,SOD是植物细胞内重要的抗氧化酶,而MDA作为氧化胁迫的主要产物会破坏生物膜的结构和功能。为了进一步研究转基因拟南芥株系的耐旱性,测定了经过15 d干旱处理的转基因株系和野生型拟南芥的相对含水量、SOD活性和MDA含量。结果显示,干旱处理后,转基因拟南芥株系中的相对含水量和SOD活性显著高于野生型拟南芥,而MDA含量显著低于野生型拟南芥(图8)。干旱胁迫下LjbHLH34转基因拟南芥中含水量、SOD和丙二醛的变化,表明过表达LjbHLH34可以通过提高细胞内的防御成分和减少伤害物质的形成来抵抗干旱胁迫给植物带来的氧化伤害。

图8 干旱胁迫下转基因拟南芥的生理指标Fig.8 Physiological indexes of transgenic A.thaliana under drought stress
2.8 干旱处理下LjbHLH34转基因拟南芥中抗性相关基因的表达分析
为了研究在干旱条件下LjbHLH34转基因拟南芥株系对其他调节抗逆相关基因的影响,本研究分析了AtCAT1、AtCAT3和AtRD22这3个 基 因 的 表 达 水 平。结 果 显 示,在 干 旱 处 理15 d后AtCAT1、AtCAT3和AtRD22在LjbHLH34转基因拟南芥株系中的表达水平明显高于野生型(图9)。在过表达LjbHLH34转基因植株中,逆境相关基因的表达水平受到相当程度的诱导,推测过表达LjbHLH34可以通过调节胁迫应答基因的表达来提高植物的抗旱性。

图9 干旱处理下抗性相关基因的表达Fig.9 Expression of resistance related genes under drought treatment
3 讨论
bHLH蛋白最初是在小鼠中发现并分离鉴定出来的,随后在酵母和植物中也相继被发现和研究[24-25]。在拟南芥中发现了至少162种bHLH蛋白,分为bHLHⅠ~bHLHⅫ共12个不同的亚家族[11]。拟南芥bHLHⅣ亚家族的成员有一个与第二个bHLH螺旋基序相邻的高度保守的亮氨酸拉链基序[leucine zipper(ZIP)motif],预测该结构域可以使蛋白质二聚化[11,26]。在本研究中,系统进化树分析结果表明,LjbHLH34与拟南芥bHLH蛋白第Ⅳ亚家族聚为一类,且与拟南芥中的AtbHLH34和AtbHLH104亲缘关系较近,对三者氨基酸序列进行比对,结果表明LjbHLH34与AtbHLH34和AtbHLH104都具有bHLH家族特有的bHLH结构域,同时各同源蛋白在N末端和C末端表现出明显的差异;其中LjbHLH34与AtbHLH34同源性最高,预示LjbHLH34蛋白在植物生长过程中与AtbHLH34发挥着相似或相近的生物学功能。同时使用NCBI在线分析LjbHLH34氨基酸的保守域,发现该基因除了具备bHLH_AtILR3_like结构域外,还存在bHLHⅣ亚家族成员中的一个ZIP基序(basic region leucin zipper),推测该基序可能在LjbHLH34基因转录调控方面行使某种特定的功能。LjbHLH34定位在细胞核中,暗示LjbHLH34与其他转录因子一样在细胞核中行使功能。
在对bHLH蛋白研究中,发现部分家族成员可以通过结合上游基因启动子元件激活下游相关基因来调控生长发育或对逆境胁迫的响应,例如Inducer of CBF Expression(ICE1,bHLH116)转录因子直接结合CBF/DREB1基因的启动子,通过独立ABA途径激活其转录以提高植物的耐寒性[27]。拟南芥AtbHLH34在体外与AtPGR基因启动子5′-GAGA-3′元件相互作用并激活AtPGR的转录,作为连接葡萄糖和非生物胁迫的调节因子来发挥作用[20]。本研究通过酵母试验发现LjbHLH34转录因子具有转录激活活性,推测该基因可能具有结合上游基因的启动子的功能并能激活下游基因的表达来调控相关功能。
有报道显示bHLH转录因子家族基因的表达受外界因素的影响,如干旱、渗透胁迫和外源植物激素等,如拟南芥AtbHLH34、AtbHLH104和AtbHLH112基因的表达受ABA的诱导,同时AtbHLH34和AtbHLH112也受干旱的诱导[20,28-29],且它们在不同处理时间下表达量不同。在本试验中,LjbHLH34基因随着ABA和PEG处理时间的增加呈现先上调后下调的表达趋势,推测该基因受PEG和ABA诱导,对胁迫响应存在时间的特异性。
过表达AtbHLH92能适当提高拟南芥对NaCl和渗透胁迫的耐性,耐性表型主要表现在与野生型拟南芥相比,转基因植株的根长在NaCl和甘露醇胁迫下显著增加[30]。苹果MdbHLH130通过调节烟草(Nicotiana tabacum)气孔关闭和活性氧清除作为水分胁迫反应的积极调节因子[31],玉米(Zea mays)ZmPTF1通过促进根系发育和ABA的合成来调节耐旱性[32]。过表达AtAIB植株在干旱胁迫10 d后,转基因的叶片萎蔫程度比对照野生型拟南芥小,更能耐受干旱胁迫[19]。所以为了更好地了解LjbHLH34基因的功能和转录调控机制,本研究从日本百脉根中克隆到该基因,利用花序浸染法进行转化,获得了转基因拟南芥株系。在200 mmol·L-1D-Mannitol模拟干旱胁迫下,LjbHLH34转基因拟南芥株系的根长显著长于野生型拟南芥的根长;同时在干旱处理15 d后,转基因株系的叶片萎蔫程度明显比野生型小,这与AtbHLH92和AtAIB调控植物耐旱类似。通过对转基因拟南芥的耐旱表型鉴定,认为过表达LjbHLH34可以适当提高拟南芥对干旱胁迫的耐受性。
为了进一步探究在干旱胁迫下LjbHLH34过表达引起的生理生化变化,测定了在干旱胁迫后转基因株系的相对含水量、SOD活性和丙二醛含量。相对含水量是衡量植物体内水分状况的重要生理指标[33],与对照相比野生型和LjbHLH34转基因拟南芥的相对含水量在干旱处理后均降低,但转基因拟南芥的相对含水量高于野生型。在植物受到干旱胁迫时,会打破作为逆境胁迫响应的重要介质活性氧(reactive oxygen species,ROS)的产生和清除的动态平衡,导致ROS在细胞内过度积累,使细胞膜受到伤害[34]。SOD是植物重要的抗氧化酶,其活性的升高与植物抗旱能力相关[35];丙二醛含量作为检测膜脂过氧化的生理指标,在相同胁迫条件下,其含量越低,植物的抗旱性越强。在干旱处理后,SOD活性明显升高,与野生型相比,LjbHLH34转基因拟南芥积累了更多的SOD,说明LjbHLH34过表达株系具有更高的活性氧清除能力。丙二醛含量也在干旱处理后明显增加,但转基因株系的含量显著低于野生型拟南芥,说明转基因拟南芥植株中的细胞膜损害程度低于野生型。
在干旱胁迫刺激下转录因子会不断合成,将响应的干旱胁迫信号传递和放大,最终诱导响应干旱基因的表达,从而引起植物生理生化的改变,使植物产生抗旱性[36]。为了进一步探讨LjbHLH34提高转基因拟南芥的抗旱性的机制,比较了转基因拟南芥和野生型中几个关于氧化防御主要酶基因和其他抗旱相关的基因。CAT1和CAT3编码过氧化氢酶蛋白,过氧化氢酶(catalase,CAT)、SOD和过氧化物酶(peroxidase,POD)一起构成清除超氧自由基和过氧化氢的防御系统[37]。NmIG1过表达植株在干旱胁迫时SOD1、CAT1、CAT2和APX1的表达水平上升,从而增加抗氧化防御成分来更好地保护和防止ROS的损害[38];过表达AtCAT3可以显著提高拟南芥的抗旱性,而act3突变体表现出与过表达植株相反的表型[39]。干旱处理后LjbHLH34转基因拟南芥植株中CAT1和CAT3的表达水平比WT高,反映出过表达株系中抗氧化防御成分增多,ROS清除能力增强。ABA作为胁迫信号在调节植物的干旱反应中起重要作用,RD22转录因子在内源ABA积累过程中被转录,作为逆境条件下ABA信号转导通路的转录激活因子,过表达RD22可以提高植株对干旱的耐受性[40]。在干旱胁迫后3个LjbHLH34转基因植株中RD22的表达水平显著高于WT。综上所述,在过表达LjbHLH34转基因植株中,抗氧化酶编码基因和其他逆境相关基因的表达水平受到相当程度的诱导,推测过表达LjbHLH34可以通过调节胁迫应答基因的表达,在抗旱方面发挥积极作用。
4 结论
生物信息学分析表明,LjbHLH34转录因子与拟南芥bHLHⅣ亚家族聚为一类,并与拟南芥中的AtbHLH34和AtBHLH104亲缘关系较近;该基因受PEG和ABA诱导,定位于细胞核中且有转录激活活性。在甘露醇处理下,过表达LjbHLH34转基因拟南芥的根长明显长于野生型;同时在土壤干旱处理15 d后,过表达LjbHLH34转基因株系的生长情况明显比野生型的好,转基因拟南芥的相对含水量和SOD活性显著高于野生型拟南芥,丙二醛积累显著低于野生型。此外,在土壤干旱处理后,3个与抗逆相关基因AtCAT1、AtCAT3和AtRD22在转基因中的表达量显著升高。综上所述,在干旱胁迫条件下,LjbHLH34转录因子在植物中可能起到了正调控的作用。
