海滨雀稗以hpt与bar基因为筛选标记的转化体系比较研究
2023-02-07姜凯吴雪莉刘奕君马越宋洋卢文杰王增裕
姜凯,吴雪莉,刘奕君,马越,宋洋,卢文杰,王增裕
(青岛农业大学草业学院,山东 青岛 266109)
海滨雀稗(Paspalum vaginatum)作为具有较强耐盐性的暖季型草坪草,在园林绿化、运动场建植、植物修复改良盐碱地中具有极大的应用潜力。海滨雀稗是典型的二倍体盐土植物,可以耐受土壤中高达3.4%(电导率为54 dS·m-1)的可溶性盐含量,在海岸的沙丘地带、咸水池塘或河口能正常生长,并用部分海水直接灌溉[6]。海滨雀稗对于土壤环境和水质的适应性较强,在盐碱地土壤、水质修复和沙丘固定等方面具有极大的应用潜力[6-9]。通过建立盐生植物海滨雀稗的遗传转化体系,进而深入揭示耐盐基因功能和调控机理,以便利用分子设计育种提高作物的耐盐性,可以为农作物的耐盐品种选育提供理论基础,为提高盐碱地的利用提供优质种质资源。
近年来,关于海滨雀稗耐盐机理方面的研究主要集中在盐胁迫下的形态结构和生理、生化响应等方面,而对关键耐盐基因在耐盐调控中的作用和通路研究较少。2008年利用海滨雀稗‘Sea Isle 1’的未成熟的花序茎段诱导产生的胚性愈伤组织,建立了再生体系[10]。通过化学诱变海滨雀稗离体再生组织,获得了耐低温的突变体[11]。2018年建立了海滨雀稗的遗传转化体系,但遗传转化效率较低且不稳定[12],且常因种子活力和纯度低等问题影响后续研究。因此,进一步优化海滨雀稗的遗传转化体系,探索更加高效稳定的转化技术,是后续进行分子生物学研究的基础。本研究比较了两种不同筛选剂对转化效率的影响,同时进一步优化了转化条件,并获得了转基因植株。
1 材料与方法
1.1 植物材料的消毒及处理
选取完全成熟且饱满的海滨雀稗‘Sea Spray’品种的成熟种子为外植体,于2020年3月在青岛农业大学草业育种实验室开展试验。种子用流水冲洗掉包衣、杂质和稃皮后,装入50 mL离心管中,在超净台中进行种子的消毒处理。用75%酒精处理30 s后,使用10% NaClO溶液涡旋消毒30 min,然后用无菌水冲洗4~6次,吸除多余水分后,并用无菌滤纸吸干表面,每次接种5~10个培养皿。
1.2 菌株、质粒、引物
选用2种质粒载体(图1A,B):内含GUS基因(β-葡萄糖醛酸糖苷酶基因)和hpt基因(潮霉素磷酸转移酶,具有潮霉素抗性)的pCAMBIA1305.2和内含GUS和bar基因(膦丝菌素乙酰转移酶基因,具有草丁膦抗性)的pCAMBIA3301;转入根癌农杆菌(Agrobacterium tumefaciens)菌株AGL1中,作为农杆菌介导转化的菌液。

图1 植物表达载体图谱Fig.1 Map of plant expression vector
1.3 不同类型的培养基
在再生体系和遗传转化体系中,使用的培养基类型及配方见表1。
如图3所示:随着接种量的增加,水解度呈现先增大后减小的趋势,在接种量为4%处达到最大值。随着接种量的继续增加,水解度反而降低,可能是由于山羊乳中的蛋白难以满足过多菌体生长需求,产酸过多抑制了蛋白的水解;或菌体释放的蛋白酶不利于在强酸条件下作用,活性被抑制。

表1 培养基的类型和配制方法Table 1 Types and preparation methods of culture medium
1.4 胚性愈伤组织的诱导继代和再生
将消毒且吸干表面水分的灭菌种子平铺于诱导培养基中,在28℃、黑暗条件下培养5~10 d时及时拔除幼芽。根据愈伤组织的诱导情况,在30~40 d时将产生的愈伤组织在诱导培养基中继代。待颗粒状的胚性愈伤组织产生后,选择颜色鲜黄且结构紧实的愈伤组织颗粒进行继代培养扩繁。扩繁90~180 d生长健壮的胚性愈伤组织均可作为后续遗传转化的材料,进行转基因试验。
选择3个不同基因型的愈伤组织,挑选生长状态良好的愈伤组织每4周继代1次,在16、24、36、48周继代时,分别选取部分愈伤组织接种于再生培养基中,在光照培养箱(28℃,16 h光照,8 h黑暗)中进行再生。每次进行再生试验的愈伤组织继代3个培养皿即3次重复,培养4~5周后统计愈伤组织的生长时间对再生率的影响,摸索出愈伤组织具有最佳再生效率的生长时间,确定愈伤组织能够作为遗传转化材料的最佳时期。
1.5 胚性愈伤组织的遗传转化
从-80℃冰箱中分别取出含有质粒pCAMBIA1305.2和pCAMBIA3301的农杆菌菌液,分别接种于20 mL含有50 mg·L-1卡那霉素和35 mg·L-1利福平的YEP液体培养基中,在28℃摇床中,200 r·min-1振荡培养12~18 h,当菌液浓度OD600值为0.6~1.0时,吸取农杆菌菌液加入灭菌离心管中,在离心机中以2000 r·min-1离心5 min,倒掉YEP液体培养液收集菌体。
用MS液体继代培养基重新悬浮至菌液浓度OD600值为0.6~1.0。将挑选出的颜色鲜黄、颗粒紧实的愈伤组织浸泡在菌液中;浸染20~30 min后,吸除愈伤组织上多余的菌液,并用灭菌滤纸吸干,将愈伤组织平铺在有灭菌滤纸的MS继代培养基中,在28℃培养箱中黑暗条件下共培养2 d。共培养后,用含有200 mg·L-1头孢霉素的无菌水漂洗掉愈伤组织上多余的菌液,将愈伤组织转移到选择继代培养基上,28℃暗培养2~3周,有农杆菌溢菌时,要及时转移至新的选择继代培养基中。每个质粒各进行了5个批次的遗传转化试验,每批转化材料接种20~30个培养皿。
1.6 筛选压的选择
选取继代16周且再生率高的基因型,进行愈伤组织继代和再生阶段的最佳筛选压试验。将一定数量的愈伤组织分别接种到含0、40、80、100、120 mg·L-1潮霉素的继代培养基、含0、10、20、60、80 mg·L-1潮霉素的再生培养基;含0、0.2、0.4、0.8、1.2 mg·L-1草丁膦的继代培养基和再生培养基。生长5周后,分别移入不含筛选剂的再生培养基中生长5周后统计再生率,3次重复,以确定抑制愈伤组织再生的最低筛选剂浓度为最佳筛选压。
1.7 遗传转化条件的优化
乙酰丁香酮(acetosyringone,AS)添加浓度的优化:在浸染菌液浓度OD600为0.6中浸染30 min,使用超声波处理5 min,比较浸染菌液中添加50、100、200 μmol·L-1浓度AS对GUS瞬时表达效率的影响。
Silwet L-77(表面活性剂)添加浓度的优化:在浸染菌液浓度OD600为0.6中浸染30 min,使用超声波处理5 min,添加100 μmol·L-1AS的转化条件下,比较浸染菌液中分别添加0.01%、0.1%、0.3%浓度Silwet L-77对GUS瞬时表达效率的影响。
真空或超声波处理时间的优化:在浸染菌液浓度OD600为0.6中浸染30 min,添加100 μmol·L-1AS的转化条件下,分别比较超声波处理或真空处理0、10、20 min,对GUS瞬时表达效率的影响。
以上每个因素的优化处理,均3次重复,共培养2 d后分别转入筛选培养基中进行转化体的筛选。
1.8 抗性愈伤组织筛选和再生
将共培养后的胚性愈伤组织在选择继代培养基上每3~4周继代一次(暗培养4~6周);然后继代到选择再生培养基并转入光照培养箱(28℃,8 h黑暗,16 h光照)培养,每3~4周继代一次。抗性植株再生后转移至选择壮苗培养基继续培养,3~5周后将抗性苗移至温室中养护。
1.9 GUS基因瞬时、稳定表达染色
将共培养2 d后的愈伤组织和筛选12~16周的抗性愈伤组织和抗性植株叶片浸于GUS染液中,置于37℃恒温箱中12 h,使用96%乙醇脱色后,统计GUS瞬时表达或稳定表达的结果。
1.1 0抗性植株的PCR检测
通过CTAB法少量粗提野生型和抗性再生植株的DNA,通过snapgene软件设计引物并交由生工生物工程(上海)股份有限公司合成。hpt基因的PCR扩增516 bp引物为:hpt-F(5′-ATGTTGGCGACCTCGTATT-3′);hpt-R(5′-CGTTATGTTTATCGGCACTTT-3′)。bar基 因 的PCR扩 增434 bp引 物 为:bar-F(5′-GCTGCCAGAAACCCACG-3′);bar-R(5′-CTGCACCATCGTCAACCAC-3′)。
1.1 1数据统计与分析
分别统计每个批次进行农杆菌介导转化的愈伤组织数,在之后的筛选过程中,统计抗性愈伤组织数、抗性愈伤组织和抗性再生植株叶片GUS稳定表达的数量及最终经检测的阳性转基因植株数。

运用SPSS 25.0统计分析软件对所有数据进行单因素方差分析,并用Duncan法进行多重比较,数据为平均值±标准差(SD);采用Excel 2019进行试验数据的整理和制图。
2 结果与分析
2.1 愈伤组织培养年龄对再生的影响
海滨雀稗的成熟种子在诱导培养基中诱导培养6~8周,即可诱导出黄色颗粒状且结构紧实的胚性愈伤组织(图2A,B)。每粒种子培养成的愈伤组织标记为一个独立的基因型。选取最优的愈伤组织颗粒进行扩繁,用镊子将其分割成2 mm左右的小颗粒进行培养扩繁。在愈伤组织扩繁的同时,对来自不同基因型的部分愈伤组织进行再生(图2C,D)。通过统计继代时间对愈伤组织再生率和褐化率的影响,可选择具有最高再生率的基因型和愈伤组织年龄作为后续遗传转化的材料。
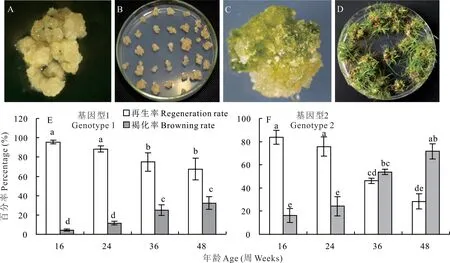
图2 愈伤组织年龄对再生的影响Fig.2 Effect of callus age on regeneration
随继代培养时间的延长,所有基因型愈伤组织的再生率均降低。基因型1和2在继代培养24周后的再生率均无显著下降;继代培养36周后的再生率均显著下降,褐化率均显著升高;继代培养48周基因型2的再生率仅28.4%,愈伤组织的褐化率高且质量下降较快。由此可见,愈伤组织继代培养的年龄对再生的影响因基因型的不同而不同。基因型1的愈伤组织状态在多次继代后,仍能保持较好的生长状态,继代48周的愈伤组织状态大部分仍可以保持黄色的紧实颗粒状,且再生率在67.6%以上,依然可以作为后续遗传转化的基因型。但基因型2在培养36周左右的愈伤组织质量下降明显,已不适合做后续的遗传转化材料(图2E,F)。
2.2 潮霉素筛选压的确定
愈伤组织的继代培养和再生过程对潮霉素敏感程度不同,因此不同筛选阶段的最佳筛选压也不同。继代培养阶段的愈伤组织对潮霉素抗性较高,在含有120 mg·L-1潮霉素的继代培养基中培养4周后,转移至再生培养基生长4周,仍有25.0%的愈伤组织具有再生能力(图3A,C)。愈伤组织在含不同浓度潮霉素的再生培养基上表现得敏感度较高,当再生培养基中添加80 mg·L-1潮霉素时,再生率可降低至22.2%(图3B,D)。由此可见,海滨雀稗胚性愈伤组织的再生阶段对潮霉素较为敏感,是农杆菌介导转化后抗性愈伤组织筛选的重要阶段,可在继代培养基中添加120 mg·L-1潮霉素筛选6~8周,然后转入含有80或100 mg·L-1潮霉素的选择再生培养基继续进行筛选,并且可适当延长筛选时间,以尽量降低假阳性转化体的存在。
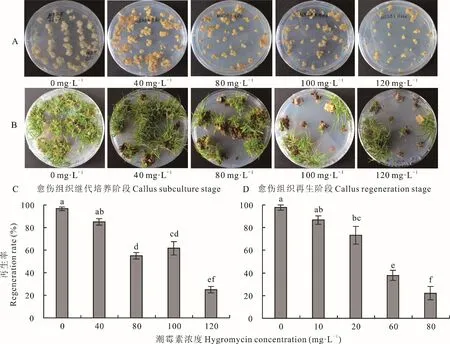
图3 潮霉素对胚性愈伤组织继代培养和再生的影响Fig.3 Effects of hygromycin on embryogenic callus subculture and regeneration
2.3 草丁膦筛选压的确定
愈伤组织在继代、再生阶段对草丁膦的敏感程度均较高。接种于含有草丁膦继代培养基中的愈伤组织的生长速度和质量均受到了明显的抑制,愈伤组织随着草丁膦浓度的升高,生长速度受抑制的程度越高;在含有1.2 mg·L-1草丁膦的继代培养基中培养4周后,愈伤组织最小且颜色呈黄褐色;接种到再生培养基后仅有1.67%的愈伤组织能够再生,且再生苗生长极慢(图4A,C)。愈伤组织在含不同浓度草丁膦再生培养基中的敏感度相对较低,在再生培养基中添加0.4 mg·L-1草丁膦,对再生率影响较小;当添加1.2 mg·L-1草丁膦时,仍有15.0%的愈伤组织可以再生,再生苗部分生长受到较大抑制,但仍有再生苗生长较好(图4B,C)。由此可见,海滨雀稗的胚性愈伤组织对草丁膦较为敏感的阶段是在愈伤组织的继代阶段,也是农杆菌介导转化后抗性愈伤组织筛选的关键阶段,在继代和再生阶段均可以使用1.2 mg·L-1草丁膦作为适宜的筛选压。
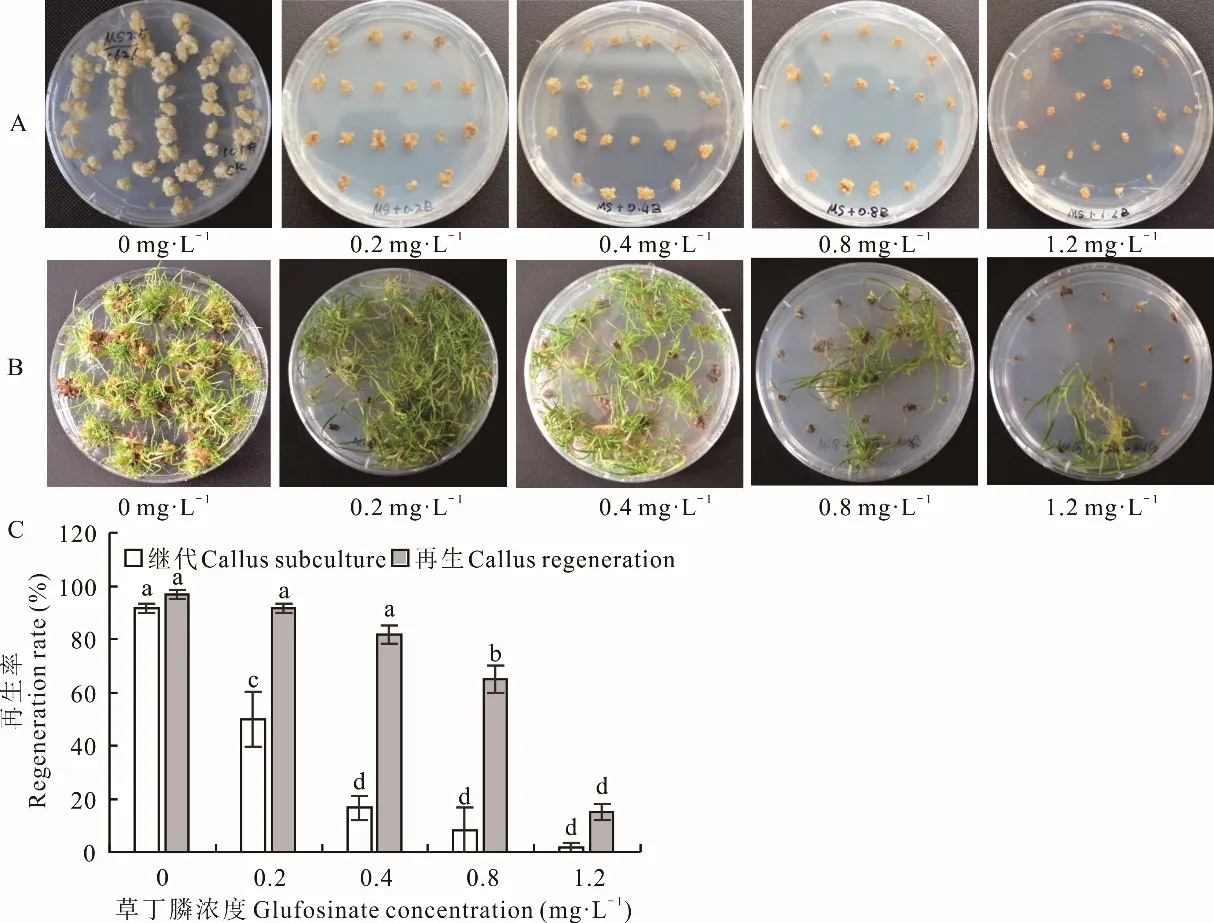
图4 草丁膦对胚性愈伤组织继代培养和再生的影响Fig.4 Effects of glufosinate on embryogenic callus subculture and regeneration
2.4 转化条件的优化
为了进一步提高农杆菌介导的转化效率,试验通过GUS瞬时表达染色,对相关的影响因素进行了单因素条件的优化。在浸染转化共培养2 d后,统计愈伤组织的GUS瞬时染色效率,从而摸索影响遗传转化的最佳处理条件。添加适当浓度AS到农杆菌的浸染液中,可以显著提高瞬时转化效率,但随着添加AS浓度的增加对转化效率的影响不显著(图5A,E)。在浸染的农杆菌菌液中添加低浓度的表面活性剂Silwet L-77可显著提高瞬时表达效率,添加0.01%和0.1%的Silwet L-77后其GUS瞬时表达效率显著提高,分别为78.07%和80.1%,虽然添加0.5%高浓度的Silwet L-77的GUS瞬时表达效率最高,但是却对愈伤组织造成明显的伤害,在共培养后,愈伤组织明显褐化且表面呈现粘稠状,极大降低了愈伤组织的后续繁殖和再生(图5B,F)。在浸染阶段,通过增加超声波处理,可在愈伤组织表面产生更多有利农杆菌介导转化的小伤口,可以显著地提高瞬时表达效率。超声波处理20 min的GUS瞬时表达效率最高且差异显著,愈伤组织的GUS瞬时表达效率高达94.17%。因超声波处理后愈伤组织状态没有明显改变,且后续筛选过程中无法跟踪评估更长时间的超声波处理是否对愈伤组织的伤害程度更高,因此可以选择20 min超声波处理,或者适当降低处理时间(图5C,G)。在浸染阶段通过真空处理,可有效增加愈伤组织和菌液的接触,从而显著提高GUS瞬时表达效率,但处理10或20 min对表达效率无显著差异,因此为尽量降低对愈伤组织的伤害,可以选择10 min为最佳的真空处理时间(图5D,G)。
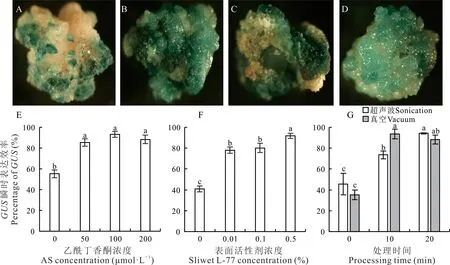
图5 不同因素对GUS瞬时表达效率的影响Fig.5 Factors affecting on percentage of transient GUS expression
2.5 农杆菌介导的不同质粒GUS稳定表达效率和转化效率的统计
挑选黄色颗粒状且结构紧实的愈伤组织,在灭菌的空培养皿中分别用含有两种不同质粒的AGL1农杆菌菌液进行浸染,在浸染菌液浓度OD600为0.6时,菌液中同时添加100 μmol·L-1AS和0.01%的Silwet L-77,浸染过程中先超声波处理20 min,然后再真空处理10 min,浸染30 min后共培养2 d。之后分别接种于含有120 mg·L-1潮霉素、200 mg·L-1头孢噻肟(图6A)和含有1.2 mg·L-1草丁膦、200 mg·L-1头孢噻肟(图6D)的选择继代培养基进行抗性愈伤组织的筛选,继代3~5次后,将抗性愈伤组织进行GUS染色呈深蓝色(图6B,E),表明GUS基因在抗性愈伤组织中获得了稳定表达。将抗性愈伤组织再分别转到含有80 mg·L-1潮霉素和200 mg·L-1头孢噻肟或者含有1.2 mg·L-1草丁膦和200 mg·L-1头孢噻肟的选择再生培养基上,再生的同时进一步筛选,筛选过程中非抗性愈伤组织逐渐变褐死亡,而部分抗性愈伤组织能够在选择再生培养基中再生出健康的植株(图6C,F)。将抗性再生的幼苗进行壮苗后,转至温室中单株种植(图6G)。分别剪取部分抗性再生植株的叶片,进行GUS染色并用酒精脱色后叶片两端仍呈深蓝色(图6H),说明GUS基因在抗性植株中稳定表达。

图6 农杆菌介导的胚性愈伤组织的遗传转化及GUS染色Fig.6 Agrobacterium-mediated transformation of embryogenic calli and result of GUS staining
在以上农杆菌介导转化的最优条件下,2种质粒各进行了5个批次的胚性愈伤组织转化。共转化hpt做筛选标记的愈伤组织329粒,筛选出74个克隆的抗性愈伤组织,其中55个克隆成功再生出抗性苗,其中抗性苗的叶片GUS染色呈现蓝色的共48个克隆,占获得抗性再生植株克隆数的87.3%,根据PCR鉴定的阳性抗性苗的平均转化效率为14.46%。共转化bar做筛选标记的愈伤组织355粒,筛选获得抗性愈伤组织和抗性苗的数量均较低,平均转化效率为5.65%。由此可见,以潮霉素为筛选标记的转化效率较高,适合在海滨雀稗转基因中使用(表2)。

表2 两种不同质粒的农杆菌介导的遗传转化效率Table 2 Summary of transformation efficiencies of Agrobacterium transformation using embryogenic callus
2.6 抗性再生植株的PCR检测
通过分别扩增外源hpt或bar片段,对野生型和农杆菌介导转化的抗性再生植株进行阳性检测。结果表明,野生型植株在516或434 bp处均无扩增条带,对获得的叶片GUS染色为深蓝色的64株具有潮霉素抗性的再生植株进行PCR检测,除No.6没有扩增出hpt条带外,其他63株均在叶片中扩增出516 bp的阳性条带,说明外源hpt基因在受体植株中获得了稳定表达(图7A)。在18株叶片GUS染色为深蓝色的草丁膦抗性植株中,均扩增出了434 bp的阳性条带,表明bar基因已在转基因海滨雀稗植株的基因组稳定表达(图7B)。

图7 抗性再生植株的PCR检测Fig.7 PCR test results of resistant regenerated plants
3 讨论
随着分子设计育种的发展,转基因育种以其周期短、目标性状精准可控等优点成为草坪草育种中的重要方法。海滨雀稗应用广泛且具有非常强的耐盐性,是目前最耐盐的暖季型草坪草[13],然而目前国内育种进程缓慢,所有商业品种均来自国外[14-17]。目前,农杆菌介导的遗传转化具有多个突出优点,仍是禾本科转基因的主要方法,然而禾本科因不是农杆菌的天然宿主,特别是暖季型草坪草的再生和转化难度更大[18-19]。本研究建立了hpt和bar两种筛选标记的遗传转化体系,并分别获得了阳性转基因植株,潮霉素作为筛选剂的平均转基因效率可以达18.93%。海滨雀稗高效的遗传转化体系的建立为进一步加快育种进程奠定了坚实的基础。
以成熟种子作为愈伤组织诱导的外植体,具有不受季节性影响并且取材方便的优点[20],目前已在多种草坪草如黑麦草(Lolium perenne)、紫羊茅(Festuca rubra)、日本结缕草(Zoysia japonica)、早熟禾(Poa annua)成功建立了离体再生体系[21]。此外,也可以采用未成熟胚、茎尖分生组织、根尖、花序、匍匐茎等部位作为禾本科的外植体来源,建立组织培养再生体系[22]。Liu等[11]以海滨雀稗‘Sea Spray’品种的成熟种子为外植体建立了再生体系,比较了不同外源物质对组织培养再生的影响。因海滨雀稗的自交不亲和性,每粒种子代表着不同的遗传信息,本研究选择来自同一基因型的愈伤组织,比较了继代时间对再生率的影响,最佳的可用于遗传转化的愈伤组织继代时间为36周左右,既能保证有足够数量的愈伤组织,又可以保证具有较高的再生效率。
潮霉素磷酸转移酶基因(hpt)和膦丝菌素乙酰转移酶基因(bar)是禾本科转化中最常用的筛选标记基因[23-24],已在多种转基因禾本科草中获得成功[25-28]。海滨雀稗在不同的发育阶段对潮霉素和草丁膦的敏感性有所不同。海滨雀稗的胚性愈伤组织在继代阶段对草丁膦较为敏感,是筛选的关键阶段,1.2 mg·L-1草丁膦可作为整个筛选过程的适宜筛选压。在继代阶段愈伤组织对潮霉素的抗性较高,在含有120 mg·L-1潮霉素的继代培养基中仍有部分可再生,而再生阶段对潮霉素的耐性较低,在80 mg·L-1潮霉素浓度的再生培养基中愈伤组织再生率较低。由此可见,海滨雀稗具有较高的潮霉素耐性,而在高羊茅(Festuca elata)、柳枝稷(Panicum virgatum)、假俭草(Eremochloa ophiuroides)和结缕草中使用的潮霉素筛选浓度在50 mg·L-1左右,并获得了转基因植株[29-32]。在农杆菌浸染转化过程中,各种处理对愈伤组织都具有一定的伤害,而潮霉素对愈伤组织也具有不良影响,对阳性愈伤组织的再生具有较大压力。因此,在选择继代的筛选阶段使用相对低浓度的潮霉素,抑制部分假阳性愈伤组织生长的同时,可对阳性的愈伤组织生长提供缓冲的时间;而在愈伤组织选择再生的筛选阶段使用高浓度的筛选压,由此获得了更高的转化效率。
遗传转化过程的不同处理可以明显影响转基因效率。本研究根据前期建立的海滨雀稗遗传体系,在转化条件菌液浓度OD600=0.6,辅以超声波处理,共培养2 d的基础上[12],通过添加100 μmol·L-1乙酰丁香酮和0.01%的Silwet L-77,并提高超声波的处理时间至20 min,同时辅以真空处理10 min,明显提高了海滨雀稗的平均遗传转化效率。以潮霉素作为筛选剂的平均转基因效率提高至14.46%,并且还获得了以草丁膦为筛选剂的转基因植株。
乙酰丁香酮(AS)通过诱发农杆菌Ri或Ti质粒上Vir区基因的活化,可有效地提高转化效率[33-34]。不同AS浓度(50~400 μmol·L-1)对不同植物受体转化效率的影响程度不同[35]。添加50~300 μmol·L-1的AS,丁香罗勒(Ocimum gratissimum)的GUS表达效率呈升高趋势,但添加400 μmol·L-1时表达效率下降[36]。在花生(Arachis hypogaea)转化 的 共培养过 程的培养 基 中添加200 μmol·L-1,瞬时转 化效率最 高 为80%[37]。在 金发草(Pogonatherum paniceum)的转化中添加40 mg·L-1AS的转化效率最高为67.3%[38]。海滨雀稗的转化中通过添加50~200 μmol·L-1的AS均可获得较高的GUS瞬时表达效率。
表面活性剂能够在农杆菌介导转化过程中,通过增加细胞膜通透性,提高农杆菌T-DNA插入受体细胞的效率[39-40]。植物遗传转化中,Silwet L-77是应用较为广泛的一种表面活性剂,可有效提高转化效率[41]。在菌液中添加0.01%~0.02%浓度的Silwet L-77,可提高玉米(Zea mays)幼胚愈伤组织的遗传转化效率[42]。本研究中,添加0.01%和0.1%浓度的Silwet L-77的瞬时转化效率较高;浓度提高至0.5%的瞬时转化效率最高,但愈伤组织外观已部分或全部褐变。在玉米胚珠的转化中添加0.1% Silwet L-77的转化效率最高[41],本试验结果与其相似。由此可见,添加适当浓度的Silwet L-77可有效提高瞬时转化效率,但因受体材料的质地不同,对表面活性剂耐受力差异较大,需要通过试验确定最佳添加浓度。
超声波处理可通过在愈伤组织表面形成微伤口,使农杆菌更易穿透细胞壁[43];真空处理可在农杆菌浸染中增加和愈伤组织的深度接触,从而均可有效地提高转化效率[44]。但需根据受体材料的质地和特性,选择合适的处理时间和强度。本研究中,在农杆菌浸染过程中分别辅以超声波处理20 min和真空处理10 min,均可显著提高转化效率。
4 结论
本研究以海滨雀稗‘Sea Spray’成熟种子为外植体,进一步优化了海滨雀稗遗传转化体系。愈伤组织继代36周后的再生率会显著下降,以继代24周的愈伤组织为转化材料,在菌液(OD600=0.6)中添加100 μmol·L-1乙酰丁香酮和0.01%的Silwet L-77,浸染过程中辅以超声波处理20 min或真空处理10 min,浸染30 min后共培养2 d。在继代和再生阶段使用最佳的筛选压进行筛选,分别获得了表达hpt和bar基因的转基因植株。潮霉素更适合作为海滨雀稗遗传转化中的筛选剂,能够获得较高的转化效率。
