预冻后冻藏温度对金鲳鱼品质的影响
2023-02-05梁释介孙晓悦冯淳淞谭雨青罗永康
梁释介,孙晓悦,李 晴,冯淳淞,洪 惠,谭雨青,罗永康
(中国农业大学食品科学与营养工程学院,北京 100083)
金鲳鱼,学名卵形鲳鲹(Trachinotus ovatus),是我国重要的海洋经济鱼类[1]。因其营养丰富、肉质细嫩且味道鲜美,而深受消费者欢迎。近年来,金鲳鱼的人工养殖产量逐年递增,2022中国渔业统计年鉴数据[2]显示,2021年我国金鲳鱼养殖产量达到243 908 t,较2020年金鲳鱼养殖产量增长139.85%,位列海水鱼养殖产量第2名。
金鲳鱼具有丰富的营养物质且水分含量较高,在捕捞后的运输和销售过程中容易滋生细菌并迅速劣变,因此在贮运过程中常采用低温保鲜。目前市场上主要采用冰鲜和真空包装冷冻2 种保鲜方式[3]。冰鲜可以延缓金鲳鱼品质劣变并确保新鲜度,但是贮藏时间较短,而真空包装冷冻的贮藏时间较长,因此金鲳鱼远距离销售一般以冻品形式。冻结过程中会有冰晶形成,引起细胞破裂、肌肉纤维变形,从而导致鱼肉水分流失、蛋白质氧化、品质下降等问题[4-6]。有研究表明,冰晶大小和分布受冻结速率、冻结温度和冻藏温度影响[7-8]。Cai Luyun等[9]研究发现先于-55 ℃完全冻结后,再置于-18 ℃冻藏的日本鲈鱼鱼肉品质优于普通冻结处理后冻藏的鱼肉;李秀霞等[10]研究发现-40 ℃超声辅助冷冻处理海鲈鱼片冻结速率快、冰晶小且分布均匀,能够有效降低肌原纤维蛋白氧化程度;巩涛硕等[11]研究发现螺旋式冻结处理的金鲳鱼肉肌原纤维间隙小、分散均匀,组织冰晶细小,品质优于其他冻结方式。
目前研究大多聚焦于冻结速率、冻结温度与冻结方式对贮藏期间鱼肉品质的影响,而对于预先冷冻处理后,冻藏温度对其品质影响的研究较少;此外,目前绝大多数研究聚焦于金鲳鱼鱼片在贮藏期间品质变化,然而在实际运输贮藏过程,金鲳鱼一般以整鱼形式进行。因此,研究预先冷冻处理,再置于不同温度贮藏对金鲳鱼整鱼品质的影响,可以为其品质控制提供理论依据,对促进金鲳鱼贮运和销售具有重要现实意义。
1 材料与方法
1.1 材料与试剂
金鲳鱼(平均体质量(0.72f0.01) kg)由海南蓝粮科技有限公司提供,捕获后24 h内冷链空运至北京实验室。将金鲳鱼随机分为2 组,每组30 条,整鱼真空包装后置于低温冷冻冰箱(-40 ℃)中预冻24 h,随后分别于-20、-40 ℃冰箱中冷冻贮藏。每隔4 周,从每组随机抽取3 条金鲳鱼放入4 ℃冰箱解冻24 h。解冻后进行感官评定,然后取背部肉进行其余指标测定。
哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES)、氨丁三醇(trometamol,Tris)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙醛2,4-二硝基苯腙(acetaldehyde 2,4-dinitrophenylhydrazone,DNPH)美国Sigma公司;亚硫酸钠、无水硫酸铜、酒石酸钾钠、氯化钠、氢氧化钠、马来酸、尿素、无水乙醇、乙酸乙酯、盐酸胍、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三氯乙酸(trichloroacetic acid,TCA)、浓盐酸、5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DNPH)、硫代巴比妥酸(thiobarbituric acid,TBA)、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)、溴酚蓝(bromophenol blue,BPB) 国药集团化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
BD-151WGHES冷冻冰箱 青岛海尔集团;DW-FL270低温冷冻冰箱 安徽中科美菱低温科技股份有限公司;T10分散均质机 德国IKA公司;FE-20 pH计 上海梅特勒-托利多科技有限公司;TGL16A冷冻离心机 长沙平凡仪器仪表有限公司;F97荧光分光光度计 上海棱光技术有限公司;14886真空包装机 宁波得力集团有限公司;ST5020全自动染色机 德国Leica仪器有限公司;Pannoramic MIDI病理扫描仪 山东斯瑞缔医疗科技有限公司。
1.3 方法
1.3.1 感官评价
参考GB/T 18108ü2019《鲜海水鱼通则》[12]的方法,略作修改。感官评定人员由10 人(3 男7 女)组成,每位评定人员对解冻后的金鲳鱼进行感官评价,评价指标包括鱼体、肌肉、鱼眼、鱼鳃及蒸煮品质。感官评价结果以平均分表示,并计算感官总得分,总分30 分表示绝对新鲜,低于15 分表示已发生较明显的腐败。
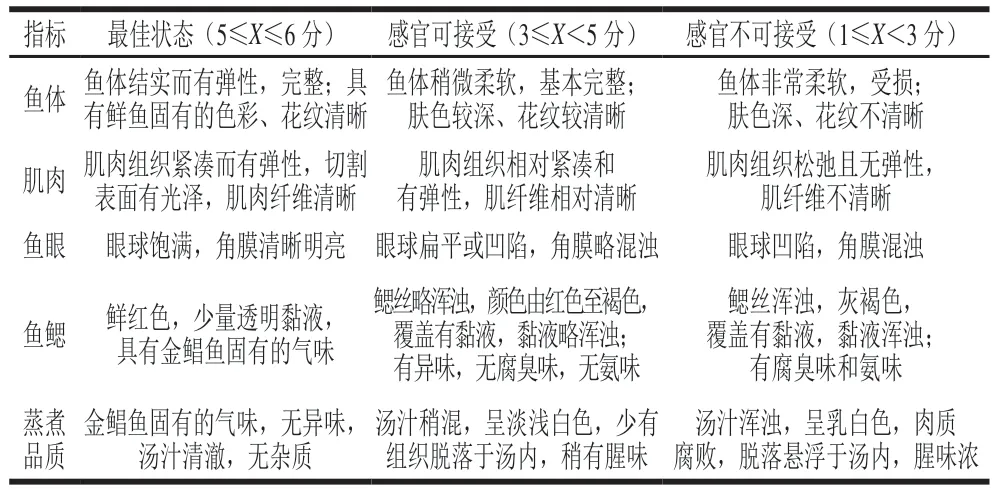
表1 金鲳鱼感官评价标准Table 1 Criteria for sensory evaluation of golden pomfret
1.3.2 离心损失率的测定
取2 g背部肉放入50 mL离心管中,准确记录鱼肉质量m1(g),离心管中提前放入玻璃珠和滤纸。将离心管在冷冻离心机中离心(4 ℃、1 590hg、10 min)。称量离心后鱼肉质量m2(g)。按式(1)计算离心损失率。
1.3.3 肌原纤维蛋白的制备
参考Liu Ru等[13]的方法。取2 g搅碎鱼肉于50 mL离心管中,加入15 mL去离子水(4 ℃),冰浴均质30 s后低温离心(10 000hg、10 min)。离心后弃去上清液,向沉淀中加入15 mL 0.3% NaCl(m/m)溶液(4 ℃),冰浴均质30 s,低温离心(10 000hg、10 min)。弃去上清液,向沉淀中加入30 mL Tris-马来酸缓冲液(0.6 mol/L NaCl-20 mmol/L Tris-马来酸,pH 7.0),冰浴均质30 s,将匀浆液放置于4 ℃冰箱,静置1 h,然后离心(4 ℃、10 000hg、10 min),上清液即为肌原纤维蛋白溶液。用0.6 mol/L NaCl(pH 7.0)调节蛋白质量浓度,存放于4 ℃冰箱备用。
1.3.4 总巯基含量与二硫键含量测定
参考卢涵[14]的方法。
总巯基含量:取0.5 mL 4 mg/mL肌原纤维蛋白溶液,加入4.5 mL缓冲液A(0.2 mol/L Tris-HCl、8 mol/L尿素、3 mmol/L EDTA、1% SDS,pH 8.0),充分混匀后,取4 mL混合液,加入0.5 mL缓冲液B(10 mmol/L DTNB-10 mmol/L Tris-HCl,pH 8.0),于40 ℃下孵育25 min,室温下冷却后于412 nm波长处测定其光密度,空白组用0.6 mol/L NaCl(pH 7.0)代替蛋白质溶液,所用摩尔吸光系数为13 600 L/(molgcm)。按式(2)计算总巯基含量,结果以蛋白计。
式中:OD空白为空白组的光密度;OD样品为样品的光密度。
二硫键含量:将缓冲液A换为缓冲液C(0.2 mol/L Tris-HCl、8 mol/L尿素、3 mmol/L EDTA、1% SDS、0.1 mol/L亚硫酸钠,pH 8.0),将缓冲液B换为缓冲液D(0.2 mol/L Tris-HCl、8 mol/L尿素、3 mmol/L EDTA、1% SDS、0.1 mol/L亚硫酸钠、10 mmol/L NTSB,pH 9.5),其余步骤同上。按式(3)计算二硫键含量,结果以蛋白计。
式中:OD空白为空白组的光密度;OD样品为样品的光密度。
1.3.5 羰基含量测定
参考Oliver等[15]的方法。取1 mL 4 mg/mL肌原纤维蛋白溶液,加入1 mL 10 mmol/L DNPH-2 mol/L盐酸溶液,避光反应1 h(每15 min漩涡振荡1 次)。反应完毕后加入1 mL 20 g/100 mL TCA溶液终止反应并离心(14 000hg,5 min)。弃去上清液后,沉淀用乙醇-乙酸乙酯(1∶1,V/V)洗涤3 次。洗涤后的沉淀用3 mL 6 mol/L盐酸胍-2 mol/L盐酸溶解并于37 ℃水浴锅中孵育15 min。室温下冷却后于370 nm波长处测定溶液光密度,空白组用0.6 mol/L NaCl(pH 7.0)代替蛋白溶液。摩尔吸光系数为22 000 L/(molgcm)。按式(4)计算羰基含量,结果以蛋白计。
式中:OD空白为空白组的光密度;OD样品为样品的光密度。
1.3.6 表面疏水性的测定
参考Utrera等[16]的方法,略作调整。将200 μL 1 mg/mL BPB加入1mL 5 mg/mL肌原纤维蛋白溶液中,空白组用1 mL PIPES缓冲溶液(50 mmol/L PIPES,0.3 mol/L NaCl,pH 6.25)代替蛋白质样品。在室温下搅拌10 min后,低温离心(4 ℃、2 000hg、15 min)。取上清液稀释20 倍后于595 nm波长处测定其光密度。表面疏水性由BPB结合量表示。按式(5)计算表面疏水性。
式中:OD空白为空白上清液的光密度;OD样品为样品上清液的光密度。
1.3.7 内源荧光强度的测定
参考Ren Lina等[17]的方法,略作调整。取0.05 mg/mL肌原纤维蛋白溶液,用荧光分光光度计测定。参数设置为:激发波长295 nm,激发和发射狭缝宽度均为10 nm,发射波长扫描范围为300~500,扫描速率6 000 nm/min。每个样品做3 个平行,每个平行扫描2 次。
1.3.8 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARs)值的测定
参考Duan Jingyun等[18]的方法。取2 g绞碎的鱼肉加入16 mL 5 g/100 mL TCA溶液,再加入100 μL 2 g/L BHT-乙醇,匀浆30 s然后离心(5 000hg、3 min)。取5 mL上清液加入1 mL 0.01 mol/L TBA,混匀后沸水浴40 min,取出后置于冰水浴中快速降温,于532 nm波长处测定OD532nm,结果以每千克样品所含丙二醛(malondialdehyde,MDA)质量计。按式(6)计算TBARs值。
1.3.9 组织微观结构观察
参考Li Qing等[19]的方法,略作调整。将金鲳鱼背部肌肉沿着肌原纤维的纹理水平和垂直切割,置于4%的组织固定溶液中浸泡24 h。肌肉在无水乙醇和80%、70%乙醇溶液中脱水,并用石蜡包埋。对样品进行切片,厚度约为5 µm,切片用苏木精和伊红溶液染色。使用250 倍放大的病理图像扫描仪对金鲳鱼肌肉的微观结构进行拍照。
1.4 数据处理
各个指标均进行3 次平行实验,所有实验数据使用Microsoft Office Excel 2019进行处理,结果以平均值±标准差表示,使用SPSS 26.0软件进行显著性分析,选择单因素方差分析中的Tukey-test,置信区间取95%(P<0.05)。使用Microsoft Office Excel 2019作图。
2 结果与分析
2.1 金鲳鱼的感官评价结果
由表2可知,新鲜金鲳鱼在鱼体、肌肉、鱼眼、鱼鳃、蒸煮实验及感官总分的初始评分分别为5.83、5.70、5.57、5.70、5.77和28.58。随着冻藏时间延长,各感官指标评分均呈下降趋势。第24周时,-20 ℃和-40 ℃冻藏的金鲳鱼鱼体与肌肉感官评分出现显著差异(P<0.05),其余指标的感官评分没有出现显著差异。任何一个指标感官评分低于3 分或感官总评分低于15 分则认为感官不可接受,而在整个贮藏期间2 组金鲳鱼各感官指标均未低于限值,因此在24 周的冻藏时间内,-20 ℃和-40 ℃冻藏的金鲳鱼均保持良好的感官品质。在整个贮藏期间,-20 ℃冻藏的金鲳鱼的感官总评分均低于-40 ℃条件下冻藏的金鲳鱼,并在第20周与第24周出现显著差异(P<0.05),说明降低冻藏温度能够延缓金鲳鱼在贮藏过程中感官品质下降。

表2 金鲳鱼在不同温度冻藏过程中感官评分的变化Table 2 Sensory changes of golden pomfret during frozen storage at different temperatures
2.2 金鲳鱼肉的离心损失
由图1可知,新鲜金鲳鱼肉的离心损失率为8.07%,随着冻藏时间延长,2 组金鲳鱼肉的离心损失率均呈上升趋势,在第24周,-20、-40 ℃冻藏的金鲳鱼离心损失分别为27.73%和25.01%。-20 ℃冻藏的金鲳鱼在整个冻藏期间离心损失率均高于-40 ℃,但无显著差异(P>0.05)。在冷冻过程中,鱼肉中的水分会形成冰晶,可能引起鱼肉肌原纤维蛋白变性,进而导致水分流失。结果表明经过预冻后不同冻藏温度对金鲳鱼肉的离心损失率无显著影响。
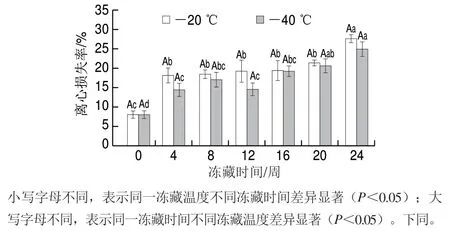
图1 金鲳鱼在不同温度冻藏过程中离心损失的变化Fig. 1 Changes in centrifugal loss of golden pomfret during frozen storage at different temperatures
2.3 金鲳鱼肉肌原纤维蛋白总巯基含量
总巯基含量是评价蛋白质氧化程度的重要指标,巯基会被氧化成二硫键及其他氧化产物[20]。由图2可知,不同冻藏温度下金鲳鱼肉肌原纤维蛋白的总巯基含量均呈现下降趋势。2 组金鲳鱼肉肌原纤维蛋白的巯基含量在冻藏前4 周快速下降,随后缓慢下降,相较于初值分别下降48.2%及44.5%。-20 ℃冻藏条件下金鲳鱼肉肌原纤维蛋白的总巯基含量在贮藏过程中都低于-40 ℃冻藏的样品,但差异不显著(P>0.05)。表明经过预冻后不同冻藏温度对金鲳鱼肉肌原纤维蛋白的总巯基含量减少的影响较小。
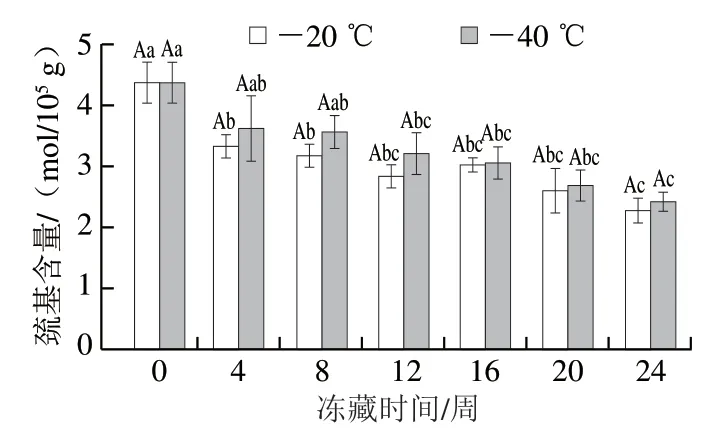
图2 不同温度冻藏过程中金鲳鱼肉肌原纤维蛋白总巯基含量的变化Fig. 2 Changes in total sulfhydryl content of myofibrillar proteins in golden pomfret muscle during frozen storage at different temperatures
2.4 金鲳鱼肉肌原纤维蛋白二硫键含量
由图3可知,经2 种温度冻藏的金鲳鱼肉肌原纤维蛋白二硫键含量随冻藏时间延长均呈上升趋势,且第24周的二硫键含量显著高于第1周(P<0.05),这与总巯基含量的下降相对应,这说明在冻藏期间肌原纤维蛋白逐渐被氧化。冻藏24 周后,-20、-40 ℃冻藏条件下金鲳鱼肉肌原纤维蛋白的二硫键含量分别为3.24、3.69 mol/105g,相较于初值分别增加61.2%及83.6%,但不同温度冻藏的金鲳鱼肉肌原纤维蛋白的二硫键含量无显著差异(P>0.05),表明经过预冻后不同冻藏温度对金鲳鱼肉肌原纤维蛋白二硫键形成的影响较小。
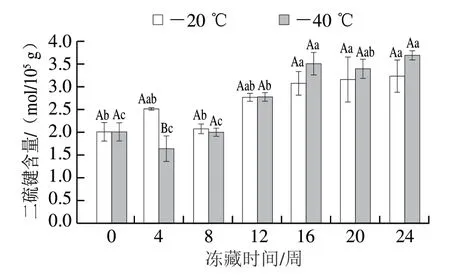
图3 不同温度冻藏过程中金鲳鱼肉肌原纤维蛋白二硫键含量的变化Fig. 3 Changes in disulfide bond content of myofibrillar protein in golden pomfret muscle during frozen storage at different temperatures
2.5 金鲳鱼肉肌原纤维蛋白的羰基含量
羰基含量是评价蛋白质氧化程度最重要的指标之一,是特定氨基酸氧化修饰的重要产物。由图4可知,在冻藏前4 周,-20 ℃与-40 ℃冻藏的样品羰基含量均无明显变化。随后,2 个温度冻藏的样品的羰基含量均呈现增加趋势,并且在冻藏第8周急剧上升。这与马新悦等[21]研究的冻藏小黄鱼的结果类似。冻藏金鲳鱼肉肌原纤维蛋白的羰基含量最初为4.40 nmol/mg,冻藏20 周后,-20 ℃金鲳鱼肉肌原纤维蛋白的羰基含量为29.36 nmol/mg,之后略微下降,在24 周时羰基含量为24.95 nmol/mg,此时-40 ℃下金鲳鱼肉肌原纤维蛋白的羰基含量为26.04 nmol/mg。羰基含量上升说明在冻藏过程中鱼肉蛋白发生了氧化,且随冻藏时间的延长,氧化程度不断加深,但经过预冻后不同温度冻藏的金鲳鱼肉肌原纤维蛋白的羰基含量无显著差异。

图4 不同温度冻藏过程中金鲳鱼肉肌原纤维蛋白羰基含量的变化Fig. 4 Changes in carbonyl content of myofibrillar proteins in golden pomfret muscle during frozen at different temperatures
2.6 金鲳鱼肉肌原纤维蛋白的表面疏水性
表面疏水性反映蛋白表面疏水性氨基酸的暴露情况,预示蛋白质空间构象的改变。由图5可知,金鲳鱼肉肌原纤维蛋白的BPB结合量初值为24.85 μg,不同冻藏温度下金鲳鱼肉肌原纤维蛋白的表面疏水性在贮藏前12 周呈上升趋势,-20、-40 ℃贮藏下金鲳鱼肉肌原纤维蛋白的BPB结合量上升至49.00 μg和54.33 μg,随后缓慢下降。桑燕菲等[22]研究也发现冻藏小龙虾的表面疏水性先上升后下降。表面疏水性的升高可能是由于冻藏过程中蛋白质发生氧化变性,使得蛋白质空间结构逐渐展开,导致隐藏于蛋白内部的疏水性氨基酸暴露[23]。贮藏后期表面疏水性下降可能是由于展开的蛋白质分子发生进一步聚集,使暴露的疏水部分被掩盖[24]。有研究发现冻藏过程发生的蛋白质侧链氧化会导致蛋白质之间疏水作用力增强,使得表面疏水性下降[25-26]。不同温度冻藏的金鲳鱼肉肌原纤维蛋白的表面疏水性之间无显著差异(P>0.05),表明经过预冻后金鲳鱼肉肌原纤维蛋白结构变化是随着冻藏时间的延长而逐渐发生,受冻藏温度的影响较小。

图5 不同温度冻藏过程中金鲳鱼肉肌原纤维蛋白表面疏水性的变化Fig. 5 Changes in surface hydrophobicity of myofibrillar proteins in golden pomfret muscle during frozen at different temperatures
2.7 金鲳鱼肉肌原纤维蛋白内源荧光强度
内源荧光光谱技术可用来监测蛋白质分子三级结构,通过测定色氨酸残基的内源荧光图谱来表征肌原纤维蛋白的构象变化及氧化程度[27]。由图6可知,在-20、-40 ℃冻藏的金鲳鱼肉肌原纤维蛋白的内源荧光强度都在贮藏前8 周内出现大幅度降低,随后缓慢降低。Lefevre等[28]研究发现内源荧光强度的降低与色氨酸吲哚侧链的变性和暴露相关。荧光强度的逐渐降低表明冻藏会导致金鲳鱼肉肌原纤维蛋白色氨酸残基的暴露和三级结构的变化[30]。在第24周时,在-20、-40 ℃冻藏的金鲳鱼肉肌原纤维蛋白的内源荧光强度分别下降64.80%和57.34%。结果表明降低冻藏温度能够保护金鲳鱼肉肌原纤维蛋白变性和结构变化程度。

图6 不同温度冻藏过程中金鲳鱼肉肌原纤维蛋白内源荧光强度的变化Fig. 6 Changes in intrinsic fluorescence intensity of myofibrillar proteins in golden pomfret muscle during frozen at different temperatures
2.8 金鲳鱼肉的TBARs值变化结果
在冻藏期间鱼肉中不饱和脂肪酸会氧化生成MDA、酮、脂肪酸等,其中MDA与TBA反应生成粉色化合物,因此常用TBARs值判断脂肪氧化程度[30]。由图7可知,不同冻藏温度下金鲳鱼肉的TBARs值在冻藏期间略有波动,但总体呈上升趋势,这说明随着冻藏时间延长金鲳鱼肉发生了脂肪氧化反应。冻藏金鲳鱼肉的TBARs初始值为0.88 mg/kg,在第24周时达到最高值,-20、-40 ℃冻藏的金鲳鱼肉的TBARs值分别为1.56 mg/kg和1.62 mg/kg。不同冻藏温度下金鲳鱼肉的TBARs值无显著差异(P>0.05),表明经过预冻后不同冻藏温度对金鲳鱼肉脂肪氧化反应影响较小。
2.9 金鲳鱼肉组织微观结构变化结果
由图8可知,新鲜金鲳鱼肉肌纤维的横切面和纵切面形状固定、排列有序、间隙最小。经过24 周的冻藏,2 种温度冻藏的金鲳鱼肉肌纤维发生了变形,肌纤维间隙和断裂程度明显变大,但2 组之间无明显差异。金鲳鱼肉的品质和持水力可以通过肌肉组织的微观结构来反映[31],离心损失结果显示,冻藏24 周后金鲳鱼肉的持水力严重下降,但2 组之间无显著差异,这与肌肉组织微观结构结果相符。结果表明,随着冻藏时间延长,金鲳鱼肉肌纤维会发生劣变,导致鱼肉持水力减弱、品质下降,但预冻后经过不同温度冻藏对金鲳鱼肌肉组织微观结构无明显影响。
3 结 论
经-40 ℃预冻后于-20、-40 ℃冻藏,2 组金鲳鱼整鱼的感官、鱼肉持水力无明显差异。蛋白氧化指标以及脂肪氧化指标结果表明,经预冻后不同温度冻藏对肌原纤维蛋白的氧化变性与脂肪的氧化分解无显著影响。冻藏24 周的金鲳鱼肉的肌纤维缝隙和断裂程度增大,但不同贮藏温度鱼肉之间的组织微观结构无明显差异。综上所述,经过-40 ℃预冻处理后,相较于-20 ℃,-40 ℃冻藏不能有效延缓金鲳鱼整鱼的品质劣变。因此从节能角度考虑,经预冻后金鲳鱼整鱼冷冻冻藏温度选择-20 ℃。
