荧光蛋白在双色蜡蘑中的构建与表达
2023-02-03马嘉楠
马嘉楠, 李 蕊, 邹 嵘, 张 凤
(兰州大学 生态创新研究院,甘肃 兰州 730070)
在长期的协同进化过程中,植物为了适应复杂的生态环境,进化出多种形式的植物-微生物共生体系,其中最重要的体系就是植物根系和土壤真菌形成的互利共生的联合体—菌根[1]。根据菌根形态学及解剖学特征,菌根可以分为三种主要类型:内生菌根、外生菌根和内外生菌根[2],目前全世界共有7 750多种外生菌根真菌和200余种丛枝菌根真菌[3]。据文献报道,外生菌根真菌不仅能帮助促进植物生长增加植物生物量,还能提高叶绿素的含量与净光合速率,刺激植物产生次级代谢产物,调节激素平衡,促进植物生长,增强植物抗逆性、适应性与吸收能力,在改善土壤微生物环境方面也具有重要意义,是土壤生态系统中重要的组成部分[4-9]。外生菌根中植物主要为真菌提供碳源,真菌为植物提供主要的氮、磷等营养元素[1]。外生菌根和植物宿主相互作用机制的研究,一方面受限于外生菌根共培养体系的建立,另一方面则受限于外生菌根真菌的遗传转化体系的建立[10]。因此,建立高效的真菌遗传转化体系尤为重要。外生菌根真菌功能的研究需要高效稳定的遗传转化体系,农杆菌介导的遗传转化体系(Agrobacterium tumefaciens-mediated transformation, ATMT)[11]是植物科学中的一种成熟技术,同样也为真菌遗传学开启了一个新时代。在过去的20年里,荧光标记物的使用提供了大量的信息,涵盖了真菌生物学的各个方面,在真菌细胞与植物组织相互作用时的可视化[12]等方面具有重要作用,例如与植物组织相互作用时可视化真菌细胞等[13],揭示了特定真菌蛋白和细胞过程在植物与病原体相互作用中的重要性[14-18]。外生菌根真菌及其共生植物的类群庞杂,其共生过程缺乏共性,给研究带来了难度。双色蜡蘑(Laccariabicolor(Maire P.D.Orton))是担子菌亚门(Basidiomycatina)口蘑科(Tricholomataceae)蜡蘑属(Laccaria)的优良外生菌根真菌[19],存在于植物根际土壤中[20],在森林、成熟苗圃中十分常见[21]。随着双色蜡蘑基因序列的完成,越来越多的研究者开始以双色蜡蘑为模式生物研究外生菌根真菌与植物的作用机制。对于外生菌根与外生菌根真菌的分子机理、调节机制的研究仍有待进一步完善,深入研究该机制有助于理解外生菌根及其在整个自然生态循环中的作用,使得外生菌根真菌能够有目的地转化为生产力并在生态修复中发挥作用。因此,选择外生菌根真菌模式生物双色蜡蘑构建外生菌根真菌携带荧光蛋白转化子具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 菌种来源 本研究所用的pCEBN载体、pHg载体以及LaccariabicolorS238N(Maire P.D.Orton)均由法国农业科学院Francis Martin院士惠赠。
1.1.2 培养基(g/L) ①MMN固体培养基(Melin Norkrans medium,MMN):Thiamine 0.05,CaCl20.05,NaCl 0.025,KH2PO40.5,MgSO4·7H2O 0.15,(NH4)2HPO40.25,FeSO4·7H2O 0.001,葡萄糖 10,麦芽糖提取物 3,酵母提取物 0.5,pH 5.8,用于固体平板培养时,加入琼脂15;②P5培养基(筛选培养基):酒石酸铵0.5,Thiamine 0.05,KH2PO41,MgSO4·7H2O 0.5,葡萄糖 20,麦芽糖 5,pH 5.8,用于固体平板培养时,加入琼脂15;③共培养培养基(农杆菌侵染真菌培养基):Thiamine 0.05,CaCl20.05,NaCl 0.025,KH2PO40.5,MgSO4·7H2O 0.15,(NH4)2HPO40.25,葡萄糖 2,麦芽提取物 3,酵母提取物 0.5,MES 40 mmol/L,甘油 5,pH 5.3,用于固体平板培养时,加入琼脂15。
1.1.3 主要试剂与仪器设备 限制性内切酶购自美国Thermo Fisher公司;连接酶购自TaKaRa公司;质粒提取试剂盒购自南京Vazyme公司;试剂购自上海生工公司;本实验所用引物见表1。高压灭菌锅(GI80TW作ZEALWAY);摇床(MQD-S2NR,旻泉);PCR仪(Bio Rad T100,伯乐);核酸电泳仪(DYCP-31DN,北京六一);生化培养箱(LRH-250,上海一恒科学仪器);激光共聚焦显微镜(FV3000,Olympus)。
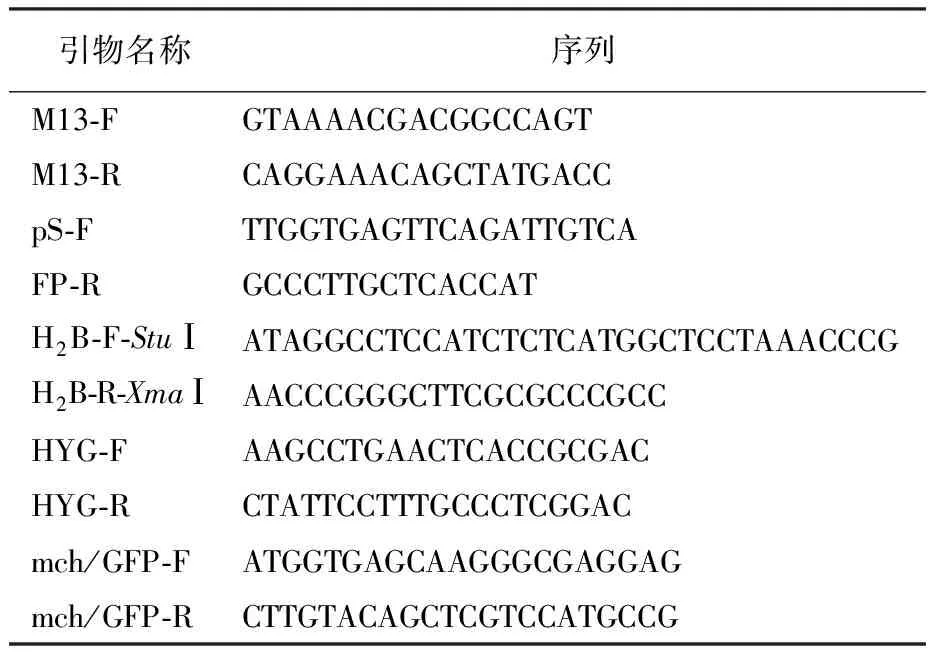
表1 实验引物
1.2 方法
1.2.1 载体构建 以野生型双色蜡蘑gDNA为模板,选择Kemppainen研究中的pCEBN∷mCherry载体,mCherry为双色蜡蘑的标记蛋白[22]构建过表达质粒。使用引物:H2B-F-StuⅠ+H2B-R-XmaⅠ (表1)扩增目的基因条带连接T载体后测序,测序正确的质粒以StuⅠ和XmaⅠ为酶切位点,定向克隆连接到pCEBN∷mCherry载体上;然后使用SacⅠ酶切连接穿梭载体pHg,图1为pHg-pCEBN∷mCharry-H2B的质粒构建图。验证正确的质粒转化农杆菌菌株AGL-1,挑取固体培养基平板上的农杆菌单克隆,液体摇菌培养,并再次用载体引物mch/GFP-F+R与潮霉素抗性引物(表1)菌检,选取验证正确的农杆菌菌液侵染真菌。

图1 pHg-pCEBN∷mCherry-H2B质粒构建图Fig.1 pHg-pCEBN∷mCherry H2B-plasmid construction diagram
1.2.2 侵染真菌 使用冻融法转化农杆菌,使用农杆菌株系AGL-1;使用Kemppainen等[23]研究的根瘤农杆菌介导转化法转化真菌:选用真菌培养广泛使用的MMN培养基培养7 d的野生型L.bicolor作为侵染材料,侵染液浓度至OD600=0.4~0.6,加入200 μmol/L的乙酰丁香酮(AS);将侵染液滴加到真菌上,使真菌与农杆菌置于共培养培养基上,共培养培养基中同样含有利于转化的乙酰丁香酮(AS),正置暗培养4 d,24 ℃。
1.2.3 筛选转化子 使用营养丰富的P5培养基加抗生素筛选,经过第1轮、第2轮筛选培养基(P5培养基含头孢霉素500 μg/mL和潮霉素300 μg/mL)与第3轮筛选培养基(P5培养基含潮霉素150 μg/mL)筛选后选出15个真菌转化子。
1.2.4 检验转化子 外生菌根真菌双色蜡蘑基因组提取参考十六烷基三甲基溴化铵法(CTAB)提取真菌基因组[24]。
1.2.5 真菌生长表型 将MMN培养基生长7 d的双色蜡蘑pHg-pCEBN∷mCherry-H2B与野生型菌丝进行对比,观察生长速度、菌丝形态与边缘菌丝生长状况等。
1.2.6 双色蜡蘑菌丝染色观察 在培养基上取生长周期7 d的菌圈边缘新鲜的双色蜡蘑菌丝,用多聚甲醛固定样品4 h后,使用PBS溶液清洗3遍;将固定好的菌丝切片用10 μg/mL的小麦凝集素(WGA染料)染色30 min;染色标本在激光共聚焦显微镜下进行形态学观察。
1.2.7 数据处理 使用Image J测量菌落直径,使用Origin 2018、PhotoshopCS6 2020作图。
2 结果与分析
2.1 构建pHg-pCEBN∷mCherry-H2B质粒
2.1.1 目的基因扩增 选择核小体核心组蛋白H2B家族作为目的基因检测荧光蛋白在双色蜡蘑中的表达,H2B存在许多亚型,在这5个Laccaria组蛋白H2B基因模型中,作为功能作用的基因HTB16201和HTB162022是典型的复制依赖的组蛋白亚型,选择其中的HTB16202作为双色蜡蘑中荧光蛋白定位表达的检测基因[22]。与天然组蛋白类似,组蛋白-荧光蛋白的融合被证明也能进入核小体[25],因此,荧光蛋白在细胞的所有有丝分裂阶段都定位于细胞核。以外生菌根双色蜡蘑gDNA为模板,H2B-F和H2B-R为引物扩增得到两端分别带有StuⅠ和XmaⅠ限制性酶切位点的H2B基因(图2A),连接T载体后送生工生物工程(上海)股份有限公司测序,通过与序列比对,结果显示,序列匹配度为100%。将H2B的片段克隆到中间载体pCEBN,构建pHg-pCEBN∷mCherry-H2B后,转化到农杆菌AGL1中进行后续真菌转化实验(图2B、C)。

图2 目的基因扩增Fig.2 Target gene amplificationA:LbH2B目的基因扩增;B:pHg-pCEBN∷mCherry-H2B构建质粒的PCR扩增;C:pHg-pCEBN∷mCherry-H2B农杆菌的PCR扩增;M:2 000 bp DNA Marker;1:H2B基因全长441 bp;2、3:pHg-pCEBN∷mCherry-H2B构建质粒;4、5:阴性对照野生型gDNA;6、7:pHg-pCEBN∷mCherry-H2B农杆菌;8、9:阴性对照空白AGL-1菌液;2、4、6、8使用引物为mch/GFP-F+R;3、5、7、9使用潮霉素抗性引物A:LbH2B target gene amplification; B:PCR amplification of pHg-pCEBN∷mCherry-H2B plasmid; C:PCR amplification of pHg-pCEBN∷mCherry-H2B Agrobacterium; M:2 000 bp DNA Marker; 1: H2B gene full length, about 441 bp; 2, 3: pHg-pCEBN∷mCherry-H2B plasmid; 4, 5: Wild-type gDNA negative control; 6, 7: pHg-pCEBN∷mCherry-H2B Agrobacterium; 8, 9:Negative control blank AGL-1 bacterial liquid; 2, 4, 6, 8 using the primer mch/GFP-F+R; 3, 5, 7, 9 using the hygromycin B primer
2.2 菌根真菌的转化
利用农杆菌介导的方法,对真菌的菌丝进行了转化。首先利用抗生素进行筛选,两轮筛选后随机挑选15个真菌转化子使用CTAB法提取DNA,潮霉素抗性引物进行PCR验证。
结果发现15个随机挑选的真菌转化子中,有14个真菌转化子的基因组DNA扩增出大小750 bp左右与潮霉素抗性基因片段长度相同,而野生型(NC)的基因组却没有相应的条带(图3)。于是计算出该方法进行农杆菌侵染的转化效率高达93.33%。14个阳性转化子中,3号转化子与15号条带较浅,1号、5号、6号、7号、12号和14号条带较亮,推测15号转化子中H2B表达较弱,1号、5号、6号、7号、12号和14号转化子中H2B基因表达较强。因此选择真菌转化LbH2B-1、6、7、12进行后续的研究。

图3 LbH2B转化子潮霉素抗性基因鉴定Fig.3 Identification of Hygromycin resistance gene in pHg-pCEBN∷mCherry-H2B transformantsM:2 000 bp DNA Marker;NP:野生型双色蜡蘑 gDNA,阴性对照;PC:阳性质粒pHg-pCEBN∷mCherry;1~15:转化子M:2 000 bp DNA Marker; NP:WT gDNA, negative control; PC:Positive plasmid pHg-pCEBN∷mCherry; 1-15:Transformants
2.3 真菌生长表型
在MMN培养基上培养7 d的双色蜡蘑野生型(图4A)与LbH2B∷mCherry(LbH2B)真菌转化子(图4B~4E)的生长情况没有区别:野生型菌落的平均直径为702 mm,LbH2B-1转化子真菌菌落的平均直径为726 mm,LbH2B-6真菌菌落的平均直径为715 mm,LbH2B-7真菌菌落的平均直径693 mm,LbH2B-12真菌菌落的平均直径为696 mm。而且野生型与转化子间生长速度相近,真菌生长形态没有区别。实验表明双色蜡蘑转化子LbH2B和红色荧光蛋白融合表达后不会影响真菌的生长状态。

图4 双色蜡蘑菌落形态Fig.4 Colony morphological diagram of L. bicolorA:双色蜡蘑野生型;B:pHg-pCEBN∷mCherry-H2B-1转化子;C:pHg-pCEBN∷mCherry-H2B-6转化子;D:pHg-pCEBN∷mCherry-H2B-7转化子;E:pHg-pCEBN∷mCherry-H2B-12 转化子A:WT;B:pHg-pCEBN∷mCherry-H2B-1 strain;C:pHg-pCEBN∷mCherry-H2B-6 strain;D:pHg-pCEBN∷mCherry-H2B-7 strain;E:pHg-pCEBN∷mCherry-H2B-12 strain
2.4 阳性真菌转化子的红色荧光蛋白信号观察
为了检测融合荧光蛋白的表达情况,利用共聚焦激光显微镜对真菌菌丝进行观测,结果发现,这四个阳性的真菌转化子的细胞核中均有红色荧光信号(图5),而野生型却没有荧光信号。结果表明,本研究成功将核小体H2B蛋白和红色荧光蛋白融合后,转入外生菌根真菌双色蜡蘑中,并稳定表达,证明了融合荧光蛋白在真菌分子机制可视化研究中的可行性。

图5 双色蜡蘑菌丝共聚焦显微镜图Fig.5 Laser scanning confocal microscopy image of L.bicolor hyphae图中绿色为真菌菌丝,红色为荧光蛋白;GFP:488 nm波长荧光;mCherry:561 nm波长荧光;BF:明场;OVERLAP:叠加场green:Fungal hyphae, red:Fluorescent protein; GFP:Fluorescence at 488 nm wavelength, mCherry: Fluorescence at 561 nm wavelength, BF: Bright field, OVERLAP: Overlay field
3 讨 论
外生菌根真菌分子机制的研究建立在高效的外生菌根真菌的遗传转化体系基础上[10],本研究建立了阳性率达到90%以上高效的遗传转化体系,得到了核小体蛋白和红色荧光蛋白融合表达的转化子真菌。在真菌中,荧光蛋白除了在细胞质中表达外,还成功地靶向了不同的细胞器,例如细胞核、质膜、过氧化物酶体、线粒体、ER内腔和高尔基体[26-28],本研究选择双色蜡蘑核小体核心组蛋白H2B和红色荧光蛋白融合表达,成功将荧光蛋白定位到细胞核中。在Kemppainen等[22]研究中也证实,红色荧光蛋白的性能优于绿色荧光蛋白,可以产生更持久的荧光信号,并且红色荧光的检测波长范围内菌丝自发荧光现象最微弱。本研究中选择小麦胚凝集素(WGA)对菌丝染色,小麦凝集素可特异性识别与结合真菌细胞壁中的几丁质[29],该染料带有Alexe flour 488的显色基团,很容易在共聚焦显微镜下观察到绿色的真菌菌丝,更好地观察真菌菌丝的分布。组蛋白-荧光蛋白融合物与天然蛋白相似[30],可通过细胞中的所有有丝分裂期定位于细胞核中更方便可视化,在植物[31-32]和动物中已成功地表达了典型的组蛋白H2B-荧光蛋白融合体[33-36],本研究成功地以H2B作为目的基因,很好地观察融合荧光蛋白的亚细胞定位,为后续研究基因的亚细胞定位提供了很好的实验平台。
根瘤农杆菌是一类普遍存在的革兰阴性细菌,通过将克隆载体将目的片段插入到自身Ti质粒的T-DNA区,最终将T-DNA片段整合到寄主的基因组中[37],使用的农杆菌株系为AGL-1,研究表明外生菌根真菌常用的农杆菌菌株有AGL-1和LBA4404,在双色蜡蘑中AGL-1的转化效率比LBA4404高出4倍[11];由于较高的转化效率,AGL-1在真菌遗传转化中使用较多,Kemppainen等[22]在研究中也使用AGL-1农杆菌,但并未表明转化效率。本研究转化效率为93.33%,与其他双色蜡蘑遗传转化效率相比较高[38],并突出了荧光蛋白的表达检测。影响ATMT转化效率的因素有很多,包括农杆菌菌株株系、受体材料、目的载体构建、诱导剂浓度、农杆菌菌液浓度等[10]。农杆菌生长状态需要处于对数期,即活力最强时期;为提高转化效率需在重悬液中加入乙酰丁香酮作为诱导剂,Satish等[39]在沙漠松露(Terfeziaboudieri)转化中发现如果不添加乙酰丁香酮转化率几乎为零,且最适宜浓度为200 μmol/L。受体材料前期培养中,本研究使用MMN培养基区别于Kemppainen在培养真菌时使用的P5培养基,DNA筛选结果发现,此方法对外生菌根真菌的侵染,阳性率较高,能筛选到阳性转化子高达90%以上,得到了更好的转化效率。
综上所述,本研究利用农杆菌介导的方法侵染真菌,获得了极高的转化效率;筛选获得核小体和荧光蛋白融合表达菌根真菌菌株LbH2B,真菌转化子并不影响菌丝的生长状态;利用激光共聚焦显微镜清晰地观察到菌丝细胞核中的红色荧光。本研究成功地建立了融合表达荧光蛋白的菌根真菌转化体系,为后续研究其他基因在菌根真菌中的功能提供了技术平台。在以后的研究中,可将本研究建立的荧光蛋白融合体系用于后续的基因亚细胞定位分析,特别是真菌启动子的时空表达分析,为揭示菌根形成中的信号分子交流机制提供参考。
