乙脑/寨卡嵌合病毒包膜蛋白V343A及I341V/V343A联合突变对小鼠脑内神经毒力的影响
2023-02-03李玥珂冯亚岚
陈 岚, 李玥珂, 任 阳, 黄 荣, 冯亚岚, 袁 磊, 杨 健
(川北医学院 基础医学与法医学院, 四川 南充 637000)
寨卡病毒(Zika Virus, ZIKV)属黄病毒科黄病毒属,单正链RNA病毒,基因组全长约11.0 kb,两侧是5′和3′非编码区,中间包含一个开放阅读框(Open Reading Frame, ORF),编码一个多聚蛋白,该蛋白在翻译后被水解加工成三种结构蛋白(衣壳蛋白C、前膜蛋白prM和包膜蛋白E)和七种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)[1]。与其他黄病毒一样,结构蛋白参与病毒组装、黏附和侵入细胞[2],其中E蛋白是介导黄病毒感染入侵的重要蛋白,也是诱导中和抗体产生的主要抗原[3]。ZIKV于1947年首次在乌干达寨卡森林恒河猴血清中分离获得[4],自发现后约半个世纪一直零星感染,近几年开始在全球爆发流行引起人们注意。研究证实ZIKV感染是先天性寨卡综合症(Congenital Zika syndrome,CZS)和成人格林-巴利综合症(Guillain-Barre syndrome, GBS)的病因[5-6]。针对ZIKV感染,目前仍无批准上市的疫苗,有效疫苗的研发迫在眉睫。ZIKV分为非洲型和亚洲型两个谱系,近年来亚洲型在世界上引起广泛流行[7]。毒株MR766与PRVABC59分别为非洲型和亚洲型的代表[8]。非洲株MR766为1947年在乌干达分离出的毒株[4],而亚洲株PRVABC59为2015年在波多黎各分离出的毒株。研究证实,非洲株比引起广泛流行的亚洲株具有更强的神经毒力[9-10]。有研究指出,亚洲株与非洲株的毒力差异主要由结构蛋白的差异引起[11]。川北医学院基础医学与法医学院虫媒病毒研究课题组(本课题组)前期以乙脑疫苗株SA14-14-2为骨架,将其结构蛋白prM/E替换为寨卡病毒的相应片段,分别构建了嵌合病毒JE/ZIKV(MR766)[12]和JE/ZIKV(PRVABC59)[13]。嵌合病毒JE/ZIKV(MR766)与JE/ZIKV(PRVABC59)对小鼠的脑内神经毒力LD50分别为22.12 pfu/0.03 mL和>1.0×105pfu/0.03 mL,差异极显著。通过序列对比分析,发现二者在E蛋白上有多个氨基酸差异,其中包括E341和E343。E蛋白是黄病毒的主要表面蛋白,在病毒吸附、融合、侵入以及细胞嗜性方面起重要作用[14],结合序列分析,预测主要是E蛋白上的氨基酸差异导致了两嵌合病毒的毒力差异。本研究分别构建突变病毒JE/ZIKV(V343A)和JE/ZIKV(I341V/V343A),并比较突变病毒与亲本株的神经毒力差异,探索E蛋白341和343位氨基酸突变对嵌合病毒神经毒力的影响,为进一步研究嵌合病毒减毒机制提供重要依据,也为嵌合病毒疫苗的研发提供支持。
1 材料与方法
1.1 材料
1.1.1 质粒、病毒、细胞及实验动物 质粒pA-JEV-3′(含乙脑疫苗株SA14-14-2基因nt 3 445~10 970),质粒pA-JEV-5′(含乙脑疫苗株SA14-14-2基因nt 1~3 450),质粒pA-JE/ZIKV(MR766)-5′(含JE/ZIKV(MR766)基因nt 1~3 450)均为代谢病药物与生物制品南充市重点实验室构建保存;JE/ZIKV(MR766)嵌合病毒、乙脑疫苗株SA14-14-2、BHK21细胞由代谢病药物与生物制品南充市重点实验室提供;清洁级昆明鼠由川北医学院实验动物中心提供。
1.1.2 主要试剂与仪器设备 高保真Taq酶、连接酶购自宝生物工程(大连)有限公司;胶回收试剂盒、质粒提取试剂盒、PCR产物纯化试剂盒均购自OMEGA公司;内切酶购自NEB公司;体外转录试剂盒购自Promega公司;RNA回收试剂盒、质粒大量抽提试剂盒均购自QIAGEN公司;抗JEV-E蛋白抗体购自Abcam公司,抗JEV-NS1蛋白抗体、抗ZIKV-E蛋白抗体购自GeneTex公司,Alexa Fluor488标记抗IgG抗体购自上海碧云天生物公司;引物根据GenBank公布的ZIKV序列(序列号:AY632535.20)设计,具体序列及用途见表1;引物合成及病毒测序均由上海生工生物工程股份有限公司完成。PCR仪(Mastercycler®nexus,Eppendrof);电泳仪(PowerPacTMUniversal Power Supply,BIO-RAD);电转仪(Gene Pulser XcellTM,BIO-RAD);倒置荧光显微镜(DMI4000B,Leica)。

表1 PCR及测序引物
1.2 方法
1.2.1 点突变片段获取 利用重叠延伸PCR[15-16]以pA-JE/ZIKV(MR766)-5′质粒为模板扩增含突变片段prM/E。prM/E(V343A)片段扩增所用两对引物分别为F2/V343A R和V343A F/R3,prM/E(I341V/V343A)扩增所用引物为F2/(I341V/V343A R)和(I341V/V343A F)/R3。
1.2.2 突变病毒全长cDNA质粒构建 利用质粒pA-JEV-5′和pA-JEV-3′构建全长cDNA质粒[15-16]。首先用片段prM/E(V343A)和prM/E(I341V/V343A)分别替换pA-JEV-5′上相应片段,获得pA-JE/ZIKV(V343A)-5′和pA-JE/ZIKV(I341V/V343A)-5′,然后再将5′端质粒和pA-JEV-3′质粒相连接得到pA-JE/ZIKV(V343A)和pA-JE/ZIKV(I341V/V343A)全长质粒。
1.2.3 突变病毒拯救及传代 用XhoⅠ线性化全长质粒后体外转录获取病毒RNA。将RNA电转染入BHK21细胞中,细胞贴壁后更换为含2%(体积分数,下同)血清的培养液,细胞死亡约40%时,冻融收毒,2 000 r/min离心10 min后,将上清分装-80 ℃保存,为P1代病毒。在T25培养瓶中接种BHK21细胞,待融合度达80%时,按M.O.I.=0.01接种病毒,37 ℃, 5% CO2吸附1 h,期间每隔20 min混匀1次,1 h后更换为2%维持液,细胞出现40%死亡时收毒,即为P2代病毒,以同样方法传至病毒滴度满足实验要求为止。
1.2.4 病毒测序 提取病毒RNA逆转录为cDNA,使用测序引物扩增后,胶回收目的片段送检测序。
1.2.5 免疫荧光 将BHK21细胞接种于96孔板,24 h后,以M.O.I.=0.01将SA-14-14-2、JE/ZIKV(V343A)、JE/ZIKV(I341V/V343A)分别接种于96孔板,同时设置不接种病毒液的空白对照孔。48 h后弃原培养液,1×PBS洗涤后,4%多聚甲醛固定30 min,0.5% TritonX-100透膜10 min,在对应孔加入抗JEV-E抗体(1∶20稀释)、抗JEV-NS1抗体(1∶1 000稀释)、抗ZIKV-E抗体(1∶500稀释)各30 μL,37 ℃孵育1 h后,1×PBS充分洗涤,加入Alexa Fluor488标记二抗(1∶500稀释,50 μL/孔),37 ℃孵育1 h,1×PBS充分洗涤,DAPI染色3 min,1×PBS洗涤,荧光显微镜观察结果。
1.2.6 蚀斑实验 将BHK21细胞接至6孔板中,融合度达70%时,按10的倍数梯度稀释病毒,每孔加入400 μL稀释后的病毒液,37 ℃吸附1 h后,更换为含1%低熔点琼脂糖,2%血清的覆盖物,37 ℃ 5% CO2培养4~5 d后,4%甲醛固定,10 g/L的结晶紫染色,计数空斑数以推算病毒滴度,并测定蚀斑直径,观察蚀斑特点。
1.2.7 生长曲线 接种BHK21细胞至培养皿,融合度达80%时,以M.O.I.=0.01,分别用JE/ZIKV(MR766)、JE/ZIKV(V343A)、JE/ZIKV(I341V/V343A)感染细胞,每隔12 h收集上清直到细胞全部死亡。将收集的上清做蚀斑实验,测定病毒滴度并绘制病毒生长曲线,对比突变病毒与亲本株增殖特性差异。
1.2.8 突变病毒神经毒力测定 将JE/ZIKV(MR766)、JE/ZIKV(V343A)、JE/ZIKV(I341V/V343A)以10为梯度作倍比稀释,以0.03 mL/只的剂量颅内接种3周龄昆明鼠,连续观察14 d,记录各组动物死亡情况并计算LD50,对比突变病毒与亲本株神经毒力差异。
1.2.9 统计学方法 使用spss23.0处理数据,得到各毒株蚀斑直径平均值 标准差(SD)。使用t检验,分析两突变病毒蚀斑直径与亲本株差异,当P<0.05时,差异具有统计学意义。
2 结果与分析
2.1 点突变片段获取
以pA-JE/ZIKV(MR766)-5′为模板,引物F2/V343A R扩增得到大小约1.5 kb片段1,V343A F/R3扩增得到大小约0.7 kb片段2,重叠延伸后用引物F2/R3扩增得到大小约2.2 kb产物prM/E(V343A),与理论相符(图1A)。prM/E(I341V/V343A)扩增过程中各产物大小与prM/E(V343A)相近(图2A)。

图1 pA-JE/ZIKV(V343A)全长质粒构建及鉴定Fig.1 Construction and identification of pA-JE/ZIKV(V343A) full-length plasmidA:含V343A突变PCR扩增产物;B:pA-JE/ZIKV(V343A)-5′酶切鉴定;C:pA-JE/ZIKV(V343A)全长酶切鉴定。M1:DNA分子量标(DL2 000);M2:DNA分子量标(DL15 000);1:含V343A突变片段2;2:含V343A突变片段1;3:含V343A突变prM/E片段;4:pA-JE/ZIKV(V343A)-5′;5:pA-JE/ZIKV(V343A)-5′KasⅠ+BglⅡ;6:pA-JE/ZIKV(V343A)-5′/BglⅡ+BspEⅠ;7:pA-JE/ZIKV(V343A)-5′/XhoⅠ;8:pA-JE/ZIKV(V343A);9:pA-JE/ZIKV(V343A)/BglⅡ;10:pA-JE/ZIKV(V343A)/XhoⅠ+BspEⅠ;11:pA-JE/ZIKV(V343A)/AscⅠ+XhoⅠA: PCR amplification product containing V343A mutation; B: Restriction endonuclease analysis of pA-JE/ZIKV(V343A)-5′; C: Restriction endonuclease analysis of pA-JE/ZIKV(V343A). M1: DNA marker(DL2 000); M2: DNA marker(DL15 000); 1: Fragment 2 containing V343A mutation; 2: Fragment 1 containing V343A mutation; 3: Fragment prM/E containing V343A mutation; 4: pA-JE/ZIKV(V343A)-5′; 5: pA-JE/ZIKV(V343A)-5′/KasⅠ+BglⅡ; 6: pA-JE/ZIKV(V343A)-5′/BglⅡ+BspEⅠ;7: pA-JE/ZIKV(V343A)-5′/XhoⅠ; 8: pA-JE/ZIKV(V343A); 9: pA-JE/ZIKV(V343A)/BglⅡ; 10: pA-JE/ZIKV(V343A)/XhoⅠ+ BspEⅠ;11: pA-JE/ZIKV(V343A)/AscⅠ+Xho Ⅰ
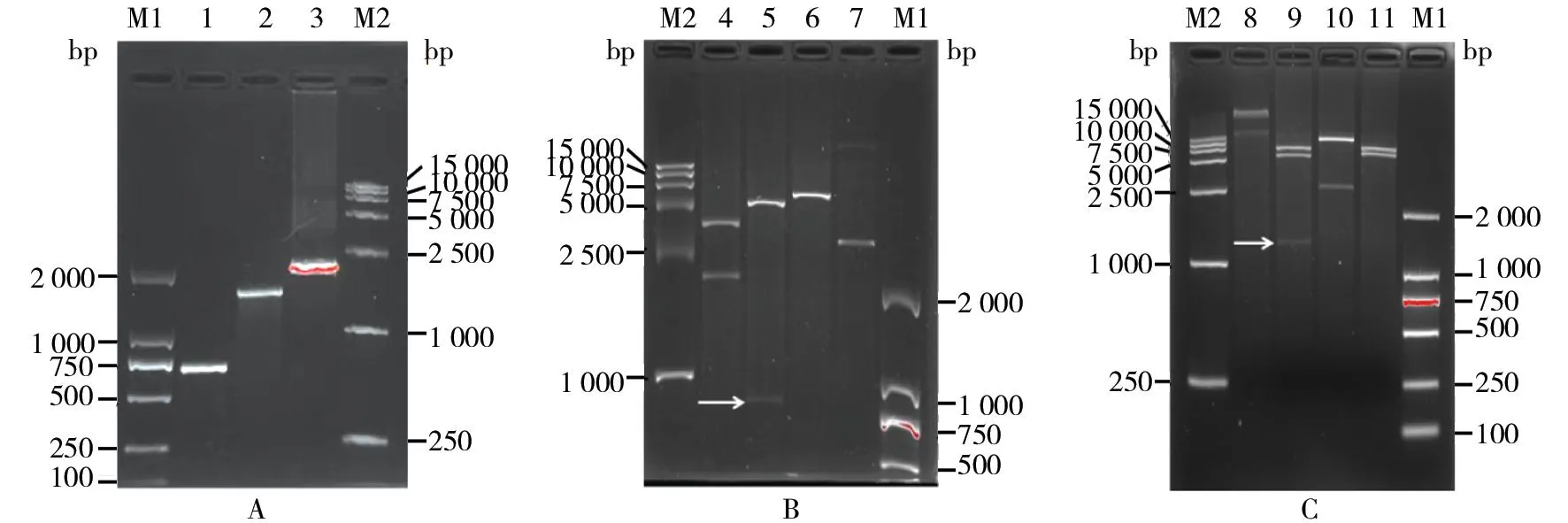
图2 pA-JE/ZIKV(I341V/V343A)全长质粒构建及鉴定Fig.2 Construction and identification of pA-JE/ZIKV(I341V/V343A) full-length plasmidA:含I341V/V343A突变PCR扩增产物;B:pA-JE/ZIKV(I341V/V343A)-5′酶切鉴定;C:pA-JE/ZIKV(I341V/V343A)全长酶切鉴定;M1:DNA分子量标(DL2 000);M2:DNA分子量标(DL15 000);1:含I341V/V343A突变片段2;2:含I341V/V343A突变片段1;3:含I341V/V343A突变prM/E片段;4:pA-JE/ZIKV(I341V/V343A)-5′/Kas Ⅰ+Bgl Ⅱ;5:pA-JE/ZIKV(I341V/V343A)-5′/BglⅡ+BspEⅠ;6:pA-JE/ZIKV(I341V/V343A)-5′/XhoⅠ;7:pA-JE/ZIKV(I341V/V343A)-5′;8:pA-JE/ZIKV(I341V/V343A);9:pA-JE/ZIKV(I341V/V343A)/BglⅡ;10:pA-JE/ZIKV(I341V/V343A)/Asc Ⅰ+XhoⅠ;11:pA-JE/ZIKV(I341V/V343A)/XhoⅠ+BspEⅠA: PCR amplification product containing I341V/V343A mutation; B: Restriction endonuclease analysis of pA-JE/ZIKV(I341V/V343A)-5′; C: Restriction endonuclease analysis of pA-JE/ZIKV(I341V/V343A). M1: DNA marker(DL2 000); M2: DNA marker(DL15 000); 1: Fragment 2 containing I341V/V343A mutation; 2: Fragment 1 containing I341V/V343A mutation; 3: Fragment prM/E containing I341V/V343A mutation; 4: pA-JE/ZIKV(I341V/V343A)-5′/KasⅠ+BglⅡ; 5: pA-JE/ZIKV(I341V/V343A)-5′/Bgl Ⅱ+BspEⅠ; 6: pA-JE/ZIKV(I341V/V343A)-5′/XhoⅠ; 7: pA-JE/ZIKV(I341V/V343A)-5′; 8: pA-JE/ZIKV(I341V/V343A); 9: pA-JE/ZIKV(I341V/V343A)/Bgl Ⅱ; 10: pA-JE/ZIKV(I341V/V343A)/AscⅠ+XhoⅠ; 11: pA-JE/ZIKV(I341V/V343A)/XhoⅠ+BspEⅠ
2.2 pA-JE/ZIKV(V343A)-5′及pA-JE/ZIKV(I341V/V343A)-5′质粒酶切鉴定
将得到的pA-JE/ZIKV(V343A)-5′端质粒分别用KasⅠ+BglⅡ、BglⅡ+BspEⅠ、XhoⅠ酶切,其中经KasⅠ+BglⅡ双酶切得到约2.2 kb和3.6 kb的片段,经BglⅡ+BspE Ⅰ双酶切得到约0.8 kb和5.0 kb的片段,XhoⅠ单酶切得到线性化片段约5.8 kb,大小与理论相符(图1B)。pA-JE/ZIKV(I341V/V343A)-5′端酶切鉴定方式同pA-JE/ZIKV(V343A)-5′,结果均与理论相符(图2B)。表明pA-JE/ZIKV(V343A)-5′及pA-JE/ZIKV(I341V/V343A)-5′质粒构建成功。
2.3 pA-JE/ZIKV(V343A)及pA-JE/ZIKV(I341V/V343A)全长质粒酶切鉴定
将得到的pA-JE/ZIKV(V343A)全长质粒用XhoⅠ+BspEⅠ、AscⅠ+XhoⅠ、BglⅡ酶切,其中经XhoⅠ+BspEⅠ酶切得到大小约6.0 kb和7.5 kb片段,AscⅠ+XhoⅠ双酶切得到约11.0 kb和2.5 kb片段,BglⅡ单酶切得到大小约为7.0、5.2、1.3 kb共3条片段,大小与理论相符(图1C)。pA-JE/ZIKV(I341V/V343A)全长质粒鉴定同pA-JE/ZIKV(V343A),酶切片段大小均与理论相符(图2C)。表明pA-JE/ZIKV(V343A)及pA-JE/ZIKV(I341V/V343A)全长质粒构建成功。
2.4 病毒测序
将测序结果与GenBank发表的ZIKV(MR766)序列(序列号:AY632535.20)和乙脑病毒疫苗株SA14-14-2序列(序列号:AF315119.1)相比对,显示突变构建成功,除构建的突变点以外无其他突变(图3)。

图3 JE/ZIKV(V343A)及JE/ZIKV(I341V/V343A)测序Fig.3 Sequencing of JE/ZIKV(V343A) and JE/ZIKV(I341V/V343A)
2.5 免疫荧光
免疫荧光实验显示,以乙脑疫苗株SA14-14-2为骨架的嵌合病毒能够被抗JEV-NS1抗体和抗ZIKV-E抗体识别,不能被抗JEV-E抗体识别,而对照组JEV SA14-14-2能够被抗JEV-NS1抗体和抗JEV-E抗体识别,不能被抗ZIKV-E抗体识别(图4)。表明病毒能够表达JEV-NS1蛋白和ZIKV-E蛋白,嵌合病毒拯救成功。
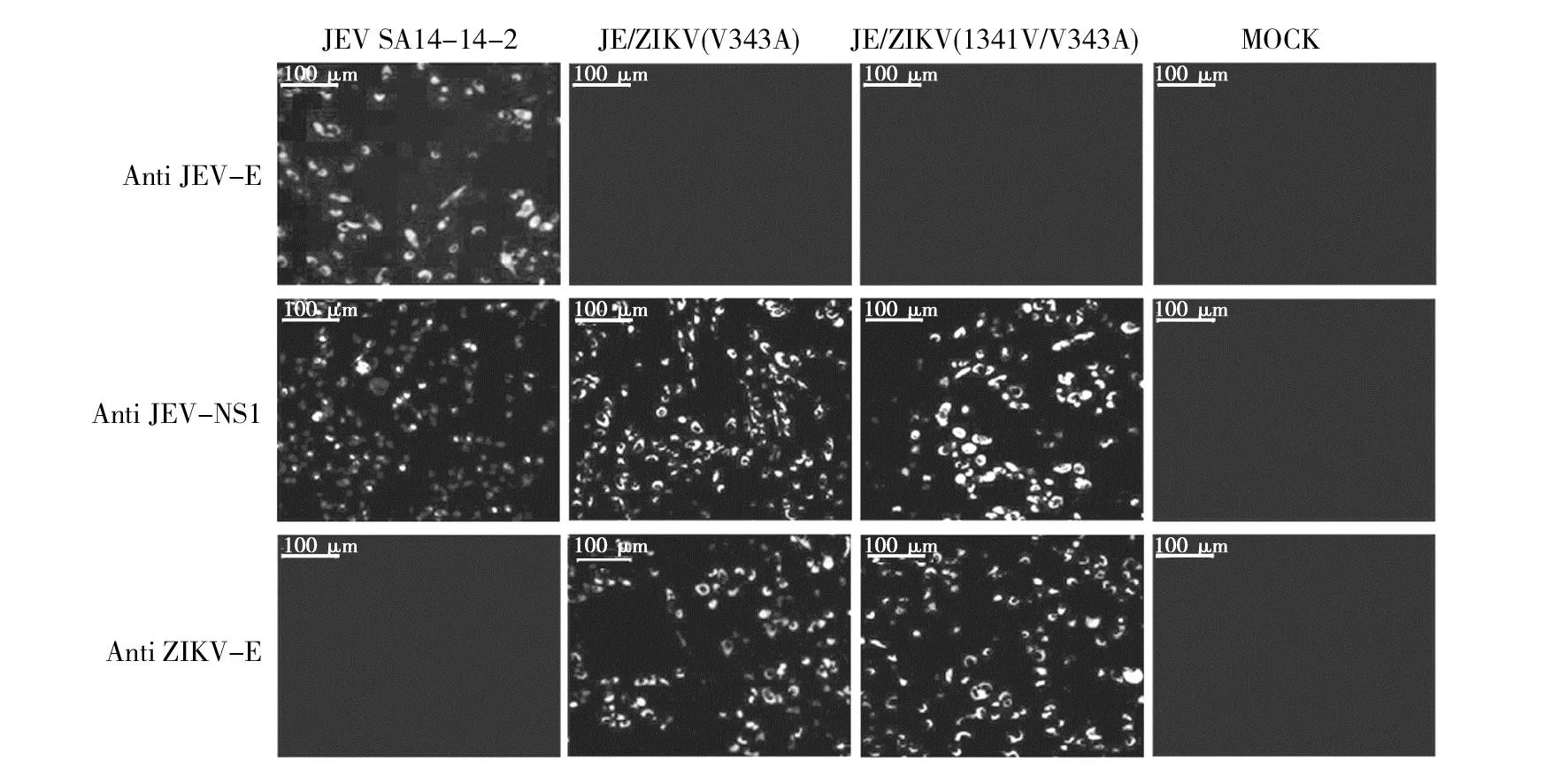
图4 间接免疫荧光鉴定Fig.4 Identification of E protein under fluorescence microscopy
2.6 蚀斑实验
JE/ZIKV(V343A)、JE/ZIKV(I341V/V343A)蚀斑直径分别为(1.09± 0.15) mm和(1.15± 0.29) mm,小于JE/ZIKV(MR766)(2.09± 0.36) mm,差异具有统计学意义(P值均小于0.001),而JE/ZIKV(V343A)与JE/ZIKV(I341V/V343A)间蚀斑直径大小无差异(P>0.05),见图5。表明V343A突变及I341V/V343A联合突变后嵌合病毒蚀斑减小。

图5 病毒蚀斑比较Fig.5 Comparison of virus plaques
2.7 生长曲线
生长曲线显示,JE/ZIKV(I341V/V343A)滴度于60 h达到高峰(6.853 Log10pfu/mL),JE/ZIKV(V343A)稍慢,于72 h达峰值(5.889 Log10pfu/mL),随后滴度开始缓慢下降,而JE/ZIKV(MR766)在96 h仍未达到峰值。整个过程中JE/ZIKV(MR766)的滴度均低于两突变病毒,JE/ZIKV(V343A)滴度低于JE/ZIKV(I341V/V343A)(图6)。表明V343A突变及I341V/V343A联合突变后嵌合病毒增殖增快。

图6 病毒生长曲线Fig.6 Growth curve of the viruses
2.8 突变病毒小鼠脑内神经毒力测定
感染亲本株与突变病毒小鼠均出现精神萎靡、僵直、后肢瘫痪等神经病变症状,小鼠生存情况见图7。用Reed-Muench法计算得JE/ZIKV(MR766) LD50为2.21 pfu/0.03 mL,JE/ZIKV(V343A) LD50为5.62 pfu/0.03 mL,JE/ZIKV(I341V/V343A) LD50为34.84 pfu/0.03 mL(表2)。表2表明,V343A突变及I341V/V343A联合突变后嵌合病毒毒力减弱。

图7 嵌合病毒感染后小鼠生存曲线Fig.7 Survival curve of mice infected with chimeric viruses

表2 突变病毒小鼠脑内神经毒力
3 讨 论
嵌合病毒疫苗是减毒疫苗的一种类型。由于黄病毒具有相同的基因结构,使得利用已有减毒疫苗株为骨架来构建嵌合病毒疫苗成为可能。嵌合病毒疫苗既有疫苗株的减毒复制机制,同时也表达目标病毒的主要结构抗原。利用不同骨架构建的ZIKV嵌合病毒已有较多报道,例如以YFV-17D为骨架构建的寨卡病毒嵌合株Chimeri Vax-Zika (CYZ)、YF-ZIKprM/E、CH-17-D/ZIKV[17-19]等,以DENV-2为骨架构建的嵌合病毒疫苗候选株DENV-2/ZIKV[20]。Li等[21]利用SA14-14-2为骨架构建的嵌合病毒chin-ZIKV在多种动物模型中表现出减毒及较好的免疫保护作用,表明了嵌合病毒疫苗是一种安全且有效的ZIKV病毒疫苗研发方式。
E蛋白参与病毒黏附、侵入细胞和诱导宿主中和抗体产生等[14],是黄病毒的重要疫苗研发靶点之一。E蛋白分为三个结构域:结构Ⅰ(EDⅠ)、结构域Ⅱ(EDⅡ)、结构域Ⅲ(EDⅢ)。EDⅢ在病毒识别细胞受体和介导膜融合中发挥重要作用,该区域中的氨基酸突变会影响病毒的毒力和细胞嗜性[22]。相对于非嗜神经性黄病毒,ZIKV和其他嗜神经性黄病毒EDⅢ中的CD环结构中多出一位氨基酸,从而使得CD环进一步扩大,这个结构已被证实可以增强ZIKV的稳定性和致病能力[23-26]。此外,在ZIKV包膜结构中,相邻的CD环之间又形成氢键相互作用网络[27],进一步增加了病毒的稳定性。E341、E343均位于ZIKV的CD环中,因此猜测这两个位点极有可能是影响ZIKV神经毒力的关键氨基酸位点。
病毒蚀斑实验表明,突变病毒JE/ZIKV(V343A)(1.09±0.15) mm、JE/ZIKV(I341V/V343A)(1.15±0.29) mm蚀斑直径均小于亲本株JE/ZIKV(MR766)(2.09±0.36) mm(P<0.001),而在减毒活疫苗的研发中,通常以蚀斑直径减小作为毒力减弱的标志[28-29],突变病毒蚀斑直径减小提示病毒毒力减弱。动物实验结果显示,突变病毒JE/ZIKV(V343A)(LD50=5.62 pfu/0.03 mL)、JE/ZIKV(I341V/V343A)(LD50=34.84 pfu/0.03 mL)神经毒力弱于亲本株JE/ZIKV(MR766)(LD50=2.21 pfu/0.03 mL),与蚀斑结果一致。生长曲线结果显示,突变病毒增殖速度较亲本株增快,联合突变病毒JE/ZIKV(I341V/V343A)略快于JE/ZIKV(V343A)。有文献报道,减弱宿主细胞凋亡效应能够促进病毒复制[30-31]。本研究中,突变病毒神经毒力较亲本株弱,但增殖却更快,可能是突变病毒诱导细胞凋亡减弱导致。
Xie等[32]研究发现,通过构建ZIKV包膜蛋白T351V突变破坏CD环间的氢键相互作用后,病毒毒力明显减弱,而通过构建突变ΔE346氨基酸缩小CD环结构会导致病毒无法组装。同样,Gallichotte等[24]研究也证实ZIKV扩展CD环在细胞类型依赖性复制、病毒粒子稳定性和体内发病机制起关键作用。结合文献推测有可能是V343A、I341V/V343A联合突变影响了CD环结构使病毒神经毒力减弱,或者是通过破坏CD环的稳定性,进一步破坏了CD环E350及E351处氢键网络的稳定性而使病毒毒力减弱。但由于本课题组在多次重复都未能得到I341V单点突变病毒,原因有待深入分析,因此未能对I341V单点突变病毒进行相关研究。综上所述,本研究结果表明,V343A、I341V/V343A突变均能够使嵌合病毒JE/ZIKV(MR766)毒力减弱,且I341V/V343A联合突变毒力较V343A单位点突变弱,减毒程度呈现出累加效应。
