常染色体显性遗传性多囊肾病肾移植临床技术操作规范(2022版)
2023-02-03中华医学会器官移植学分会
中华医学会器官移植学分会
常染色体显性遗传性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)是最常见的遗传性肾病,也是终末期肾病(end-stage renal disease,ESRD)的最常见原因之一。约15%的ADPKD患者接受透析治疗,约40%以上的ADPKD患者需要接受肾移植,约占肾移植受者的10%[1-2]。ADPKD导致尿毒症患者常合并多囊肾感染、出血,腹腔空间狭小或继发肿瘤等临床问题。因此,肾移植术前和术后临床医师均需面对ADPKD的诸多外科管理问题,包括多囊肾是否切除、切除时机的选择、切除方式以及术后管理监测等。
1 ADPKD的诊断
1.1 临床表现
85%的ADPKD患者具有常染色体显性遗传病特征,外显率几乎100%。其余患者无家族遗传史,与自身基因突变有关。患者主要表现为肾脏囊肿不断增大、增多,破坏正常的肾脏结构和功能,进而导致一系列的临床症状。患者多在35~40岁开始出现症状,肾脏相关的临床表现包括腰腹部疼痛(61%)、高血压(60%)、间歇性血尿(35%~50%)、泌尿系统感染(30%~50%)、肾结石(25%)、蛋白尿(11%)等,进一步发展可出现慢性肾功能不全,50%~70%的患者将最终进展至ESRD[3]。
ADPKD可合并肾外器官病变,包括肝脏、胰腺、精囊、脾及蛛网膜囊肿,颅内动脉瘤,心瓣膜病,憩室病,腹壁疝,精子异常和高脂血症等,体格检查可触及巨大肾脏和肝脏。
1.2 辅助检查
1.2.1 超声检查 对于有明确ADPKD家族史患者,主要依靠肾脏影像学进行诊断。超声检查为最常用的诊断方法,具有廉价、无创等优点,其诊断标准根据患者年龄而定:(1)15~39岁,双肾囊肿数≥3个;(2)40~59岁,每侧肾囊肿数≥2个;(3)年龄≥60岁,每侧肾囊肿数≥4个。年龄>40岁,肾脏囊肿不超过1个则可排除该疾病(推荐等级B级)[4]。
1.2.2 CT检查 CT较超声检查灵敏度高,还可获得用于未来对比的基线影像学检查结果,确定ADPKD的并发症及肾脏以外其它器官的病变,并可计算肾脏总体积以评估病情进展的风险。CT对于出血性囊肿、囊肿壁或囊肿间实质钙化以及合并肝囊肿的诊断率高。CT血管造影能显示残存功能肾实质的数量,尤其适合怀疑囊肿恶变或感染的患者。但由于造影剂对肾功能存在影响,CT血管造影仅限于估算肾小球滤过率(estimated glomerular filtration rate,eGFR)≥60 mL/(min·1.73 m2)的患者(推荐等级 C 级)[5]。
1.2.3 MRI检查 MRI对于较小的肾脏囊肿更为敏感,一般MRI显示囊肿数<5个可排除ADPKD[6]。对有脑出血家族史或既往有脑出血病史者推荐行磁共振血管成像(magnetic resonance angiography,MRA)筛查,无症状患者不建议常规行颅内动脉瘤筛查(推荐等级C级)。
1.3 家族史
家族史对ADPKD的诊断具有重要的参考价值,需要记录受累家庭成员的人数和关系、诊断年龄、发生ESRD的年龄以及已知的家族性基因突变。大约78%的ADPKD家族存在16号染色体异常(PKD1基因座),其余家族有14%存在位于4号染色体的基因缺陷(PKD2基因座),少数家族存在GANAB或DNAJB11基因缺陷[7]。PKD2基因缺陷患者的临床表型轻于PKD1基因缺陷患者,PKD2基因缺陷患者较晚出现囊肿,也较晚出现ESRD;一般PKD2和PKD1基因缺陷患者出现ESRD的平均年龄分别为74.0岁和54.3岁[8]。
1.4 基因诊断
目前主要采用长片段聚合酶链反应联合二代测序(next generation sequencing,NGS)技术对ADPKD患者进行基因突变检测[9]。PKD基因突变的检出率约为90%,仍有10%的基因突变无法检出[10]。以下情况应进行ADPKD突变基因诊断:(1)无家族史的散发患者;(2)影像学表现不典型者、家族史阳性的潜在活体肾脏供者;(3)疑似儿童患者的早期诊断、肾囊肿明显不对称、影像学表现不典型、肾衰竭而无明显肾脏增大、家庭成员病情差异显著及胚胎植入前遗传诊断等。
1.5 诊断标准
10%~15%的ADPKD患者无阳性家族史,发病原因包括自发突变、镶嵌型变异、亲代数据缺失等。双肾增大和双肾多发囊肿的患者即使无阳性家族史也需考虑ADPKD,超声检查双肾囊肿数>10个可基本确诊,肾外囊肿的存在有助于确诊。ADPKD的临床主要诊断标准包括双肾皮髓质分布多个液性囊肿和有明确的常染色体显性遗传家族史[11];次要诊断标准包括多囊肝、肾功能不全、腹壁疝、心脏瓣膜异常、胰腺囊肿、颅内动脉瘤和精囊腺囊肿。只要符合主要诊断标准和任意1项次要诊断标准即可临床诊断ADPKD。
2 ADPKD肾移植的适应证和禁忌证
肾移植是ADPKD伴ESRD患者的最佳肾脏替代治疗方式,与非糖尿病肾病患者相比,其术后受者和移植肾存活率差异无统计学意义[12]。在等待肾移植过程中可选择血液透析或腹膜透析,腹膜透析由于腹腔空间有限,腹壁疝发生率较高,故临床中多采用血液透析,但ADPKD不是腹膜透析的绝对禁忌证[13]。我国研究数据表明ADPKD患者血液透析与腹膜透析5年生存率差异无统计学意义[14]。
2.1 ADPKD肾移植的适应证
当ADPKD患者进展至ESRD,eGFR<20 mL/(min·1.73 m2)时,或需接受长期透析治疗时即符合进行肾移植的指征。
2.2 ADPKD肝肾联合移植的适应证
ADPKD进展至ESRD,合并终末期肝病、肝衰竭的患者具有肝肾联合移植的指征,包括:(1)多囊肾同时合并多囊肝,有症状的肝脏肿大或反复发作的胆管炎;(2)多囊肾合并遗传性代谢性疾病,如原发性高尿酸血症;(3)多囊肾合并乙型病毒性肝炎后肝硬化等。
2.3 ADPKD肾移植的禁忌证
ADPKD患者如合并以下情况则为肾移植的禁忌证:(1)多囊肾活动性出血或感染,需要先行多囊肾切除后才可以考虑肾移植;(2)肝炎病毒复制期;(3)近期心肌梗死,难治性心力衰竭或左心室射血分数<40%;(4)活动性消化性溃疡;(5)体内有活动性慢性感染病灶,包括未控制的脓毒血症、结核病等;(6)未经治疗的恶性肿瘤;(7)各种进展期代谢性疾病;(8)伴发其它重要器官终末期疾病,如心、肺、肝衰竭等(器官联合移植除外);(9)尚未控制的精神病或心理异常、依从性差;(10)一般情况差,呼吸系统功能不全,不能耐受肾移植手术者。
3 ADPKD肾移植术前评估及处理
3.1 多囊肾切除的评估
目前国内外学者对于ADPKD患者肾移植前多囊肾是否需要切除存在一定的争议,并且多囊肾切除手术标准及手术方式也不尽相同[15]。约20%的ADPKD患者需要进行单侧甚至双侧肾切除,虽然早期一些研究显示,与肾移植术后多囊肾切除相比,肾移植术前自体多囊肾切除患者术后受者和移植肾存活率更高,脓毒症发生率更低[15];但更多的研究表明无论是在肾移植术前、术中同期或术后切除多囊肾,在受者的移植肾功能、并发症发生率、受者生存率等预后指标中没有明显差异,但同期行肾移植和多囊肾切除可提高受者的满意度[16-17]。ADPKD患者移植前后多囊肾外科手术介入时机及手术方式推荐详见图1。一般肾移植术前多囊肾需要切除的指征包括:(1)多囊肾体积过大,延伸到潜在盆腔手术部位导致移植肾植入空间不足,推荐在行肾移植前或移植同期行自体多囊肾切除,采用同期方式要依据移植中心的技术特点来决定;(2)多囊肾导致反复腰腹部剧烈疼痛;(3)反复发作和(或)严重多囊肾感染;(4)多囊肾合并有症状的肾及输尿管结石;(5)无法控制的多囊肾复发和(或)严重出血;(6)怀疑多囊肾合并肾癌,这类患者建议双侧多囊肾同时切除,一旦确诊恶性病变,切除多囊肾后5年内不建议进行肾移植手术;(7)多囊肾导致的难治性高血压;(8)多囊肾体积过大压迫下腔静脉,或由于压迫胃肠道出现厌食、早饱等症状[18]。
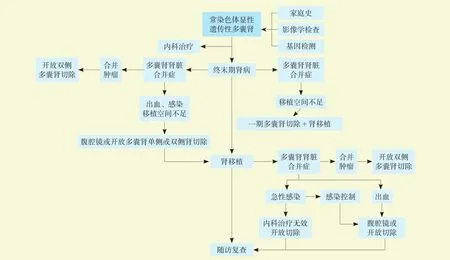
图1 多囊肾外科手术介入时机及手术方式推荐Figure 1 The recommended timing of intervention and operation method in polycystic kidney surgery
对于无症状或症状较轻的患者,并不常规推荐在移植前行自体多囊肾切除,特别是考虑到ADPKD患者的肾切除术具有较高的并发症及手术相关病死率。即使需要进行自体肾切除,也推荐尽量选择单侧肾切除,而选择哪侧多囊肾切除主要决定因素是明确疼痛或反复感染、出血等症状和体征主要来自哪侧肾脏。肾移植前保留多囊肾有如下优点:(1)可以使ADPKD患者保持一定尿量,使ADPKD患者在透析的过程中有更大的液体自由,降低了液体负荷导致充血性心力衰竭的发生率,提高生活质量;(2)可以减少ADPKD患者切除多囊肾时的输血量及输血带来的潜在致敏机会;(3)避免了患者多囊肾切除的手术风险和手术相关并发症;(4)避免多囊肾切除导致的钙吸收减少,促红细胞生成素分泌减少等并发症[19-21]。
3.2 多囊肾感染指标的评估与治疗
ADPKD患者出现发热、腰痛、血沉快、C-反应蛋白及降钙素原升高,应首先考虑急性肾盂肾炎和(或)囊肿感染。白细胞管型的存在提示急性肾盂肾炎,而囊肿感染可能表现为一个界限清晰的区域压痛,尿沉渣可以表现为无明显异常。此外,在某些患者中肾实质和肾囊肿的感染可以同时存在。尿常规正常或血、尿培养结果阴性并不能排除感染。常规CT成像对于感染的诊断准确性有限。静脉注射18F-氟代脱氧葡萄糖后的正电子发射计算机体层显像仪(positron emission tomography and computed tomography,PET/CT)在识别和定位肾囊肿感染方面优于常规的放射成像技术[22]。
感染致病菌以大肠埃希菌最为常见(74.0%~82.4%),囊肿感染的标准治疗是根据血、尿培养结果选用脂溶性抗生素(喹诺酮类、复方新诺明及甲硝唑等)[23]。治疗72 h症状未见好转者应联合使用水溶性抗生素(头孢菌素、碳青霉烯类等),并避免使用损害肾功能的药物。治疗周期至少持续10~14 d,或至症状消失、体温正常、两次血或尿培养结果阴性后1周停药[23]。如发热持续1~2周,应给予感染囊肿穿刺或手术引流,ESRD患者可行感染肾切除。尿路感染患者首选氟喹诺酮类抗生素,但近年来氟喹诺酮类抗生素耐药率增高,建议按照药敏试验选择合适抗生素。如病情反复应延长疗程,肾盂肾炎治疗时间至少2周,囊肿感染需要延长至4~6周,如果未治愈,最长可延长至6~12个月。
4 多囊肾切除术
随着微创技术的发展,多囊肾切除从以前单一的开放手术转变为后腹腔镜多囊肾切除术,但微创手术要求更为熟练的腹腔镜技术,不应盲目追求。腹腔镜操作的关键是有技巧地破除囊肿,提供足够的后腹腔空间,所以对于出血严重、囊肿感染或不能排除恶性肿瘤的患者在腹腔镜下切开囊肿要慎重选择。
后腹腔镜多囊肾切除术:患者体位采用斜45°侧卧位,术者及助手立于患者背侧,腹腔镜各穿刺套管采用常规四孔后腹腔镜入路,分别位于髂棘上两横指(A孔)置10 mm Trocar,右腋前线肋缘下(B孔)置12 mm Trocar,腋后线肋缘下(C孔)置10 mm Trocar,腋前线髂棘水平(D孔)置5 mm Trocar,A孔进镜,B、C孔进操作器械,D孔进助手辅助操作器械。进入腹膜后腔隙,充分游离肾脏及输尿管,暴露肾蒂,根据情况切开部分囊肿并吸尽囊液。应用Hemolock逐个夹闭并切断肾动静脉及输尿管,彻底游离肾脏后暂不取出。取肋缘下切口或取Gibson切口,并适当延长,经此切口将多囊肾取出[24]。
开放手术:选择经腹腔途径,切口选择肋缘下切口(从腹正中至腋中线),必要时在正中沿肋缘向对侧延长(上腹“人”字形切口);或者选择正中切口,从剑突下至脐下。打开结肠旁沟,牵拉结肠,暴露并切断肾蒂,同一般肾切除步骤相似,游离切除多囊肾。
5 ADPKD肾移植术后管理
5.1 免疫抑制剂的使用
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号靶点在ADPKD患者囊肿发育中起到一定作用,而使用mTOR抑制剂可减缓ADPKD患者囊肿生长[25]。有研究表明以mTOR抑制剂为主要免疫抑制方案的ADPKD肾移植受者与以钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)为主者相比,前者肾囊肿和肝囊肿体积减小更为明显[26]。但目前仍缺乏大宗临床研究来支持ADPKD肾移植受者优先使用mTOR抑制剂作为主要免疫抑制方案具有明显的临床优势[27]。同时也需要进一步的研究来确定mTOR抑制剂的最佳治疗时间点及合适的药物浓度水平。因此,目前ADPKD患者肾移植术后采用的维持免疫抑制方案依然推荐以CNI类药物为主的三联免疫抑制方案。
对于免疫诱导方案的选择,ADPKD肾移植需要根据供受者的诸多危险因素进行综合考虑。一般情况下,ADPKD患者不属于高免疫风险移植,也不存在特殊的致敏因素,同时考虑到ADPKD患者肾移植术后面临长期的感染风险,所以巴利昔单抗较常用于ADPKD肾移植的免疫诱导。而对于发生移植肾功能延迟恢复及排斥反应高风险者多选择T淋巴细胞清除性抗体[兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte immunoglobulin,rATG)、抗人T细胞兔免疫球蛋白(anti-T lymphocyte globulin-Fresenius,ATG-F)]进行诱导治疗。需考虑的因素主要包括:(1)免疫因素,预存供者特异性抗体、群体反应性抗体水平显著升高,以及再次移植等情况;(2)供者因素,扩大标准或边缘性供肾、心脏死亡器官捐献、供肾冷保存时间>12 h;(3)受者因素,心血管疾病史、体质量指数>35 kg/m2、丙型肝炎病毒阳性、年龄>60岁、不同种族等[28]。
5.2 肾移植术后多囊肾的监测
5.2.1 自体多囊肾监测 ADPKD患者在肾移植成功后,其自体肾脏的体积会显著减小。已有研究发现ADPKD患者肾移植术后自体多囊肾体积均有缩小,术后0.5~1年、1~3年、3~10年和10年以上,多囊肾体积分别平均减小了20%、28%、38%和45%[29-30]。而体积减小主要发生在肾移植术后早期,此后体积减少速率会下降。但ADPKD患者肾移植术后仍然存在较高的囊肿出血、感染和发生肿瘤的风险,故推荐移植术后对自体多囊肾进行监测。可使用肾脏总体积年增长率监测和评估多囊肾进展。肾脏总体积可采用超声、CT或MRI测算。长期随访研究可采用超声测定肾脏总体积,但超声检查存在可重复性差、精确度低,受检查者操作影响等缺点。如进行短期临床干预研究,建议采用MRI或CT检查,并对数据进行三维重建后精确测算肾脏总体积。CT血管造影可区分非囊肿性组织(完全强化区)和纤维化、无功能的肾组织(低强化或“分隔中度强化”区)。MRI可精确测量肾脏血流,肾脏血流量减少与ADPKD进展相关。推荐MRI的T2加权成像技术,无辐射损伤。影像学报告应该标准化,包括最大肾脏长度、宽度、厚度测量,并计算肾脏总体积(mL)=π/6×长度(mm)×宽度(mm)×厚度(mm)[23]。
5.2.2 感染监测 术后感染在ADPKD肾移植受者中非常常见,特别对于肾移植术前有过感染病史的ADPKD患者。一方面肾移植术后免疫抑制药的应用增加了ADPKD患者感染的风险。另一方面,患者的集合管系统经常被增大的囊肿压迫阻塞,这影响到微生物的有效清除并促进细菌生长。因此,肾移植术后推荐常规进行感染指标的监测,包括体温监测、血常规、C-反应蛋白、尿常规、降钙素原、血沉等。明确感染后积极抗感染治疗,避免因肾移植术后感染造成抗体介导的排斥反应、微血栓性疾病等一系列并发症影响移植肾功能,甚至危及受者生命。
5.2.3 颅内动脉瘤监测 颅内动脉瘤破裂是ADPKD最严重的并发症,血管造影检查是诊断颅内动脉瘤的金标准。以下ADPKD患者需要进行无症状颅内动脉瘤筛查:(1)有颅内动脉瘤家族史和有颅内动脉瘤破裂出血史;(2)对颅内动脉瘤发病特别焦虑;(3)一旦颅内动脉瘤破裂会威胁生命安全的患者;(4)突发非典型的、突然加重的剧烈头痛并伴有其他神经系统症状[31]。有颅内动脉瘤阳性家族史,血管造影筛查阴性的患者应每隔5年进行重复筛查[32]。
5.2.4 肾移植术后多囊肾切除 关于肾移植术后自体多囊肾切除的时机与肾移植术前类似,在患者发生反复的囊肿感染和出血,复杂性肾结石和疑似肾癌的情况下,推荐在肾移植术后切除患者一侧或双侧的多囊肾。相比于在肾移植术前切除,肾移植术后切除单侧或双侧多囊肾通常也更为稳妥,术后良好的肾功能、正常的凝血功能和更好的全身状况可减少肾切除的并发症,并使得多囊肾切除术后残腔得以顺利愈合[15]。对于肾移植术后多囊肾切除的手术方式,推荐如因感染或肿瘤需要切除多囊肾时,选择开放手术切除,避免因囊液破溃而造成的细菌及肿瘤的种植和播散。
执笔作者:王 强 朱一辰
通信作者:田 野
审稿专家(按姓氏拼音排序):
丁小明 西安交通大学第一附属医院
胡小鹏 首都医科大学附属北京朝阳医院
林 俊 首都医科大学附属北京友谊医院
李 响 中国人民解放军总医院第八医学中心
欧彤文 首都医科大学附属北京宣武医院
杨 洋 首都医科大学附属北京友谊医院
周晓峰 中日友好医院
张 磊 首都医科大学附属北京友谊医院
