西门塔尔牛表皮干细胞的分离培养与生物学特性研究
2023-02-03牛锐利宋哈楠王育南高也凡关伟军宗宪春
牛锐利,宋哈楠,吴 月,王育南,高也凡,关伟军,宗宪春
(1.牡丹江师范学院生命科学与技术学院,牡丹江 157011;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
1960年西门塔尔牛(Simmental)由前苏联引进中国,至今已成为中国牛肉产区的主要品种之一[1]。2020年Meng等[2]分析了西门塔尔牛的转录组学,成功建立了西门塔尔牛转录组遗传资源,同时分析了与其肉质相关的差异表达基因,推动了西门塔尔牛遗传资源的研究,为西门塔尔牛遗传育种的研究奠定了一定的基础。但目前西门塔尔牛干细胞遗传资源的建立及保存仍存在缺失。表皮干细胞(EpSCs)作为干细胞,是西门塔尔牛一种重要的遗传种质资源。干细胞具有多向分化潜能[3],是自我更新能力很强的细胞。EpSCs存在于人和动物最大器官——皮肤中,在皮肤的更新、损伤修复与再生过程中起着重要的作用,在干细胞治疗和再生医学中具有重要的研究意义[4]。EpSCs来源于胚胎时期的外胚层[5]。在胚胎发育早期,外胚层细胞对称分裂增殖产生大量基底细胞附着于基底膜并形成皮肤基板[6]。随着胚胎的发育,基板中基底细胞经不对称分裂形成一部分子细胞向外迁移发育出一层扁平细胞,这层细胞暴露于羊水中形成周皮,另一部分继续留在基板。表皮的增厚及皮肤附属物的发育与基底层细胞的不断分裂相关[7],这些细胞具有潜在的多能性。2006年Moore和Lemischka[8]将基板中具有多向分化潜能的基底细胞定义为表皮干细胞。研究发现,除基底层基底细胞外,表皮干细胞还包含毛囊干细胞(hair stem cells,HSCs)[9],滤泡间表皮干细胞(interfollicular epidermal stem cells,IESCs)[10]和汗腺干细胞(sweat gland stem cell,SGSCs)[11]等。在基底层、毛囊和滤泡间表皮存在的ESCs均特异性表达特定基因[12],主要包含KRT15、KRT19[13]、KRT10[14]和KRT9等。细胞整合素对于表皮的扩增和维持表皮稳定具有重要作用,细胞整合素β1(integrin β1,ITG β1)通过信号调节调控凋亡蛋白在EpSCs中的水平控制细胞的凋亡[15],细胞整合素α6(integrin α6,ITG α6)可调节EpSCs的高增殖和克隆能力[16]。EpSCs在体内被证实具有向表皮、毛囊等皮肤附件分化的潜能[17]。P63是一种与肿瘤抑制基因p53相关的转录因子,可以维持基底细胞的再生能力,并在调节外胚层间质的相互作用中发挥功能[18]。P63磷酸化水平的调控与EpSCs分化为角质形成细胞密切相关,其主要出现在基底EpSCs[19]。胚胎时期,存在于基底层的EpSCs可增殖迁移到毛发胚芽的EpSCs形成毛囊干细胞,进一步分化为毛囊细胞[20]。存在于汗腺中的EpSCs具有分化为汗腺细胞的潜能[21]。甲基质中EpSCs可分化为甲板细胞[22],并参与指甲的再生。EpSCs在体外特定条件下也可诱导分化为汗腺[23]、神经[24]、内皮[25]等不同胚层的细胞。本研究以西门塔尔牛背部表皮为试验材料获得EpSCs,对其进行鉴定并探讨其体外诱导分化潜能。通过EpSCs的分离以期建立生长状态良好的西门塔尔牛EpSCs系,为建立西门塔尔牛种质资源库提供细胞遗传资源,同时为干细胞治疗研究提供种子细胞。
1 材料与方法
1.1 材料
1.1.1 试验动物 3月龄西门塔尔牛由河北省廊坊市万福肉类有限公司提供。
1.1.2 主要试剂 L-DMEM培养基、胰蛋白酶(Trypsin1:250)、Ⅱ型中性蛋白酶(Dispase Ⅱ)胎牛血清(fetal bovine serum,FBS)均为Gbico公司产品;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)均为Peprotech公司产品;Ⅳ型胶原(TypeⅣ)为HZbscience公司产品;胰岛素(insulin,INS)、吲哚美辛为Aladdin公司产品;地塞米松(Dexamethasone,DXMS)为麦克林公司产品;β-甘油磷酸、β-琉基乙醇、3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-methylxanthine,IBMX)、乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)、聚乙二醇辛基苯基醚(TritonX-100)、二甲基亚砜(DMSO)、抗坏血酸盐(Vc)均为Sigma公司产品;FITC标记兔抗鼠二抗、鼠多克隆抗体、细胞整合素β1(Integrin β1,ITG β1)、P63和转铁蛋白受体(Transferrin receptor,TFRC/CD71)均为Abcam公司产品;Trizol为Invitrogen产品;RT-PCR试剂盒、DL1 000 DNA Marker为TaKaRa产品。
1.1.3 培养基配制 完全培养基:L-DMEM+10% FBS+10 ng·mL-1EGF+10 ng·mL-1bFGF+2 mmol·L-1M谷氨酰胺;脂肪细胞诱导液:L-DMEM培养基+12% FBS+1%青、链霉素+0.5 mmol·L-1IBMX+10 mg·L-1INS+1 umol·L-1DXMS+200 μmol·L-1吲哚美辛;软骨细胞诱导液:L-DMEM培养基+2.5% FBS+1% ITS+50 μg·mL-1L-脯氨酸+0.1 μm地塞米松+0.9 mmol·L-1丙酮钠+50 μg·mL-1L-抗坏血酸+10 ng·mL-1TGF-β3;成骨细胞诱导液:L-DMEM培养基+10% FBS+10 mmol·L-1β-甘油磷酸钠+0.1 mmol·L-1抗坏血酸+ 10 mmol·L-1地塞米松+10 ng·mL-1 TGF-β3;细胞冻存液:40% L-DMEM+50% FBS+10% DMSO。
1.2 方法
1.2.1 西门塔尔牛表皮干细胞分离培养 准备1 mL TypeⅣ,将其均匀铺在60 mm细胞培养皿中,置于CO2培养箱中2 h待其凝固。取3月龄西门塔尔牛胎牛背部表皮并浸泡于75%酒精中5 min进行消毒,在超净台取出表皮,在PBS中清洗3次,用眼科镊子和剪刀轻轻将表皮层和真皮层分离,PBS再次清洗3次,将表皮剪至2~3 mm3。酶消法:剪好的组织置于Dispase Ⅱ中37 ℃消化30 min,在显微镜下观察有大量分散圆形的细胞时用含有FBS的L-DMEM终止消化,用500目细胞筛过滤,1 200 r·min-1离心5 min。将细胞重悬并接种于铺有TypeⅣ的细胞培养皿,在37 ℃,50 mL·L-1CO2培养箱内培养,24 h后半量换液。贴壁法:用眼科镊子直接将2~3 mm3大小的组织贴于铺好TypeⅣ的细胞培养皿中,将培养皿倒置放于培养箱约20 min,待组织块贴紧皿底后加入完全培养基进行培养。
1.2.2 西门塔尔牛表皮干细胞传代与冻存 西门塔尔牛EpSCs汇集度达到80%可进行传代。弃去培养皿中培养基,用PBS清洗后加入0.25%胰酶置于37 ℃消化3 min,待细胞变圆用含FBS的L-DMEM终止消化。接种于2个培养皿中,置于37 ℃,50 mL·L-1CO2培养箱中继续培养。EpSCs汇集度达到80%可进行冻存。将细胞用胰酶消化并收集至离心管中,1 200 r·min-1离心5 min,弃上清,约每106个细胞加入1 mL细胞冻存液重悬,将细胞悬液转移至冻存管中进行冷冻保存。
1.2.3 西门塔尔牛表皮干细胞生长曲线测定 取P3代、P10代和P15代EpSCs分别制成细胞悬液进行细胞计数,按照104个细胞每孔接种至24孔细胞培养板中,每天对3个孔进行计数取平均值,连续计数7 d。绘制生长曲线,并计算细胞群体倍增时间(population doubling time, PDT)。PDT的计算公式:PDT=(t-t0) lg2/ (lgNt-lgN0),其中t表示EpSCs对数生长期结束的时间,t0表示EpSCs对数生长期开始的时间,Nt表示EpSCs对数生长期结束时的细胞数量,N0表示EpSCs对数生长期开始时的细胞数量。
1.2.4 西门塔尔牛表皮干细胞RT-PCR检测 取汇合度达90%的P6代西门塔尔牛EpSCs,PBS清洗2次,加入1 mL TRIzol将细胞吹打至脱离培养皿并收集于1.5 mL EP管中静置5~10 min进行细胞裂解;加入氯仿轻微震荡15 s,室温静置10 min,4 ℃,12 000 r·min-1离心15 min;弃上清,加入等体积的异丙醇震荡15 s,室温静置15 min,4 ℃,12 000 r·min-1离心15 min;75% 乙醇(DEPC水配制)清洗2次,4 ℃,12 000 r·min-1离心15 min,弃上清晾干;用DEPC水溶解RNA,测RNA 260/280比值,260/230比值及RNA浓度。RNA OD260 nm/OD280 nm比值理想值应在1.8~2.0;RNA OD260 nm/OD230 nm比值理想值应在1.8~2.2;调整RNA浓度,使RNA浓度保持在1 000 μg·mL-1左右。利用反转录试剂盒将RNA反转录为cDNA。根据NCBI设计引物,引物由生工生物工程(上海)股份有限公司合成。PCR反应体系25 μL:2×Taq PCR Mixture 12 μL,cDNA 1 μL,Primer 1、2(Primer 1为稀释10倍后的上游引物,Primer 2为稀释10倍后的下游引物。引物设计信息见表1)各1 μL,ddH2O 10 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,退火(退火温度见表1)30 s,72 ℃延伸1 min,共30个循环;72 ℃总延伸5 min。用2.0%琼脂糖对PCR产物进行琼脂糖凝胶电泳检测,并成像拍照。
1.2.5 西门塔尔牛表皮干细胞表面标志物检测 取P6代EpSCs消化收集并接种于6孔板中。待细胞汇合度达到60%,弃去培养基,用PBS清洗3次;4%多聚甲醛固定20 min,PBS清洗3次;加入0.25% Triton X-100进行通透10 min,PBS清洗3次;加入山羊血清静置30 min封闭EpSCs表面非特异性标记,PBS清洗3次;分别在每孔加入鼠多克隆抗体:ITG β1、P63和CD71(1∶300)室温孵育1 h,PBS清洗3次;加入兔抗鼠二抗(1∶100)避光室温孵育30 min,PBS清洗3次;加入DAPI室温避光孵育30 min,PBS清洗3次;用共聚焦显微镜(TE-2000-E,Nikon)进行观察并拍照,并通过总细胞和免疫荧光细胞计数比计算阳性细胞率。
1.2.6 脂肪细胞诱导分化及鉴定 取P7代EpSCs细胞随机分为对照组和脂肪诱导组,待其汇合度达到70%时,将脂肪诱导组培养基更换成脂肪细胞诱导液继续培养,每3 d更换1次脂肪细胞诱导液;对照组加入完全培养基正常培养,每3 d更换1次完全培养基。成脂诱导在培养16~18 d,镜下观察产生大量脂滴后利用油红O对脂滴进行染色,并提取RNA利用RT-PCR对成骨特异性基因过氧化物酶体增殖因子活化受体γ(PPAR-γ)和脂蛋白酶(LPL)表达情况进行检测。引物设计见表1,PCR反应体系及反应条件同“1.2.4”。
1.2.7 成骨细胞诱导分化及鉴定 取P7代EpSCs细胞随机分为对照组和成骨诱导组,待其汇合度达到70%时,将成骨诱导组培养基更换成骨细胞诱导液继续培养,每3 d更换1次成骨诱导液;对照组加入完全培养基正常培养,每3 d更换1次完全培养基。连续培养15~16 d后,观察细胞形态,用茜素红对钙结节进行染色,并利用TRIzol提取RNA通过RT-PCR对成骨特异性基因胶原蛋白Ⅰ(CollagenⅠ)和矮小转录因子2(RUNX2)表达情况进行检测。引物设计见表1,PCR反应体系及反应条件同“1.2.4”。
1.2.8 软骨细胞诱导分化及鉴定 取P7代EpSCs细胞随机分为对照组和软骨诱导组,待其汇合度达到70%时,将软骨诱导组培养基更换成软骨细胞诱导液继续培养,每3 d更换1次软骨细胞诱导液;对照组加入完全培养基正常培养,每3 d更换1次完全培养基。软骨诱导在培养21 d后,观察细胞形态,用阿利新蓝对其染色,并提取RNA利用RT-PCR对成软骨特异性基因双糖链蛋白多糖(BGN)和胶原蛋白Ⅱ(CollagenⅡ)表达情况进行检测。引物设计见表1,PCR反应体系及反应条件同“1.2.4”。
2 结 果
2.1 西门塔尔牛表皮干细胞分离培养
利用组织块贴壁法将组织培养至第6天时,有少量长梭形和多边形细胞从组织块周围游离出。如图1A所示,通过组织贴壁法获得的细胞致密杂乱,存在许多成纤维状细胞,EpSCs的纯度较低。经过不断传代纯化EpSCs,传代至P4代时,细胞形态均一,呈多边形,获得较高纯度的EpSCs。酶消化法利用Dispase Ⅱ对表皮组织消化30 min后得到分散的细胞,培养12 h后细胞贴壁率达85%。如图1B所示,此时细胞大多呈铺路石状,细胞大小均匀,纯度较高。对比直接将组织块和消化后的细胞接种于细胞培养皿中,在培养皿底部铺上TypeⅣ可增加EpSCs细胞的粘附性,同时起到一定纯化EpSCs的作用。细胞平均2 d传代1次,传代至P28代时,细胞开始扁平化,有少量空泡产生,细胞增殖缓慢,传代时间延长,出现细胞衰老。
2.2 西门塔尔牛表皮干细胞生长曲线测定
利用细胞计数法对西门塔尔牛EpSCs连续计数7 d,利用graphpad prism 9软件绘制细胞生长曲线(图2)。由图2可知,EpSCs P3代、P10代和P15代细胞生长曲线均呈“S”型。在第1~3天经历了潜伏期,第1~2天细胞增殖缓慢,第2~3天细胞增殖变快;第3~5天为对数生长期,细胞呈指数增长;第6~7天细胞增殖减缓,逐渐进入平台期。由不同代次EpSCs生长曲线可知,随着细胞代次的增加,细胞增殖速度逐渐减弱,达到的细胞饱和密度也相应降低。由表2可知P3代细胞的群体倍增时间为31.08 h,P10代细胞的群体倍增时间为32.77 h,P15代细胞的群体倍增时间为34.08 h。随着代次的增加,EpSCs的群体倍增时间逐渐增加。由3个代次数据得出西门塔尔牛EpSCs平均群体倍增时间为32.64 h。
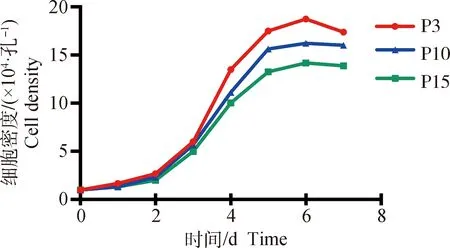
图2 西门塔尔牛EpSCs生长曲线Fig.2 Growth curve of EpSCs in Simmental cattle

表2 西门塔尔牛EpSCs群体倍增时间Table 2 Population doubling time of EpSCs in Simmental cattle
2.3 西门塔尔牛表皮干细胞RT-PCR鉴定
通过RT-PCR的方法对西门塔尔牛EpSCs特异性基因进行扩增,由图3可知,西门塔尔牛EpSCs表达ITGβ1、ITGα6和KRT19基因,不表达CD31。符合表皮干细胞特性,表明此细胞是西门塔尔牛EpSCs。
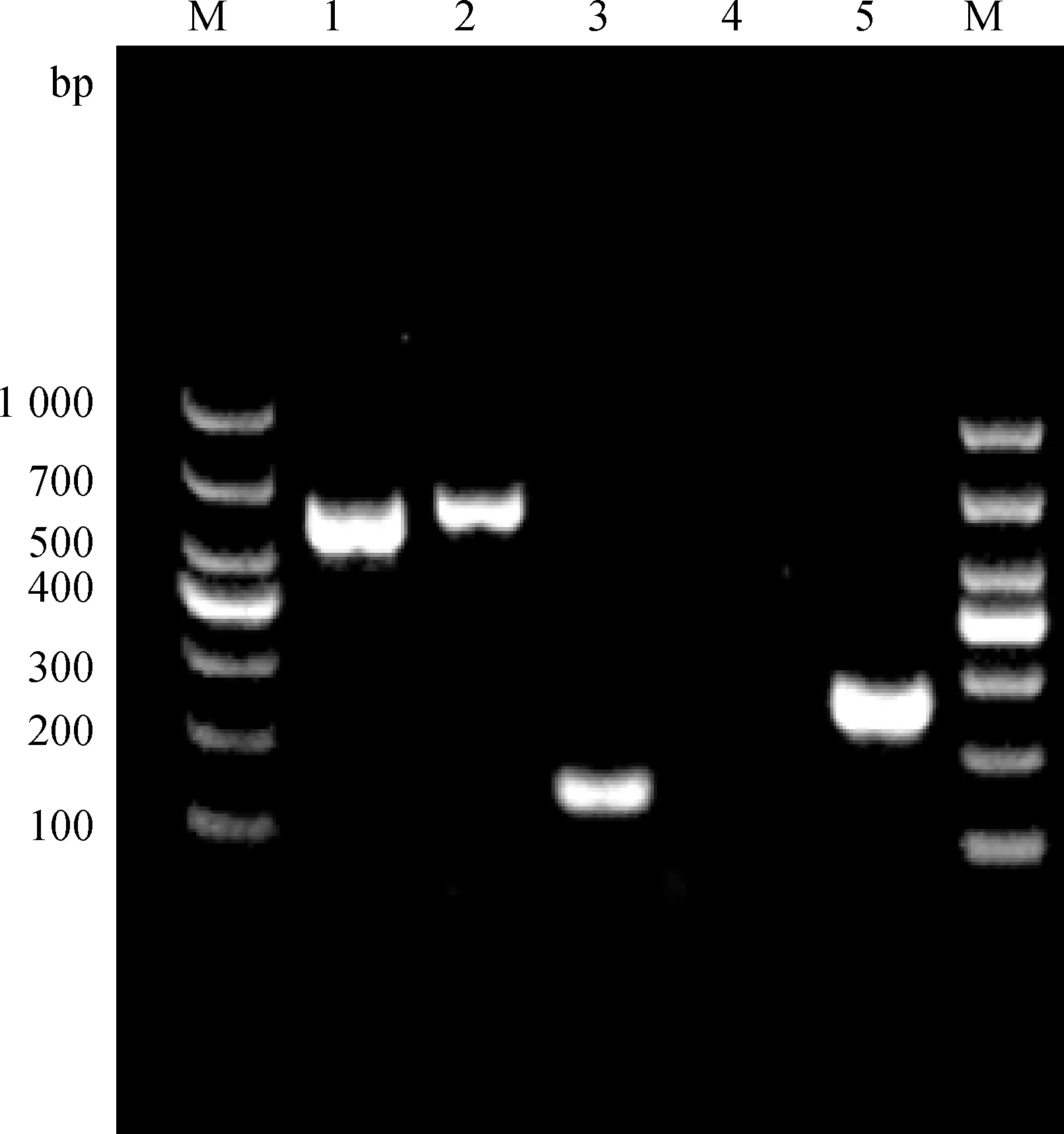
M.DL1000 DNA Marker;1~5.分别为ITG β1、KRT19、ITG α6、CD31和GAPDH基因M.DL1000 DNA Marker;1-5. ITG β1, KRT19, ITG α6, CD31 and GAPDH genes,respectively图3 西门塔尔牛EpSCs 表面标记物PCR检测Fig.3 PCR identification of EpSCs surface markers in Simmental cattle
2.4 西门塔尔牛表皮干细胞表面标志物检测
取P6代生长旺盛的西门塔尔牛EpSCs消化收集并接种于6孔板中。待细胞汇合度达到60%时利用免疫细胞化学的方法对细胞表面特异性标记物ITG β1、P63和CD71进行检测。在共聚焦显微镜下观察分析EpSCs表面标志物ITG β1、P63和CD71的表达情况。结果如图4所示,Fluorescence为相应抗体着色,DAPI为EpSCs核染,Merged为两者叠加情况。在共聚焦显微镜下观察发现EpSCs表面标志物ITG β1、P63和CD71呈阳性表达。符合表皮干细胞生物学特性,表明此细胞是西门塔尔牛EpSCs。经计算得细胞中ITG β1阳性细胞比为98.5%,P63阳性细胞比为100%,CD71阳性细胞比为95.3%。

图4 西门塔尔牛EpSCs免疫荧光Fig.4 Immunofluorescence of EpSCs in Simmental cattle
2.5 脂肪细胞诱导分化及鉴定
西门塔尔牛EpSCs在加入脂肪诱导液诱导16 d后,细胞增殖缓慢,镜下可见大量小而分散,折光性非常强的透明脂滴(图5B),这些脂滴经过一段时间的积累呈簇状聚集。利用油红O对脂滴进行染色,大量脂滴呈红色,如图5C箭头所示。对诱导后的脂肪细胞提取RNA并进行RT-PCR检测。结果显示,诱导后的细胞LPL和PPAR-γ基因呈阳性表达,结果如图5D所示。
2.6 成骨细胞诱导分化及鉴定
西门塔尔牛EpSCs成骨诱导16 d后,镜下可观察到如图6B所示钙化结节,经茜素红染色后,如图6C所示钙结节呈红色。对诱导后的成骨细胞提取RNA并进行RT-PCR检测,结果表明,诱导后的成骨细胞RUNX2和CollagenI基因呈阳性表达,如图6D所示。

A. 未加成骨诱导液的EpSCs;B. 加成骨诱导液的EpSCs;C. 茜素红染色;D. 骨细胞特异性基因PCR检测:M. DL1000 DNA Marker;1~3. 分别为 CollagenⅠ、RUNX2和GAPDH 基因A. No osteogenic inducer of EpSCs;B. Add osteogenic inducer of EpSCs;C. Alizarin Red Staining;D. Detection of bone cell-specific gene by PCR: M. DL1000 DNA Marker;1-3. CollagenⅠ, RUNX2 and GAPDH genes,respectively图6 西门塔尔牛EpSCs的成骨诱导Fig.6 Osteogenic induction of EpSCs in Simmental cattle
2.7 软骨细胞诱导分化及鉴定
软骨诱导14 d后镜下观察,培养皿中出现少量具有一定厚度边缘模糊的软骨基质样结构,如图7B箭头所示,同时伴有大量折光性强的结晶样物质产生。诱导21 d软骨基质样结构变多,利用阿利新蓝对软骨基质进行染色,结果如图7C所示,软骨基质被阿利新蓝染色呈蓝色突起。对诱导后的软骨细胞及软骨基质提取RNA并通过RT-PCR检测软骨细胞特异性基因。结果如图7D所示,诱导后的软骨细胞BGN和CollagenⅡ呈阳性表达。

A. 未加软骨诱导液的EpSCs;B. 加软骨诱导液的EpSCs;C. 阿利新蓝染色;D. 软骨细胞特异性基因PCR检测:M. DL1000 DNA Marker;1~3. 分别为和GAPDH、BGN和CollagenⅡ基因A. No cartilage inducer of EpSCs;B. Add cartilage inducer of EpSCs;C. Alcian blue staining;D. Detection of chondrocyte-specific gene by PCR: M. DL1000 DNA Marker;1-3. GAPDH, BGN and CollagenⅡ genes,respectively图7 西门塔尔牛EpSCs的软骨诱导Fig.7 Cartilage induced of EpSCs in Simmental cattle
3 讨 论
目前干细胞治疗研究成为生命科学及临床医学的研究热点,在2020年大规模爆发的新型冠状病毒治疗中,干细胞为新型冠状病毒感染的患者提供了新型的治疗方案[26-27],干细胞在临床医学上有着巨大的潜力。在医疗和美容行业,以EpSCs为种子细胞,推动了皮肤创伤修复研究和医学转化[4]。在西门塔尔牛种质资源的保存研究中,EpSCs资源的保存将为其提供一种新方法,为西门塔尔牛的育种及资源保存提供重要材料。本研究以酶消化法和组织贴壁法分离得到EpSCs。组织贴壁法获得EpSCs较缓慢,组织贴壁后6~7 d生长出细胞,酶消法获取EpSCs迅速,效率高,纯度高。EpSCs对基底膜有较强的黏附性,但在体外培养中,EpSCs对细胞培养皿的黏附性较弱,本试验采用在细胞培养皿中铺TypeⅣ[28]的方式增加其黏附性。同时对比表皮成纤维细胞,EpSCs酶消化时间较长,不易脱落,通过控制酶消时间可对EpSCs进行逐步纯化,通过试验发现,EpSCs胰酶适宜消化条件为0.25%胰酶,37 ℃消化3 min。生长曲线从一定程度上可以反应细胞活力[29]。EpSCs生长曲线呈典型的“S”型,由细胞生长曲线和群体倍增时间可知随着EpSCs代次增加细胞增殖速度减弱,群体倍增时间延长。随着细胞传代次数的增加,细胞会受到外力的机械性损伤以及自然衰老,细胞的活力逐渐下降。RT-PCR结果显示细胞表达ITGβ1、ITGα6和KRT19,不表达CD31基因;免疫荧光结果显示EpSCs表达ITG β1、P63和CD71,与Wang等[30]研究结果一致,说明分离得到的细胞为EpSCs,经免疫荧光细胞计数比得到细胞阳性率大于90%。
干细胞在自我更新的同时具有多向分化的潜能,EpSCs在体内被证实具有向表皮、毛囊和皮肤附件分化的潜能[17]。EpSCs在体外培养时,P4代EpSCs纯度较低,传代至P12代时部分细胞存在分化情况,同时P5~P10代细胞增殖速度快,细胞活力强,因此诱导分化时可选用P5~P10代细胞进行检测。在研究EpSCs分化潜能时则统一选取P7代EpSC进行诱导分化。本试验在研究EpSCs向脂肪细胞诱导分化的过程中,总结前人干细胞脂肪诱导液配方,采用L-DMEM培养基+12% FBS+1%青、链霉素+0.5 mmol·L-1IBMX+10 mg·L-1INS+1 μmol·L-1DXMS+200 μmol·L-1吲哚美辛诱导体系[31],16 d即可得到折光性强的大量脂滴,油红O染色后脂滴变红。对EpSCs进行检测,发现诱导后的细胞特异性表达脂肪细胞PPAR-γ和LPL基因。在体外将EpSCs向成骨细胞诱导分化的过程中,在诱导液中加入β-甘油磷酸钠,抗坏血酸和地塞米松的基础上,加10 ng·mL-1TGF-β3会显著提高诱导效率,诱导10 d后镜下可观察到钙结节的形成,16 d产生大量可被茜素红着色的钙沉积物,且表达CollagenⅠ和RUNX2基因。EpSCs在体外向软骨细胞诱导分化的过程中加入10% FBS培养2 d后细胞汇合度达90 %甚至更高,引起很多细胞飘落甚至在宏观条件下可看到细胞培养皿底部的细胞呈片状卷边飘起。故在添加FBS时可适当减少血清含量以减慢细胞的增殖。在诱导14 d后可在镜下观察到少量小的软骨基质,诱导21 d后软骨基质增多,结构增大,经阿利新蓝染色后软骨基质呈蓝色且高表达BGN和CollagenⅡ基因。说明EpSCs具有向脂肪细胞、软骨细胞和成骨细胞分化的潜能。
4 结 论
本试验成功从西门塔尔牛表皮中分离得到EpSCs,细胞形态呈铺路石状,细胞生长状态和活力良好。免疫荧光结果显示EpSCs表面特异性标记物ITG β1、P63和CD71呈阳性表达,RT-PCR结果显示EpSCs高度表达ITGβ1、ITGα6和KRT19,不表达CD31基因。在体外特定条件下可将EpSCs诱导分化为脂肪细胞,软骨细胞和成骨细胞,证明EpSCs具有向不同胚层细胞诱导分化的潜能。成功建立了西门塔尔牛EpSCs体外分离培养体系。
