人参皂苷Rg3通过调节AMPK/mTOR信号通路提高骨质疏松老年大鼠骨密度及骨代谢
2023-02-03马伟凤王亮马彦巧谢媛媛王天天汤玉萌陈文文王云
马伟凤,王亮,马彦巧,谢媛媛,王天天,汤玉萌,陈文文,王云
(1.中国人民解放军总医院第八医学中心老年医学科,北京100091;2.北京朝阳医院疼痛科,北京 100020)
骨质疏松症(osteoporosis,OP)是一类以骨微结构退化、骨量减少和骨密度下降为特征的代谢性疾病,是老年人的常见病[1]。据报道,在我国50岁以上的中老年人OP的发病率约为30%[2]。由于OP发生的骨折病例不断增加,其高致残率和致死率严重影响患者的生活质量。目前,临床常用的OP治疗药物为双磷酸盐、甲状旁腺激素片和钙剂等,但因其不同程度的耐药性与不良反应,亟需寻找新的药物改善现状[3]。骨质疏松症归属于中医学“骨痿”“骨枯”“虚劳”范畴。人参为五加科植物人参Panax ginsengC.A.Mey.的干燥根和根茎,《神农本草经》记载:“人参,味甘,微寒。主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智。久服,轻身延年。”崔燎等[4]通过动物实验发现,人参具有显著地防治骨质疏松的药理作用,提出人参可作为雌激素的代用品用于临床各种骨质疏松症的预防和治疗,申请了国家发明专利并获得授权。人参皂苷Rg3是提取自人参的有效活性成分,具有抗肿瘤、抗氧化活性和抗衰老等多种药理作用[5-10]。既往有研究显示,人参皂苷Rg3具有调控骨代谢,促进骨重塑的作用[11]。本研究拟通过对比OP老年大鼠与青年大鼠模型,探讨人参皂苷Rg3对OP老年大鼠骨代谢的影响及其可能的作用机制,旨在为人参临床防治OP及相关药物开发提供参考依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物10只SPF级3月龄雌性SD大鼠,体质量220~250 g,30只23月龄SPF级雌性SD大鼠,体质量550~600 g,购自浙江维通利华实验动物技术有限公司,动物质量合格证号:SCXK(浙)2019-0001。所有大鼠饲养于SPF级环境7 d,环境条件设置为温度20~24℃,湿度(50±10)%,光暗周期为12 h/12 h。普通饲料与清洁水源充足供应。本实验方案已经中国人民解放军总医院第八医学中心伦理委员会批准,伦理号:No20211028KY。
1.2 药物、试剂与仪器人参皂苷Rg3(分子式:C42H72O13,分子量:785.01328),分子结构如图1所示,由上海西格玛奥德里奇贸易有限公司生产,批号:SML0184。Ⅰ型前胶原羧基端前肽(PICP)和骨钙素(BGP)酶联免疫吸附分析(ELISA)试剂盒(上海博湖生物科技有限公司);兔抗βactin多克隆抗体、兔抗大鼠腺苷酸活化蛋白激酶(AMPK)多克隆抗体、兔抗大鼠哺乳动物雷帕霉菌靶蛋白(mTOR)多克隆抗体、兔抗大鼠磷酸化腺苷酸活化蛋白激酶(p-AMPK)多克隆抗体、兔抗大鼠磷酸化哺乳动物雷帕霉菌靶蛋白(p-mTOR)多克隆抗体、兔抗大鼠哺乳动物ATG6同源蛋白(Beclin-1)多克隆抗体和兔抗大鼠微管相关蛋白1轻链3(LC3-Ⅱ)多克隆抗体、山羊抗兔IgG(北京索莱宝科技有限公司)。viva CT40型micro-CT仪器(瑞士SCANCO Medical AG公司);DYY-7C型电泳仪(北京六一仪器厂);ELX-800型多功能酶标仪(美国Bio-Tek公司)。
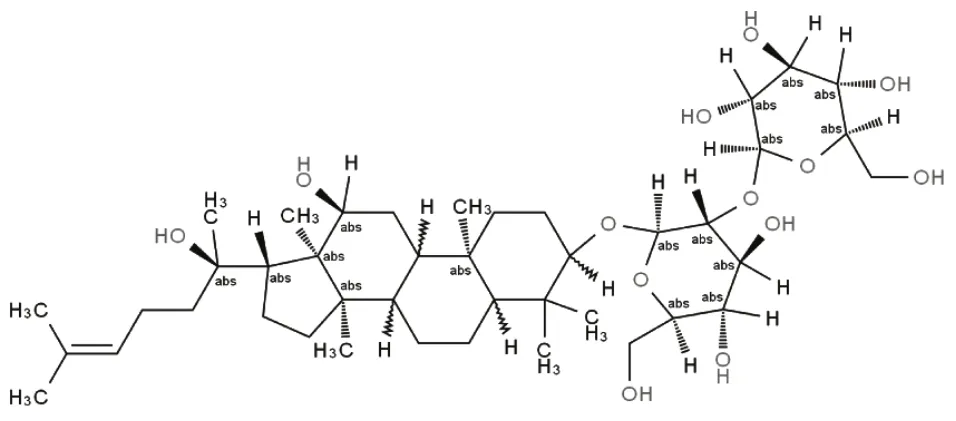
图1 人参皂苷Rg3分子结构Figure 1 Molecular structure of Ginsenoside Rg3
1.3 分组与给药将30只23月龄大鼠随机分为模型组及人参皂苷Rg3低、高剂量组,每组10只,另将10只3月龄大鼠设为对照组。参照文献研究[12-13],人参皂苷Rg3低、高剂量组大鼠给予灌胃10、20 mg/kg人参皂苷Rg3混悬液,对照组及模型组给予灌胃等体积生理盐水,每日1次,连续12周。
1.4 样本采集末次给药后大鼠禁食12 h,腹腔注射戊巴比妥钠麻醉,仰卧位固定于手术台上,腹主动脉采集血液,分离血清,-20℃保存。采血结束后处死大鼠,剥离大鼠股骨,去除周围肌肉等软组织,剪去骨干两端,露出骨髓腔,使用预冷的PBS溶液反复冲洗骨髓腔,并收集冲出的骨髓组织装入无菌冻存管内,-80℃保存备用。取部分股骨冲洗后放入多聚甲醛溶液中进行脱钙、固定。
1.5 观察指标与方法
1.5.1 骨显微参数检测取大鼠股骨样本,使用micro-CT扫描仪检测各组大鼠股骨骨密度(bone mineral density,BMD)和骨体积分数(BV/TV)。仪器调试为分辨率:18 mm;源电流:385 μA;旋转步骤:0.7。再选取股骨远端干骺区域,检测大鼠骨小梁数量(number of trabeculae bone,TB.N)、骨小梁厚度(trabecular bone thickness,TB.Th)和骨小梁分离度(bone trabecular separation,TB.Sp)。
1.5.2 ELISA法检测骨代谢指标PICP、BGP水平取出血清与PICP和BGP ELISA试剂盒,平衡至室温后严格按照试剂盒说明书检测各组大鼠血清中骨代谢指标PICP和BGP水平。应用酶标仪于450 nm波长处测定各组样品吸光度值,根据标准曲线计算样本浓度。
1.5.3 HE染色法观察股骨组织病理变化将已完成脱钙的股骨组织取出,梯度酒精溶液、二甲苯溶液脱水透明,使用石蜡进行包埋,待蜡液完全凝固时修整蜡块,应用组织切片机制成5 μm薄片。将组织切片再次浸入二甲苯、梯度浓度酒精溶液脱蜡复水。浸入苏木素染液5 min,流水冲洗,盐酸酒精溶液分化5 s,氨水返蓝,伊红染液染色1 min,清水冲洗,常规脱水透明,滴加中性树胶封存固片。于光学显微镜下观察股骨组织病理变化并进行分析。
1.5.4 实时荧光定量聚合酶链反应(qRT-PCR)法检测股骨骨髓组织AMPK、mTOR mRNA表达TRIzol法提取股骨骨髓组织总RNA,检测其浓度与纯度后使用逆转录试剂盒合成cDNA。按照试剂盒说明书配制反应体系(20 μL):上、下游引物各0.4 μL,SYBR Premix Ex Tap 10 μL,cDNA 1 μL,RNase free ddH2O 8.2 μL。置于PCR仪器设置参数:95℃30 s,95℃5 s,60℃30 s,收集荧光信号,进行40个循环。以β-actin为内参,采用2-△△CT法计算各样本基因mRNA相对表达水平。引物序列见表1。

表1 PCR引物序列Table 1 PCR primer sequences
1.5.5 Western Blot法检测股骨骨髓组织中p-AMPK、AMPK、p-mTOR、mTOR、Beclin-1和LC3-Ⅱ蛋白表达提前取出裂解液室温下融化,取适量股骨骨髓组织置于研钵内,加入裂解液冰上静置,取上清液后用BCA蛋白试剂盒测定蛋白含量。组装电泳装置,配制聚丙烯酰胺凝胶,进行电泳,恒压80 V电泳2.5 h。300 mA将蛋白转至聚偏氟乙烯(PVDF)膜上。TBST缓冲液加入脱脂牛奶制备封闭液,将膜加入封闭液室温封闭2 h,再分别加入p-AMPK、p-mTOR、Beclin-1和LC3-Ⅱ等一抗(均体积比1∶1 000稀释),4℃孵育过夜。浸入TBST缓冲液中洗膜5 min,反复4次,加入二抗(体积比1∶5 000稀释),室温孵育60 min。洗膜后,加入增强化学发光(ECL)试剂显色后,置于凝胶成像系统上进行成像。以β-actin为内参,采用ImageJ软件分析条带灰度值,以目的蛋白与内参灰度值比值作为目的蛋白的相对表达量。
1.6 统计方法采用SPSS 23.0统计软件分析数据,计量数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠骨密度比较表2结果显示:与对照组比较,模型组大鼠股骨BMD和BV/TV水平降低(P<0.05);与模型组比较,人参皂苷Rg3低、高剂量组大鼠股骨BMD和BV/TV水平升高(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组大鼠股骨BMD和BV/TV水平升高(P<0.05)。
表2 各组大鼠骨密度比较Table 2 Comparison of bone mineral density among various groups of rats (±s)
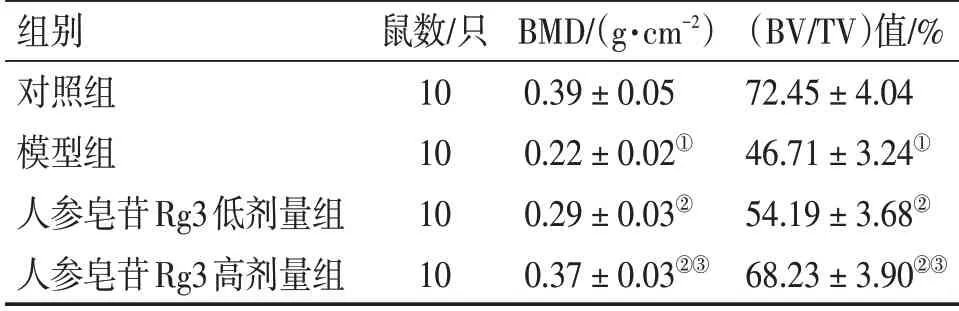
表2 各组大鼠骨密度比较Table 2 Comparison of bone mineral density among various groups of rats (±s)
注:①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与人参皂苷Rg3低剂量组比较
组别对照组模型组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组鼠数/只10 10 10 10 BMD/(g·cm-2)0.39±0.05 0.22±0.02①0.29±0.03②0.37±0.03②③(BV/TV)值/%72.45±4.04 46.71±3.24①54.19±3.68②68.23±3.90②③
2.2 各组大鼠骨形态学指标比较表3结果显示:与对照组比较,模型组大鼠TB.N和TB.Th水平降低,TB.Sp水平升高(P<0.05);与模型组比较,人参皂苷Rg3低、高剂量组大鼠TB.N和TB.Th水平升高,TB.Sp水平降低(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组大鼠TB.N和TB.Th水平升高,TB.Sp水平降低(P<0.05)。
表3 各组大鼠骨形态学指标比较Table 3 Comparison of bone morphological indexes among various groups of rats (±s)

表3 各组大鼠骨形态学指标比较Table 3 Comparison of bone morphological indexes among various groups of rats (±s)
注:①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与人参皂苷Rg3低剂量组比较
组别对照组模型组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组鼠数/只10 10 10 10 TB.N/(个·mm-2)5.40±0.37 3.07±0.26①3.82±0.21②4.69±0.28②③TB.Th/μm 78.44±4.28 46.84±2.62①59.55±2.91②72.53±3.52②③TB.Sp/mm 0.24±0.03 0.38±0.04①0.31±0.03②0.25±0.02②③
2.3 各组大鼠骨代谢指标水平比较表4结果显示:与对照组比较,模型组大鼠血清PICP水平升高,BGP水平降低(P<0.05);与模型组比较,人参皂苷Rg3低、高剂量组大鼠血清PICP水平降低,BGP水平升高(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组大鼠血清PICP水平降低,BGP水平升高(P<0.05)。
表4 各组大鼠骨代谢指标水平比较Table 4 Comparison of levels of bone metabolic markers among various groups of rats(±s,ng·mL-1)
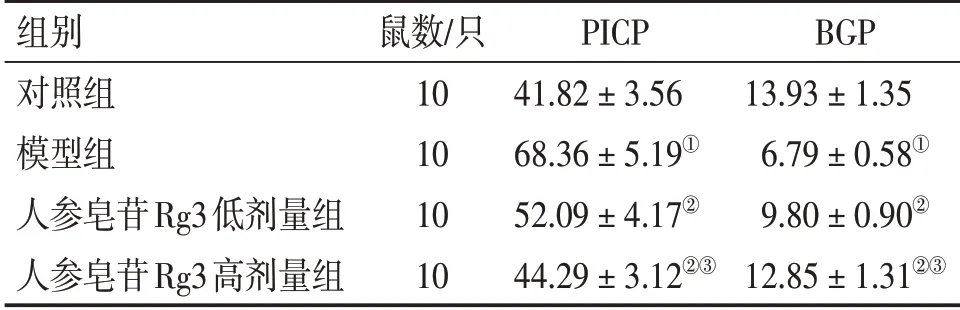
表4 各组大鼠骨代谢指标水平比较Table 4 Comparison of levels of bone metabolic markers among various groups of rats(±s,ng·mL-1)
注:①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与人参皂苷Rg3低剂量组比较
组别对照组模型组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组鼠数/只10 10 10 10 PICP 41.82±3.56 68.36±5.19①52.09±4.17②44.29±3.12②③BGP 13.93±1.35 6.79±0.58①9.80±0.90②12.85±1.31②③
2.4 各组大鼠股骨组织病理学表现比较图2结果显示:与对照组比较,模型组大鼠股骨组织干骺端骨小梁数量明显减少,结构破坏严重,骨小梁稀疏、排列紊乱,骨小梁变薄,间隙变宽,骨髓腔内空洞较多;人参皂苷Rg3低、高剂量组大鼠股骨组织可见骨小梁数量明显增多,结构逐渐恢复正常,骨小梁排列紧密,骨小梁变厚,间隙恢复正常,且骨小梁之间的连接在一定程度上得到改善。
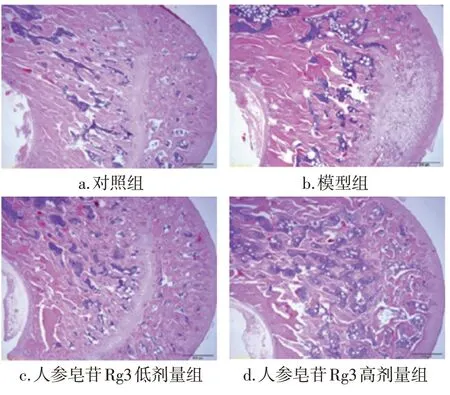
图2 各组大鼠股骨组织病理学表现比较(HE染色,×10)Figure 2 HE staining results of femoral tissue in each group of rats(HE staining,×10)
2.5 各组大鼠股骨骨髓组织AMPK和mTOR mRNA表达比较表5结果显示:与对照组比较,模型组大鼠股骨骨髓组织中AMPK mRNA表达水平降低,mTOR mRNA表达水平升高(P<0.05);与模型组比较,人参皂苷Rg3低、高剂量组大鼠AMPK mRNA表达水平升高,mTOR mRNA表达水平降低(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组大鼠AMPK mRNA表达水平升高,mTOR mRNA表达水平降低(P<0.05)。
表5 各组大鼠股骨骨髓组织AMPK和mTOR mRNA表达水平比较Table 5 Comparison of mRNA expression levels of AMPK and mTOR in femoral bone marrow tissue among various groups of rats (±s)
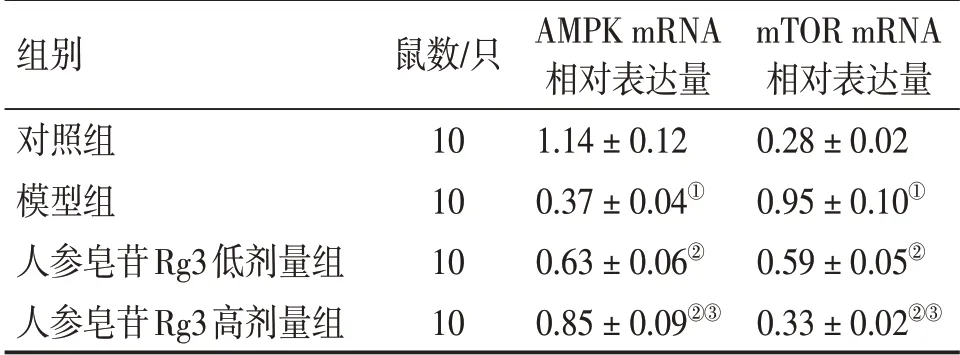
表5 各组大鼠股骨骨髓组织AMPK和mTOR mRNA表达水平比较Table 5 Comparison of mRNA expression levels of AMPK and mTOR in femoral bone marrow tissue among various groups of rats (±s)
注:①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与人参皂苷Rg3低剂量组比较
组别对照组模型组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组鼠数/只10 10 10 10 AMPK mRNA相对表达量1.14±0.12 0.37±0.04①0.63±0.06②0.85±0.09②③mTOR mRNA相对表达量0.28±0.02 0.95±0.10①0.59±0.05②0.33±0.02②③
2.6 各组大鼠股骨骨髓组织AMPK和mTOR活化水平比较表6、图3结果显示:与对照组比较,模型组大鼠股骨骨髓组织中p-AMPK/AMPK比值降低,p-mTOR/mTOR比值升高(P<0.05);与模型组比较,人参皂苷Rg3低、高剂量组大鼠p-AMPK/AMPK比值升高,p-mTOR/mTOR比值降低(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组大鼠p-AMPK/AMPK比值升高,p-mTOR/mTOR比值降低(P<0.05)。
表6 各组大鼠股骨骨髓组织p-AMPK/AMPK、p-mTOR/mTOR比值比较Table 6 Comparison of ratios of p-AMPK/AMPK and p-mTOR/mTOR in femoral bone marrow tissue among various groups of rats (±s)
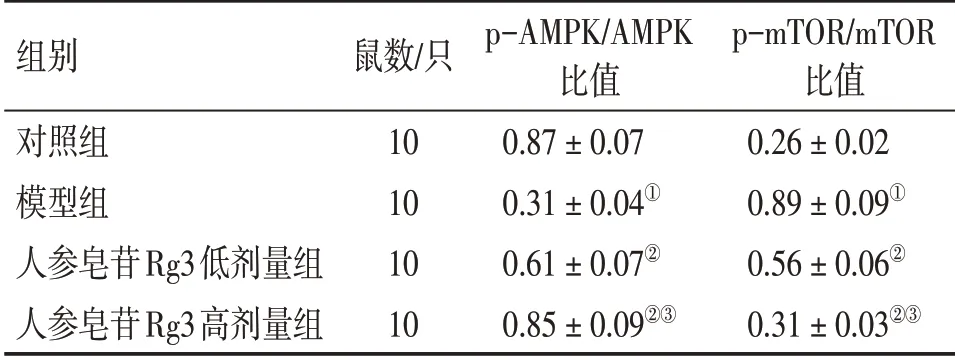
表6 各组大鼠股骨骨髓组织p-AMPK/AMPK、p-mTOR/mTOR比值比较Table 6 Comparison of ratios of p-AMPK/AMPK and p-mTOR/mTOR in femoral bone marrow tissue among various groups of rats (±s)
注:①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与人参皂苷Rg3低剂量组比较
组别对照组模型组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组鼠数/只10 10 10 10 p-AMPK/AMPK比值0.87±0.07 0.31±0.04①0.61±0.07②0.85±0.09②③p-mTOR/mTOR比值0.26±0.02 0.89±0.09①0.56±0.06②0.31±0.03②③
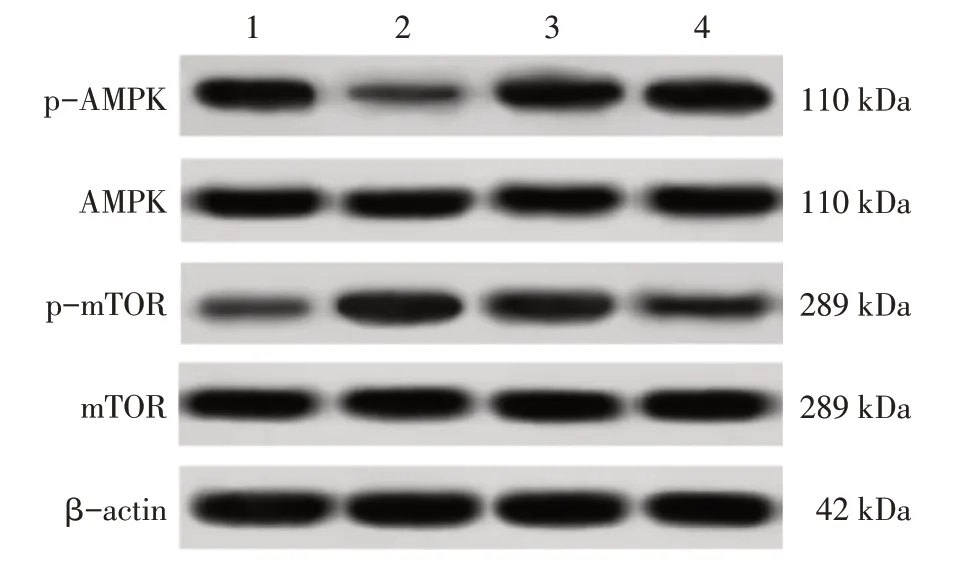
图3 股骨骨髓组织AMPK和mTOR及其磷酸化蛋白Western Blot电泳图Figure 3 Western Blot electrophoretogram of AMPK and mTOR as well as their phosphorylated proteins in femoral bone marrow tissue
2.7 各组大鼠股骨骨髓组织自噬蛋白Beclin-1和LC3-Ⅱ水平比较表7、图4结果显示:与对照组比较,模型组大鼠股骨骨髓组织中Beclin-1和LC3-Ⅱ蛋白表达水平降低(P<0.05);与模型组比较,人参皂苷Rg3低、高剂量组大鼠Beclin-1和LC3-Ⅱ蛋白表达水平升高(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组大鼠Beclin-1和LC3-Ⅱ蛋白表达水平升高(P<0.05)。
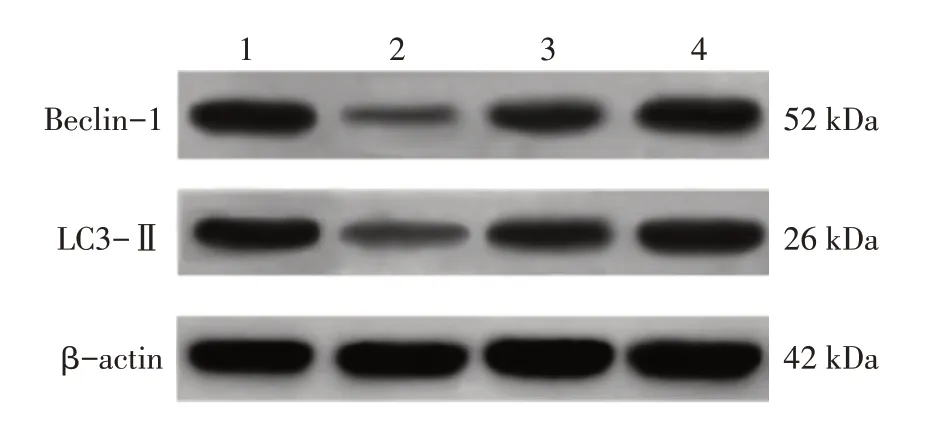
图4 股骨骨髓组织Beclin-1和LC3-Ⅱ蛋白Western Blot电泳图Figure 4 Western Blot electrophoretogram of Beclin-1 and LC3-Ⅱproteins in femoral bone marrow
表7 各组大鼠股骨骨髓组织自噬蛋白Beclin-1和LC3-Ⅱ蛋白表达水平比较Table 7 Comparison of the protein expression levels of the autophagy proteins Beclin-1 and LC3-II in femoral bone marrow tissue among various groups of rats(±s)
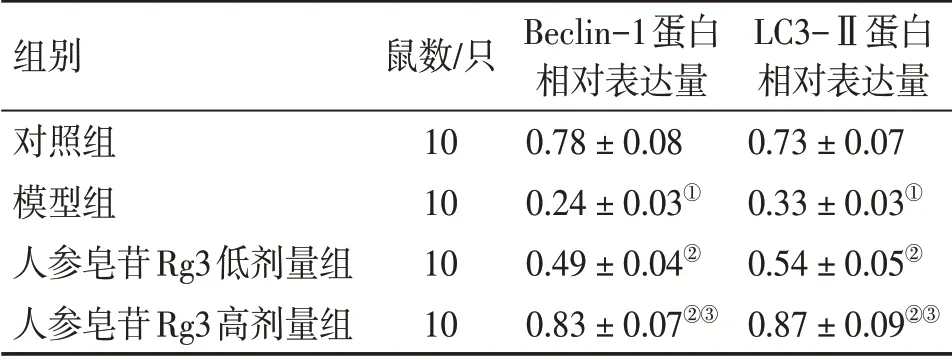
表7 各组大鼠股骨骨髓组织自噬蛋白Beclin-1和LC3-Ⅱ蛋白表达水平比较Table 7 Comparison of the protein expression levels of the autophagy proteins Beclin-1 and LC3-II in femoral bone marrow tissue among various groups of rats(±s)
注:①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与人参皂苷Rg3低剂量组比较
组别对照组模型组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组鼠数/只10 10 10 10 Beclin-1蛋白相对表达量0.78±0.08 0.24±0.03①0.49±0.04②0.83±0.07②③LC3-Ⅱ蛋白相对表达量0.73±0.07 0.33±0.03①0.54±0.05②0.87±0.09②③
3 讨论
随着年龄的增长,受多种因素干扰,骨形成与骨吸收之间平衡失调,导致过多的骨质流失[14]。本研究选用23月龄的雌性大鼠作为研究模型,模拟老年人骨质流失状态,观察人参皂苷Rg3对骨质疏松症(OP)老年大鼠骨密度与骨代谢过程的影响。HE染色结果显示,与对照组青年大鼠比较,模型组老年大鼠结构破坏严重,骨小梁稀疏、排列紊乱,骨小梁变薄,间隙变宽,分离度较高,骨髓腔内空洞较多。micro-CT扫描仪检测发现,模型组老年大鼠股骨组织BMD与BV/TV水平降低,且TB.N和TB.Th水平降低,TB.Sp水平升高,与模型组老年大鼠病理结果相符。表明老年大鼠出现骨质流失情况,骨微结构受到严重破坏,提示OP模型建立成功。给予不同剂量的人参皂苷Rg3治疗后老年大鼠股骨组织BMD和BV/TV水平均呈上升趋势,呈现剂量依赖式,表明人参皂苷Rg3可提升OP老年大鼠骨密度,显著促进OP老年大鼠骨形成。检测大鼠血清中骨代谢指标PICP、BGP水平发现,人参皂苷Rg3低、高剂量组血清PICP水平降低,BGP水平升高。PICP是反映骨转换率的主要标志物,也是公认的骨吸收重要指标;BGP是骨形成指标[15]。表明人参皂苷Rg3可以显著降低老年大鼠的骨胶原代谢水平,使其高转换的状态逐渐降低,并促进骨形成,以保持骨代谢的动态平衡。
自噬是细胞维持稳态的重要机制,细胞通过自噬降解残余蛋白和老化细胞器为其他生理活动提供能量,自噬常被认为是不良刺激和微环境失衡状态下细胞的自我保护过程[16-18]。mTOR蛋白是一种非典型的丝/苏氨酸蛋白激酶,是调控细胞自噬水平的重要通路之一[19]。研究表明,AMPK/mTOR信号通路在骨代谢过程中发挥着重要作用。在参与骨代谢中,mTOR作为AMPK的下游信号因子,受到AMPK水平的调控。在营养不足等应激条件下,AMPK感应到能量状态的改变,进而以磷酸化的形式被激活,负反馈调节下游因子mTOR的活性。p-mTOR作为关键靶蛋白,对自噬水平进行调控[20]。本研究结果显示,模型组老年大鼠股骨骨髓组织AMPK基因与蛋白表达水平均降低,且mTOR基因与蛋白表达水平升高,结合大鼠自噬蛋白Beclin-1和LC3-Ⅱ水平也呈降低趋势,表明OP老年大鼠体内AMPK/mTOR信号通路活性受到影响,自噬水平降低。当给予人参皂苷Rg3治疗后,OP老年大鼠股骨骨髓组织AMPK基因与蛋白表达水平均升高,且mTOR基因与蛋白表达水平降低,自噬蛋白Beclin-1和LC3-Ⅱ水平也逐渐升高,表明人参皂苷Rg3能够调节骨髓组织AMPK/mTOR信号通路,促进骨细胞自噬,发挥积极的OP治疗作用。
综上所述,人参皂苷Rg3能够提高OP老年大鼠骨密度,改善骨微结构,促进骨形成,其机制可能与调节AMPK/mTOR信号通路,提高骨细胞自噬发挥骨保护作用有关。
