铝蜂窝负载锰基催化剂的制备及其在室温下去除低含量甲醛的性能
2023-02-02田景晨吴功德刘雁军王晓丽
田景晨, 吴功德, 刘雁军, 万 杰, 王晓丽, 邓 琳
(1.东南大学 土木工程学院,江苏 南京 211189;2.南京工程学院 能源研究院,江苏 南京 211167)
近年来,随着社会经济发展,室内装修需求不断提高,甲醛污染问题也随之而来。装修过程中使用的胶合板、墙面涂料、纺织皮革用品成为甲醛重要释放源[1-2]。研究发现室内及公共环境中甲醛含量严重超标,新近装修市场甲醛超标率甚至达到86.9%[3-4]。长期接触或生活在甲醛含量超标环境中会严重刺激呼吸系统[5-7],甲醛已经被国际癌症研究机构(IARC)列为1类致癌物质。然而,现阶段室温条件下去除低含量甲醛的技术仍不成熟,因此探究安全高效去除室内低含量甲醛对人们身体健康至关重要。
目前,物理吸附[5-8]、光催化氧化[9-10]、热催化氧化[11-12]等技术已在甲醛去除中显示了一定效果,其中热催化氧化具有高效、稳定、无二次污染等优点,被认为是一种极具开发前景的甲醛去除技术。热催化剂可分为贵金属(Pt[13]、Au[14]、Pb[15]、Ag[16])催化剂和廉价金属(Mn[17]、Cu[18]、Fe[19]、Co[20]等)催化剂。贵金属催化剂表现出优异的甲醛去除性能,可在室温下完全氧化甲醛。通过负载、掺杂金属等改进方法,可进一步提高其催化活性[21-22],但是贵金属催化剂价格昂贵、难以大规模推广。廉价金属催化剂的甲醛去除性能普遍低于贵金属,但其成本低廉、种类多样,备受研究人员的青睐。在廉价金属催化剂中,锰基催化剂是研究较多的一类。Sekine等[13]比较了不同过渡金属氧化物的甲醛去除效果,发现MnO2的甲醛去除性能最优。随后,研究人员使用KMnO4为锰前驱体,通过氧化还原制备了不同K+含量的MnO2(α-、β-、γ-和δ-MnO2),并测试甲醛去除性能,结果表明δ-MnO2具有最高的活性[13,23],这是因为δ-MnO2的二维结构有利于甲醛分子向反应位点扩散和吸附。
一些富含羟基的材料可通过氢键吸附甲醛分子,以之为载体负载锰基催化剂可提高催化活性[11],且Na+、Cs+和K+促进表面羟基形成,有利于提高催化活性[11,24-26]。类水滑石(LDHs)是一种表面富含羟基的碱性材料,广泛应用于吸附[27]、光催化[28]、电催化[29]等领域。Jiang等[30]认为,Ni/Co-LDHs表面丰富的羟基有利于甲醛氧化,表面羟基不仅提高催化剂吸附甲醛的能力,还可与甲醛氧化中间产物甲酸直接反应生成CO2和水。
锰基催化剂的应用受形态限制[31],而有机纤维和金属薄膜可用于负载锰基催化剂以克服上述缺点[32-34],取得了良好效果。因此,首先采用KMnO4为锰前体,使用水热共沉淀法和原位氧化还原法制备了富含羟基的MnOx/Mg3Al1-LDH催化剂,然后将其负载到铝蜂窝上,用于低含量甲醛去除研究,以克服粉末催化剂在应用方面的限制。此外,笔者还探究了MnOx/Mg3Al1-LDHs负载量、风扇功率、反应温度、相对湿度等条件因素对甲醛去除效果的影响。
1 实验部分
1.1 原料和试剂
无水乙醇、氨水、亚甲基纤维素钠、氢氧化钠(NaOH)、三氧化二铝(Al2O3)、二氧化硅(SiO2),国药集团化学试剂有限公司产品;碳酸钠(Na2CO3)、硝酸镁(Mg(NO3)2)、硝酸铝(Al(NO3)3)、甲醛,西陇化工股份有限公司产品;高锰酸钾(KMnO4),上海宏图化学试剂厂产品;所用试剂均为分析纯。水玻璃,西安华昌水玻璃有限公司产品;铝蜂窝,华瑞蜂窝科技有限公司产品。去离子水采用实验室YK-RO-B型超纯水机制得。
1.2 催化剂制备
1.2.1 MnOx/Mg3Al1-LDHs催化剂的制备
采用水热共沉淀法合成了Mg2+/Al3+摩尔比为3/1的Mg3Al1-LDHs作为负载MnOx的载体。具体操作:在搅拌过程中,将120 mL含有0.09 mol Mg(NO3)2和0.03 mol Al(NO3)3的溶液逐步滴加到120 mL 0.05 mol/L Na2CO3溶液中;同时滴加1.0 mol/L NaOH溶液保持pH值在10左右。然后将获得的胶体转移到不锈钢晶化釜中,在100 ℃下老化12 h。最后将沉淀物过滤,用去离子水充分洗涤,并在100 ℃下干燥12 h,即得到Mg3Al1-LDHs载体。
采用原位氧化还原法制备MnOx/Mg3Al1-LDHs催化剂。具体操作:将2 g Mg3Al1-LDHs载体(过200目筛)和0.68 g KMnO4添加到150 mL去离子水中,充分搅拌30 min。随后向上述混合物中加入15 mL浓氨水和20 mL无水乙醇,室温(25 ℃)搅拌2 h后,将沉淀物过滤并用去离子水洗涤,在100 ℃下干燥12 h,即得到MnOx/Mg3Al1-LDHs催化剂样品。
1.2.2 铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的制备
使用水玻璃作为黏结剂将MnOx/Mg3Al1-LDHs催化剂负载到铝蜂窝上。所用铝蜂窝尺寸大小为10 cm×10 cm×3 cm,孔径为3 mm×3 mm。首先将铝蜂窝浸入到0.2 mol/L NaOH溶液中4 min,去除表面污渍和氧化层,随后放入超声波清洗仪中处理30 min,然后在100 ℃下干燥1 h,备用。取2 kg水玻璃并加入质量分数1%亚甲基纤维素钠,搅拌10 h,使其完全分散。将一定质量分数的Al2O3(2%、5%、8%、10%)、MnOx/Mg3Al1-LDHs(1%、2%、5%、10%、15%)和SiO2(2%、5%、8%、10%)分别放入球磨机中,以转速500 r/min研磨1 h,使各组分充分混合。最后将混合粉末加入到上述含有亚甲基纤维素钠(质量分数1%)的水玻璃中,搅拌2 h后,即得到浆料。将预处理后的铝蜂窝完全浸泡在浆料中,30 s后迅速提出,然后使用气枪吹去表面多余浆料避免孔堵塞,之后于120 ℃加热固化4 h,重复此过程3次,即得到整体式催化材料——铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂样品。浆料中Al2O3、SiO2、亚甲基纤维素钠质量分数均为1%,MnOx/Mg3Al1-LDHs催化剂设计质量分数分别为1%、2%、5%、10%、15%时,所制备的铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂中的实际测量质量分数分别为1.38%、2.62%、6.48%、12.24%、17.36%。
1.3 催化剂的分析表征
采用北京彼奥德电子技术有限公司生产的Kubo-x-1000型比表面积和孔径分析仪测试催化剂样品的比表面积;采用日本ULVAC-PHI公司生产的PHI5000 VersaProbe型X射线光电子能谱仪进行催化剂样品元素分析;采用美国TA仪器公司生产的Q600SDT型热差分析仪进行催化剂样品热重分析;采用德国Bruker公司生产的Bruker TENSOR 27型傅里叶变换红外光谱仪和美国赛默飞世尔科技有限公司生产的X′TRA型固体X射线衍射仪分析催化剂样品的晶体结构和组成;采用美国INTERSCAN公司生产的4160-19.99 m型甲醛分析仪检测甲醛含量。
1.4 甲醛去除测试实验
在1 m3反应舱内对铝蜂窝负载MnOx/Mg3Al1-LDHs进行甲醛去除测试。将大小为10 cm×10 cm×3 cm的复合铝蜂窝放入反应舱内,关闭舱门,然后使用干燥器将反应舱内相对湿度降至30%以下,随后用注射去离子水的方法控制舱内湿度在60%左右。湿度稳定后,使用微量进样针向反应舱内注射12 μL甲醛溶液(质量分数38%),开启风扇使甲醛完全挥发,使反应舱内甲醛质量浓度约为1.3 mg/m3。
为研究实验中各因素对于甲醛去除效果的影响,改变实验条件后分别进行实验测试,其中Al2O3质量分数为2%~10%,SiO2质量分数为2%~10%,MnOx/Mg3Al-LDHs负载质量分数为1%~5%,风扇功率为5~20 W,反应温度为10~60 ℃,相对湿度为30%~90%。
为测试催化剂稳定性,将催化剂循环8次进行实验(反应温度25 ℃,相对湿度60%)及连续15 d使用(反应温度27.8~31 ℃,相对湿度65%~87%),通过称量催化剂质量变化和催化剂效果分析其稳定性。
2 结果与讨论
2.1 MnOx/Mg3Al1-LDHs催化剂表征结果
图1(a)为MnOx/Mg3Al1-LDH催化剂的XRD谱图。由图1(a)可以看出,所制备的MnOx/Mg3Al1-LDHs具有典型的类水滑石(JCPDS Card 35-0965)结构。2θ为 11.01°、22.86°、34.73°、38.64°、59.96°和61.12°的特征衍射峰可以归因于类水滑石的(003)、(006)、(012)、(015)、(110)和(113)晶面[35],表明在该研究中成功制备了具有类水滑石结构的MnOx/Mg3Al1-LDHs。图1中显示MnOx的主要成分是δ-MnO2(JCPDS Card 80-1094)和Mn3O4(JCPDS Card 01-1127)[36]。2θ为 40.02°和64.57°处的衍射峰可以确定为δ-MnO2的(201)和(310)晶面,而2θ为44.61°处的峰可归因于Mn3O4的(220)晶面,这证明MnOx/Mg3Al1-LDHs中的MnOx是δ-MnO2和Mn3O4的混合物。值得注意的是,MnOx
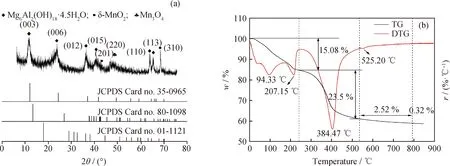
图1 MnOx/Mg3Al1-LDHs催化剂的XRD谱图和TG曲线Fig.1 XRD patterns and TG curves of MnOx/Mg3Al1-LDHs catalyst(a) XRD; (b) TG
的衍射峰均较弱,可能是由于δ-MnO2和Mn3O4高度分散和结晶度差所致[11]。
MnOx/Mg3Al1-LDHs催化剂的TG和DTG曲 线如图1(b)所示。由图1(b)可以看出,MnOx/MgAl-LDHs的质量损失可分为3个阶段:吸附水和结合水脱除阶段、脱羟基脱碳酸根阶段、δ-MnO2转化阶段。MnOx/Mg3Al1-LDHs催化剂中的吸附水和结合水在207 ℃完全去除,相应质量损失为15.1%;加热温度为384 ℃时,Mg3Al1-LDHs中的羟基和层板间的碳酸根转变为水和CO2逸出,相应质量损失为23.5%。吸附水结合水脱除阶段和脱羟基脱碳酸根阶段的质量损失超过了30%,表明MnOx/Mg3Al1-LDHs催化剂中含有大量的羟基。温度在500~750 ℃时MnOx/Mg3Al1-LDHs表面的δ-MnO2转变为Mn2O3,相应质量损失为2.5%;温度超过750 ℃后Mn2O3转变为Mn3O4[36],经实验结果计算相应的质量损失为0.3%。
图2为MnOx/Mg3Al1-LDHs催化剂的FT-IR谱图。由图2可见:3465 cm-1附近的宽峰归属于类水滑石吸附水和层板中—OH的伸缩振动[36-38];1638 cm-1附近的红外吸收峰由—OH弯曲振动引起[39-40];在1375 cm-1处的尖锐吸收峰为碳酸根中C—O键的伸缩振动所致,表明成功合成了碳酸根插层的类水滑石。2355 cm-1处的吸收峰归因于吸附在MnOx/Mg3Al1-LDHs表面的CO2。

图2 MnOx/Mg3Al1-LDHs催化剂的FT-IR谱图Fig.2 FT-IR spectrogram of MnOx/Mg3Al1-LDHs catalyst
图3为MnOx/Mg3Al1-LDHs催化剂的N2吸附-脱附曲线和孔径分布。使用BET法计算得到MnOx/Mg3Al1-LDHs的比表面积为25.7 m2/g。
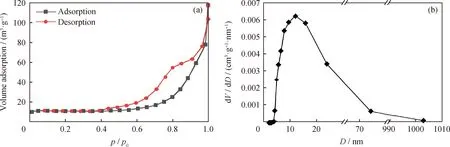
图3 MnOx/Mg3Al1-LDHs催化剂的N2吸附-脱附曲线和孔径(D)分布Fig.3 N2 adsorption-desorption curve and pore diameter (D) distribution of MnOx/Mg3Al1-LDHs catalyst(a) N2 adsorption-desorption curve; (b) Pore diameter distribution
由图3(a)可见,N2吸附-脱附曲线存在明显迟滞环,是典型的Ⅳ型吸附-脱附曲线,具有介孔(2~50 nm)结构。由图3(b)可见,MnOx/Mg3Al1-LDHs中孔径分布主要集中于6~24 nm。
MnOx/Mg3Al1-LDHs催化剂表面Mn价态分布如图4所示,其主要元素含量和结合能如表1所示。由图4(b)可以看出,Mn 2p峰经过拟合可得到2个子峰,结合能分别为641.12 eV和642.10 eV,分别对应Mn3+和Mn4+[41-42]。通过计算两峰面积得到Mn3+和Mn4+的占比为0.25和0.75,Mn4+含量远高于Mn3+。大量Mn4+可提供丰富的反应活性位点,有利于甲醛催化氧化[43]。结合图4(c)中两峰位置,根据经验公式:AOS=8.956-1.126ΔE3s(AOS为平均氧化态;ΔE3s为图4(c)中Mn 3s两峰结合能差值,eV),计算得到Mn的平均氧化态为3.86,进一步表明Mn4+含量高于Mn3+[44]。图4(d)为MnOx/Mg3Al1-LDHs催化剂的O 1s轨道谱图。结合能529.81、531.45 和532.07 eV对应的峰分别归属于表面晶格氧(Olatt)、表面吸附氧(Oads)和表面羟基氧(OOH),其峰面积占比为0.30、0.23和0.47[45-46]。
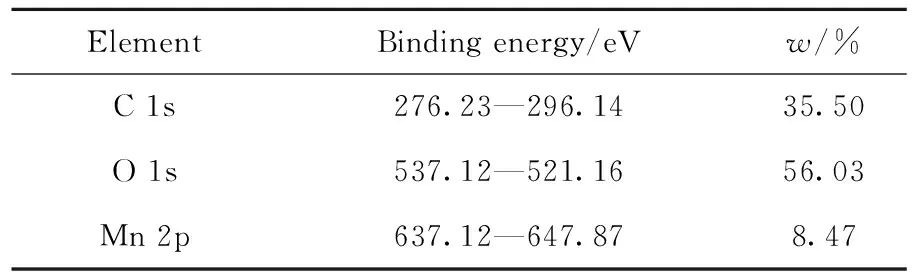
表1 MnOx/Mg3Al1-LDHs催化剂表面元素结合能和含量Table 1 Element content and binding energy of MnOx/Mg3Al1-LDHs catalyst

图4 MnOx/Mg3Al1-LDHs催化剂的XPS谱图Fig.4 XPS spectra of MnOx/Mg3Al1-LDHs catalyst(a) Total survey scans; (b) Mn 2p; (c) Mn 3s; (d) O 1s
表面羟基氧占比远高于表面吸附氧和表面晶格氧,表明MnOx/Mg3Al1-LDHs具有较多的羟基,这有利于吸附甲醛分子。此外,表面吸附氧的摩尔分数超过了20%,表明MnOx/Mg3Al1-LDHs表面存在丰富的活性氧(O-、O2-)。
2.2 不同影响因素对MnOx/Mg3Al1-LDHs催化剂甲醛去除效果的影响
2.2.1 Al2O3和SiO2含量对甲醛去除效果的影响
图5为Al2O3和SiO2对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂甲醛去除效果的影响。由图5(a)可见,经过4 h反应, Al2O3质量分数分别为2%、5%、8%和10%时的舱内甲醛质量浓度从1.3 mg/m3分别下降到0.39、0.42、0.42和0.37 mg/m3,较为接近,表明Al2O3含量对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除活性影响较小。
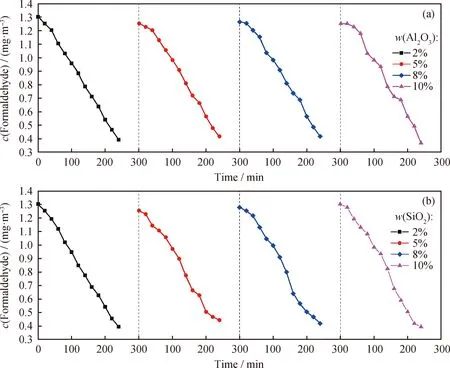
图5 Al2O3和SiO2含量对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂甲醛去除效果的影响Fig.5 Effect of Al2O3 and SiO2 content on formaldehyde removal using MnOx/Mg3Al1-LDHs catalyst supported by aluminum honeycomb(a) w(Al2O3); (b) w(SiO2)Conditions: w(MnOx/Mg3Al1-LDHs)=1%; Relative humidity 60%; T=25 ℃
由图5(b)可知,经过4 h反应后,SiO2质量分数分别为2%、5%、8%、10%时,甲醛质量浓度分别为0.39、0.44、0.42和0.39 mg/m3,相差较小,表明SiO2含量对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除活性影响较小。
2.2.2 MnOx/Mg3Al1-LDHs催化剂用量对甲醛去除效果的影响
图6为不同MnOx/Mg3Al1-LDHs催化剂用量对甲醛去除效果的影响。由图6可以看出:浆料中MnOx/Mg3Al1-LDHs质量分数为1%、2%和5%时,经过4 h反应后甲醛质量浓度从1.3 mg/m3分别下降到0.42、0.16和0.09 mg/m3;且随着MnOx/Mg3Al1-LDHs含量的增加,甲醛去除效果有较大的提高。但当MnOx/Mg3Al1-LDHs质量分数超过5%时,甲醛去除效果的提升幅度减小。因此,考虑到成本和去除效果的平衡,选择MnOx/Mg3Al1-LDHs用量为质量分数5%较为合适。
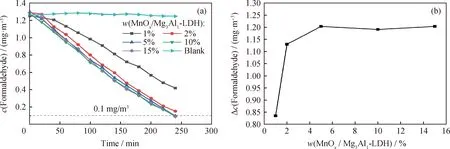
图6 MnOx/Mg3Al1-LDHs用量对甲醛去除效果的影响Fig.6 Effect of MnOx/Mg3Al1-LDH content on formaldehyde removal(a) c(Formaldehyde) vs.w(MnOx/Mg3Al1-LDH); (b) Δc(Formaldehyde) vs. w(MnOx/Mg3Al1-LDH)Conditions: Relative humidity 60%; T=25 ℃; w(Al2O3)=1%; w(SiO2)=1%
2.2.3 风扇功率对甲醛去除效果的影响
通过改变风扇的输入电压调节功率为5、8、10、12、15和20 W,考察风机功率对甲醛去除效果的影响如图7所示。由图7可以看出:当风扇功率分别为5、8、10 W时,反应4 h后舱内甲醛质量浓度分别降至0.15、0.11和0.09 mg/m3;且随着风扇功率提高,铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除效果提升较快。当风扇功率大于10 W后,甲醛含量基本保持不变,表明风扇功率对甲醛去除效果有一定程度的影响,但不是关键因素。考虑能耗等因素,选择风扇功率为10 W较为合适。
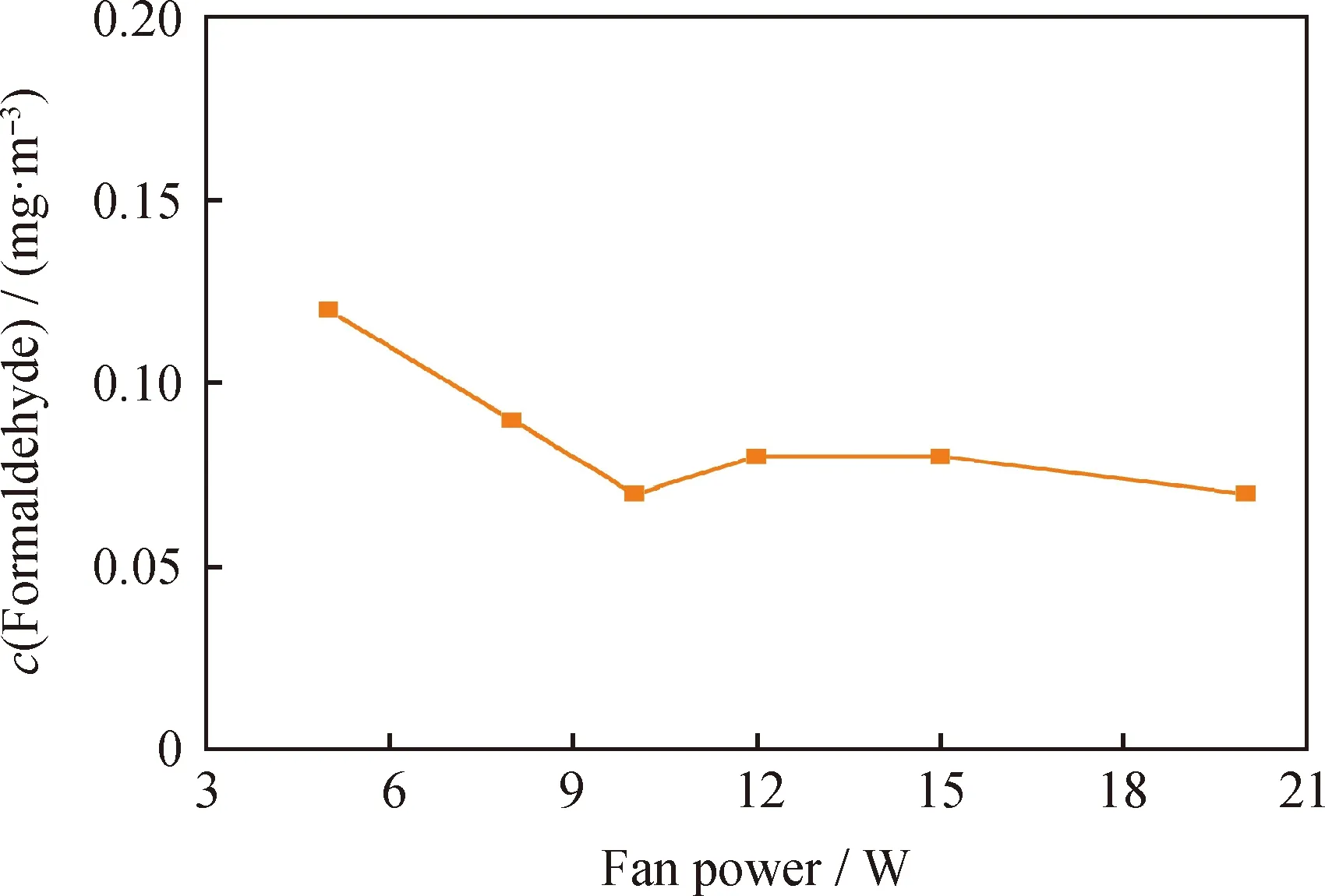
图7 风机功率对甲醛去除效果的影响Fig.7 Effect of fan power on formaldehyde removalConditions: Relative humidity 60%; T=25 ℃; t=4 h
2.2.4 反应温度对甲醛去除效果的影响
反应温度对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂甲醛去除效果的影响如图8所示。由图8可知,反应温度对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除有显著影响,催化剂对甲醛去除效果随着反应温度升高而提升。当反应温度分别为10、20、30、40、50和60 ℃时,经4 h反应后舱内甲醛质量浓度分别降至0.39、0.26、0.18、0.09、0.07和0.05 mg/m3。反应温度从10 ℃升至30 ℃时,甲醛去除效果提升较快;但随着反应温度进一步提高,甲醛去除效果提升幅度减小,推测可能原因是反应舱内甲醛含量较低导致与铝蜂窝负载MnOx/Mg3Al1-LDHs的接触不足造成的。
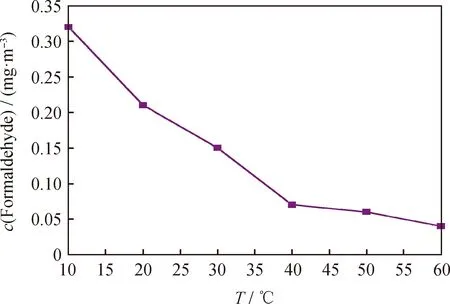
图8 反应温度(T)对甲醛去除效果的影响Fig.8 Effect of reaction temperature (T) on formaldehyde removalConditions: Relative humidity 60%; t=4 h
2.2.5 相对湿度对甲醛去除效果的影响
空气中水含量对催化剂的甲醛氧化效果有重要影响。吸附在催化剂上的水分子可以和表面活性氧(O2-、O-)结合形成活性羟基,参与到甲醛氧化过程,并不断补充反应过程中消耗的表面羟基,保证高效催化活性[30,47]。但是水分子会和甲醛分子竞争催化活性中心,过量的水分会引起甲醛去除活性下降[30,39,47]。相对湿度变化对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除效果的影响如图9所示。
反应舱内的相对湿度分别控制为30%、60%、80%、90%时,反应温度为室温(25 ℃),经过4 h反应后,甲醛质量浓度分别下降至0.10、0.09、0.09、0.07 mg/m3,表明相对湿度变化没有明显改变铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除效果,推测可能原因是由于MnOx/Mg3Al1-LDHs中富含水分子,外加水分子对其去除甲醛性能的影响不大。
2.2.6 铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂甲醛去除稳定性测试结果
铝蜂窝负载MnOx/Mg3Al1-LDHs每次使用后,在120 ℃下加热4 h,使表面吸附的甲醛完全氧化脱附下来,以恢复甲醛去除活性。表2为铝蜂窝负载MnOx/Mg3Al1-LDHs重复次数和甲醛去除效果的关系。经过8次使用,该铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂的甲醛去除效果没有发生明显变化。MnOx/Mg3Al1-LDHs催化剂质量仅减少0.06 g,质量损失率为0.39%,催化剂在多次循环过程中质量损失较小,表明其具有优异的多次重复使用性和稳定性。
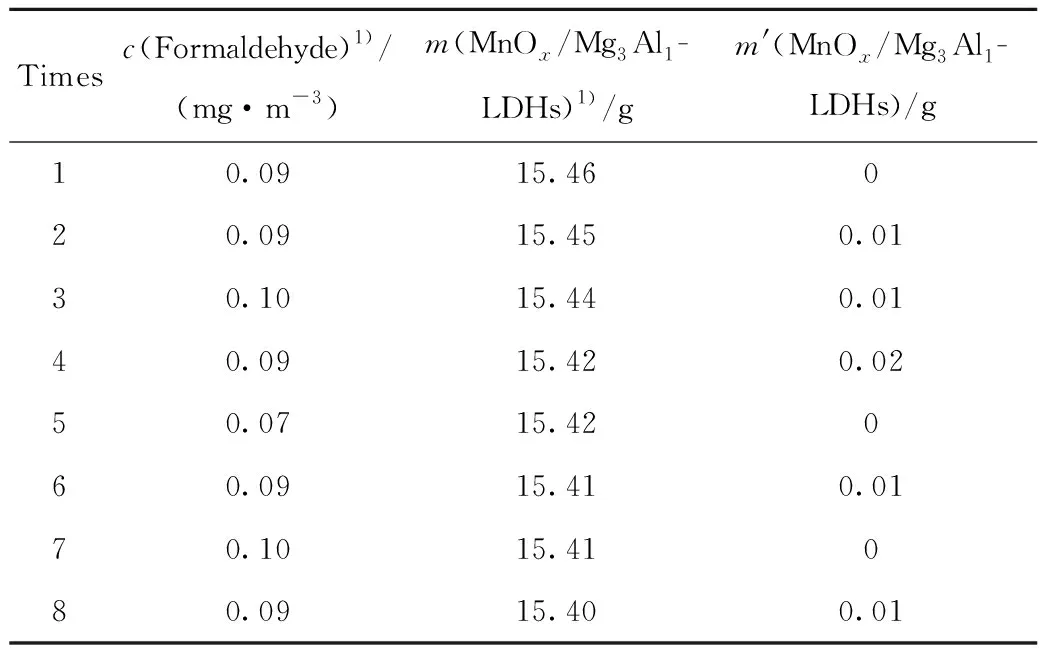
表2 铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂甲醛去除的重复使用效果及该催化剂的损失质量(m′)Table 2 Effect of repeated use of MnOx/Mg3Al1-LDHs catalyst supported by aluminum honeycomb for formaldehyde removal and the catalyst′s mass loss (m′)
为了测试铝蜂窝负载MnOx/Mg3Al1-LDHs的甲醛实际去除效果,对其进行连续15 d实际测试,结果如表3所示。尽管在测试时间内温度、湿度变化较大,但是铝蜂窝负载MnOx/Mg3Al1-LDHs仍然具有优异的甲醛去除效果。

表3 铝蜂窝负载MnOx/Mg3Al1-LDHs连续15 d的甲醛去除效果Table 3 Formaldehyde removal performance of MnOx/Mg3Al1-LDHs supported by aluminum honeycomb for 15 consecutive days
3 结 论
采用水热共沉淀法合成了Mg3Al1-LDHs,并通过KMnO4和无水乙醇的原位氧化还原反应将MnOx和Mg3Al1-LDH结合,制备出了MnOx/Mg3Al1-LDHs催化剂和铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂,探究了其在甲醛去除中的应用效果。结论如下:
(1)XRD和FT-IR表征结果显示,MnOx/Mg3Al1-LDHs表现出了典型的类水滑石结构,催化剂表面的MnOx为δ-MnO2和Mn3O4的混合物,且结晶度较差。XPS分析结果表明,MnOx/Mg3Al1-LDHs中具有高比例的Mn4+/Mn3+和丰富的吸附氧,其平均氧化态可达到3.86,较多的Mn4+为甲醛反应提供了大量活性位点。O 1s的分峰结果也表明MnOx/Mg3Al1-LDHs中具有大量结合水和羟基,为甲醛去除提供了有利条件。
(2)Al2O3含量和SiO2含量对铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂甲醛去除效果影响不大;催化剂用量和风扇功率会一定程度提高铝蜂窝负载MnOx/Mg3Al1-LDHs的甲醛去除效果,最佳MnOx/Mg3Al1-LDHs用量为5%(质量分数),最佳风扇功率为10 W;空气中湿度变化对甲醛去除效果的影响较小,表明该催化剂具有较强的水分抵抗能力;反应温度提升会较大程度提高甲醛去除效果,但由于反应后甲醛含量较低,提升效果降低。
(3)铝蜂窝负载MnOx/Mg3Al1-LDHs催化剂具有较高的甲醛去除效果,在室温(25 ℃)、相对湿度60%、反应时间4 h条件下,可将甲醛质量浓度由1.3 mg/m3降至0.10 mg/m3以下。
