MicroRNA-122-5P通过靶向MMP-9抑制TPA诱导的SW480细胞侵袭迁移能力
2023-02-01张丽君姜卓言谢海娟俞红女
张丽君, 石 皓, 姜卓言, 谢海娟, 王 林, 俞红女
(1.大连大学附属新华医院, 辽宁 大连 116021 2.山东省曹县市人民医院肿瘤科, 山东 曹县 274400)
结直肠癌(Colorectal cancer,CRC)是中国第五位常见恶性肿瘤,其病死率排恶性肿瘤第二[1],40%~50%的结直肠癌患者死于远处转移[2]。而侵袭是转移形成最重要的一步,MMP-9是最复杂的基质金属蛋白酶(matrix metal proteinases,MMPs)之一,可促进侵袭其他组织从而引起转移[3],因此抑制MMP-9的表达和/或调节上游活性可能是一种潜在的治疗策略。有研究发现佛波酯(TPA)身为一种肿瘤促进剂,可诱导多种肿瘤MMP-9激活和侵袭迁移的发生[4,5]。近年来发现微小RNA(microRNA,miRNA)可以通过与靶基因3'非编码区互补结合抑制癌基因或作为肿瘤启动子进而参与癌症过程[6,7]。同时可作为重要的生物调节因子,调节细胞增殖,凋亡,癌症进展和肿瘤发生[8]。利用生物信息学分析显示MMP-9在结直肠癌中高表达,并且与miR-122-5p存在连接位点。但目前关于 miR-122-5p 在结直肠癌中的研究仍然很少,因此本实验旨在探究miR-122-5p能否靶向MMP-9逆转TPA引起的结直肠癌肿瘤细胞侵袭转移,并分析其潜在的作用方式。
1 材料与方法
1.1实验材料:人结直肠癌SW480细胞购买于中科院;胎牛血清和DMEM培养基分别购于上海生工BBI公司和美国Gibco公司; qPCR所用Evo M-MLV反转录试剂盒Ⅱ和SYBR Green预混型qPCR试剂盒购自艾科瑞生物工程有限公司;转染所用GP-transfect-Mate转染试剂和RNA oligo试剂购自苏州吉玛基因;免疫印迹法所需细胞裂解液和山羊抗兔IgG抗体购自美国Thermo Fisher Scientific 公司、MMP-9抗体购自Santa Cruz 公司、GAPDH抗体购自Bioworld 公司、ECL发光试剂购自生工生物工程(上海)股份有限公司;明胶酶谱实验所使用酶谱显色缓冲液购自北京天恩泽基因科技有限公司;Transwell实验所需Matrigel基底胶和0.1%结晶紫染色液均购自北京索莱宝科技有限公司、Transwell小室购自美国 Corning 公司;实验用药佛波酯TPA购自美国 Sigma 公司。
1.2生物信息学分析:通过GEO2R(https://www.ncbi.nlm.nih.gov/geo/)数据库筛选结直肠癌差异表达基因,利用GEPIA(http://gepia.cancer-pku.cn/detail.php)数据库验证差异基因在结直肠癌患者较正常的表达情况,根据差异基因结合miRWalk (http://mirwalk.umm.uni-heidelberg.de/) 数据库预测靶向miRNA,最后通过TargetScan (https://www.targetscan.org/vert_71/) 数据库预测结合位点。
1.3实验方法
1.3.1细胞培养:人结直肠癌SW480细胞培养在90%DMEM和10%FBS配置成的完全培养基,放于37℃、体积分数为5%CO2细胞培养箱中,以1∶3进行传代培养。取对数生长期的SW480细胞接种于六孔板中,待细胞贴壁后用TPA(100nM)处理不同时间(0,6,12,24h),通过RT-qPCR和Western blot法检测TPA对SW480细胞MMP-9表达的影响。细胞生长至60%~80%时利用GP-transfect-Mate对SW480细胞进行转染,分组如下:阴性对照NC组、NC+TPA组、转染miR-122-5p minics(minic组)和minic+TPA组。细胞转染后用含有TPA(100nM)的完全培养基培养。
1.3.2RT-qPCR 检测细胞MMP-9与miR-122-5p表达水平:采用Trizol法从处理好的SW480细胞提取总RNA,进一步使用Evo M-MLV反转录试剂盒Ⅱ进行反转录得到cDNA,保存于-20℃。PCR扩增时对cDNA稀释5倍使用,根据SYBR Green预混型qPCR试剂盒说明书添加荧光,使用引物序列见表1。

表1 qPCR引物序列
1.3.3miRNA minics 转染:将处于对数生长期的SW480细胞进行铺板(ρ=1.7×105/孔),培养18h细胞密度达到60%~80%时,按照GP-transfect-Mate转染试剂和RNA oligo试剂说明书要求进行转染。置于培养箱中,4~6h将细胞液换成含10%FBS新鲜完全培养基,24h检测mRNA表达或检测蛋白表达。转染RNA oligo合成序列见表2。

表2 转染RNA oligo 合成序列
1.3.4免疫蛋白印迹试验:收集所需细胞用配置好的细胞裂解液进行裂解提取蛋白,采用BCA法绘制标准曲线和实现蛋白定量,在保证浓度一致的前提下调整各个样品的体积进行蛋白变性制样,于-80℃保存。分别配制使用了浓度10%与12%的分离胶与浓缩胶,上样后按照电泳、转膜、封闭、洗膜、孵育MMP-9抗体和GAPDH抗体4℃过夜、洗膜后室温孵育山羊抗兔IgG抗体,最后用ECL发光试剂进行显影,结果图像使用ImageJ软件分析和计算灰度值。
1.3.5明胶酶谱实验:将处理后的细胞收集并完成制样,配制浓度10%分离胶与浓缩胶,凝固每孔上样15ul,以60v,30min转100v,60min完成电泳后,依据酶谱显色缓冲液说明书孵育过夜,0.05%R-250考马斯亮蓝染色液染色,最后使用UVP凝胶成像系统观察拍照,ImageJ软件进行灰度值计算。
1.3.6Transwell 实验检测细胞侵袭和迁移:进行迁移实验时直接将细胞悬液(ρ=2×105个/小室)放到小室;进行侵袭实验时取30μL Matrigel基底胶稀释液均匀铺满Transwell小室,置于培养箱2h后更换培养基,将细胞悬液(ρ=3×105个/小室)加到小室。根据实验设计给需要佛波酯TPA处理的组别在上下室加入TPA,使终浓度为100nM。24h后5%多聚甲醛固定,0.1%结晶紫染色液染色,在倒置显微镜下观察与拍照,最后使用ImageJ软件计数穿膜细胞数。
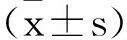
2 结 果
2.1生物信息学分析MMP-9在结直肠癌组织中的表达情况:通过GEO2R数据库找到结直肠癌相关数据集(GSE77199、GSE141174、SGE38026),以P<0.05,LogFC>1.0为筛选条件,进行数据合集(如图1A),得到差异表达基因4个(MMP-9、PDGFRB、TGM2、UBD)。借助TCGA数据库初步筛查发现MMP-9在结直肠癌组织中较正常高表达(*P<0.05),如(图1B)。

图1 生物信息学分析MMP-9在结肠癌组织中的表达A:结直肠癌差异表达Veen图;B: MMP-9在结直肠癌中高表达注:与正常组织(N)相比,*P<0.05
2.2生物信息学筛选MMP-9的靶基因miRNA:通过GEO2R筛选结直肠癌差异表达miRNA,选取数据集GSE85589、GSE125904差异表达miRNA,按照条件(P<0.05,logFC >1.0)进行筛选。同时,借助靶点预测数据库miRWalk得到MMP-9存在连接位点(score=1.0)的miRNAs进行合集得到其靶基因为has-miR-122-5p(如图2A)。随后,通过Targetscan数据库预测两者的连接位点(如图2B)所示。

图2 生物信息学数据库预测MMP-9靶基因miRNAA:结直肠癌差异表达miRNA Veen图; B: miR-122-5p 和 MMP-9 mRNA 3'-UTR 的结合位点
2.3TPA 对结直肠癌SW480 细胞MMP-9 表达的影响:TPA(100nmoL /L)处理 SW480 细胞不同时间(0,6,12,24h),利用RT-PCR 法检测细胞中 MMP-9 mRNA的表达水平,结果(如图 3)所示,TPA 诱导 SW480 细胞 MMP-9mRNA表达显著上调,呈时间依赖性,24h 时增加最为明显(** P<0.01)。

图3 MMP-9 mRNA的相对表达注:与0h相比,** P<0.01
2.4TPA 对结直肠癌SW480 细胞miR-122-5p 表达的影响:观察TPA(100nM) 诱导 MMP-9 表达上调过程中对miR-122-5p 表达的影响,结果(如图4)所示,与空白对照组相比较,TPA 处理组 miR-122-5p 表达水平明显降低(** P<0.01)。

图4 TPA影响SW480细胞miR-122-5p的表达注:与Control组相比,** P<0.01
2.5MiR-122-5p 对SW480 细胞MMP-9 表达的影响
2.5.1过表达 miR-122-5p 的细胞模型建立 :观察miR-122-5p 在结直肠癌SW480 中的生物效应,将miR-122-5p minic 及NC 在SW480 细胞中进行转染,结果(如图 5)所示,Control 组与 NC 组间无统计学差异(P>0.05)。miR-122-5p minic 在结直肠癌 SW480 细胞中转染成功(**P<0.01)。

图5 SW480细胞转染 miR-122-5p minic 后 miR-122-5p 表达水平:与Control组相比,** P<0.01
2.5.2MiR-122-5p 对 TPA 诱导 SW480 细胞 MMP-9 表达及分泌的作用 :利用 RT-qPCR 和 Western blot进一步观察 miR-122-5p 对 MMP-9 的调控作用,结果(如图 6)所示,与 NC 组相比,NC+TPA 组MMP-9表达显著上调(**P<0.01);与 NC+TPA 组相比,过表达 miR-122-5p 的 minic+TPA 组 MMP-9 表达明显下降(# P<0.05,##P<0.01);明胶酶谱法结果显示过表达 miR-122-5p明显抑制 TPA 诱导的 MMP-9 分泌。

图6 MiR-122-5p 影响 TPA 诱导 SW480 细胞 MMP-9 的表达A:MMP-9 mRNA 表达水平;B: MMP-9 蛋白表达情况及定量柱状图注:与NC组相比,** P<0.01;与NC+TPA组相比,A:# P<0.05,B:## P<0.01
2.6MiR-122-5p 对TPA 诱导SW480 细胞侵袭和迁移能力的影响:采用 Transwell检测NC组、NC+TPA组、minic+TPA组和minic组细胞穿膜细胞数目,观察细胞的侵袭与迁移能力,结果(如图7-8)所示,与NC 组相比,NC+TPA 组侵袭和迁移细胞数目均显著增多(**P<0.01);与 NC+TPA 组相比,过表达miR-122-5p 的 minic+TPA 组细胞侵袭和迁移数目明显减少(## P<0.01)。。

图7 各组 SW480 细胞侵袭能力及其定量分析(×200)

图8 各组 SW480 细胞迁移能力及其定量分析(×200)注:与NC 组相比,(** P<0.01);与 NC+TPA 组相比,(## P<0.01)
3 讨 论
结直肠癌为最常见癌症之一,研究显示,肿瘤转移仍然是致死的主因,因此抑制癌细胞侵袭和迁移的研究具有重要意义。MMP-9 是研究最广泛的 MMP 之一,主要由肿瘤细胞和基质细胞分泌,激活的 MMP-9影响 BMs 阻碍肿瘤细胞运动的能力,因此在肿瘤发展过程中,基底膜的破坏是支持肿瘤侵袭和迁移的重要步骤[9]。目前文献研究显示,MMP-9 在不同恶性肿瘤中均有过表达,并且被证明与包括结直肠癌在内的肿瘤的进展和侵袭有关[10]。因此,抑制 MMP-9 的过表达是防治肿瘤侵袭转移的重要策略。据报道,许多刺激因子,如肿瘤坏死因子-α、成纤维细胞生长因子-2 和 TPA 均可诱导MMP-9 过表达[11]。佛波酯(TPA)是从巴豆油中分离出一个经典的肿瘤促进剂,被认为是 PKC 依赖的多种信号通路的有效诱导剂,即 PKC 激活剂。蛋白激酶 C(PKC)被称为第二种信使依赖性蛋白激酶,在调节各种细胞应答中起关键作用,也是促肿瘤的佛波酯的受体蛋白[12]。PKC 的激活参与了癌细胞增殖、侵袭、凋亡、耐药性和遗传不稳定等的发生发展[13]。基于以上研究推测PKC激动剂TPA可通过诱导MMP-9表达,增强肿瘤转移能力。因此,本研究首先通过生物信息学分析结直肠癌组织中 MMP-9的表达,发现MMP-9 在结直肠癌中同样存在过表达的现象,与文献报道相符。同时,一系列实验表明TPA 可以诱导 SW480 细胞 MMP-9 过表达与分泌,进而有助于肿瘤细胞侵袭转移的发生。
大量研究表明,MicroRNA 在多种人类恶性肿瘤中均处于表达失调状态,并可调控肿瘤的发生、发展、侵袭、转移等过程[14]。其中,miR-122-5p 表达失调可以影响多种类型癌症的 EMT、侵袭、转移、增殖或凋亡等癌症进展相关过程。同时,本研究实验也利用生物信息学分析以及相应实验证实miR-122-5p靶向调控MMP-9 的表达进而抑制SW480细胞的迁移侵袭能力。
综上所述,在结直肠癌中,miR-122-5p能够靶向调控MMP-9的表达,从而抑制TPA通过激活PKC诱导细胞侵袭迁移的能力。但是,miR-122-5p是否可以作为临床诊断预后的标志物,以及TPA相关抑制剂能否用于改善预后还需进行深入研究。
