人参二醇皂苷通过调节上皮间质转化抑制喉癌细胞的增殖和迁移
2023-02-01石耿隆赵昀霞颜如玉孙宇新辛伟红
石耿隆,赵昀霞,颜如玉,孟 艳,孙宇新*,辛伟红*
(1.吉林大学中日联谊医院 耳鼻咽喉头颈外科,吉林 长春130033;2.吉林大学基础医学院 病理生理学系,吉林 长春130021)
喉鳞状细胞癌占全身恶性肿瘤的5.7%~7.6%[1],40%的患者在确诊时已进展至Ⅲ期或Ⅳ期,复发和转移是5年内喉癌患者死亡的主要原因[2]。上皮间质转化(EMT)可增强细胞迁移和侵袭能力[3]。RAS/RAF/MEK/ERK,Wnt/β- catenin等多种信号传导途径参与EMT的激活和调控[3]。喉癌的转移与EMT过程有关,调节EMT信号传导途径是减少喉癌转移性的潜在治疗策略[4]。人参二醇皂苷(PDS)是从人参茎叶中提取的属于四环三萜类的原人参二醇型提取物。PDS及其代谢产物Rb2、Rd、F2、Rh2、Rg3、CK和PPD可有效抑制肿瘤细胞的侵袭和转移[5]。PDS具有甾环结构,具有地塞米松样抗炎、抗休克作用。本研究旨在观察PDS对人喉癌Hep2细胞迁移的影响,报道如下。
1 材料和方法
1.1 细胞、主要试剂盒、仪器
人喉癌细胞系Hep2细胞(吉林大学基础医学院前列腺疾病预防和治疗研究中心),PDS(吉林大学自然医学研究实验室的专利产品,专利号为ZL98100070.3),RPMI-1640培养基(美国Gibco公司),胎牛血清(美国Clark Bioscience公司),地塞米松(山东新华制药有限公司),Trizol(美国Invitrogen公司),二甲基亚砜、蛋白酶抑制剂(美国Sigma公司),逆转录试剂盒、SYBR实时荧光定量PCR试剂盒(北京宝泰克公司),BCA蛋白质测定试剂盒(上海碧云天生物有限公司)。β-actin、MMP2、MMP9、E-cadherin抗体(美国Proteintech公司),N-cadherin、vimentin、β-catenin抗体(北京博奥森公司)。酶标仪(德国Biotek公司),CFX96实时荧光定量 PCR 仪、蛋白电泳仪和转膜仪(美国 Bio-Rad 公司)。
1.2 细胞培养
Hep2细胞含有10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基中,于37 ℃,5%CO2培养箱中常规培养。以5×105的密度将Hep2细胞接种于6孔板中,当细胞达到70%~75%状态时,细胞分为3组,分别加入100 mg·L-1PDS(PDS组)、100 nmol·L-1地塞米松(DEX组)及等量PBS(CON组)。48 h后收获细胞,用于后续分析目的蛋白的mRNA和基因的表达水平。
1.3 MTT实验
将Hep2细胞以每孔约5×103个细胞接种于96孔板中,每组5个复孔,实验重复3次。当细胞生长达到70%~75%融合时,加入不同浓度的PDS溶液,继续培养24 h和48 h。结束实验前每孔加入20 μL MTT溶液(5 g·L-1)孵育4 h后,去上清后加入150 μL二甲基亚砜充分震荡溶解后,使用酶标仪在490 nm处测量吸光度(A)值,细胞存活率=实验组A/对照组A×100%。
1.4 划痕实验
将Hep2细胞(1×106/孔)接种到6孔板中并保持对数生长直至生长汇合。使用200 μL移液管尖端在细胞层上划痕,PBS洗涤后用无血清培养基培养,分别在0 h和48 h拍照记录划痕宽度。实验重复3次,应用Image J软件对划痕距离进行统计学分析,计算划痕愈合率=(0 h划痕距离-48 h划痕距离)/0 h划痕距离×100%。
1.5 HE染色和形态学分析
将载玻片置于24孔板中,并将细胞(1×104)接种在孔板中。将细胞培养24 h后给与相应药物处理,继续培养48 h。用无菌PBS洗涤3次3~5 min,用4%多聚甲醛固定20~30 min,进行HE染色,在显微镜下观察并拍照。使用Image J软件进行形态学分析,计算细胞面积和周长。
1.6 实时定量PCR
收集各组细胞后用Trizol试剂裂解,根据说明书制备总RNA。应用逆转录试剂盒逆转录成cDNA。使用2×Plus SYBR qPCR Mix进行实时荧光定量PCR。反应条件为94℃预变性2 min,之后94℃变性15 s,60℃退火30 s,40个循环后,70℃延伸10 min。以GAPDH为内参,并通过2-ΔΔCt方法计算目的基因相对表达水平。特异性引物序列如表1。
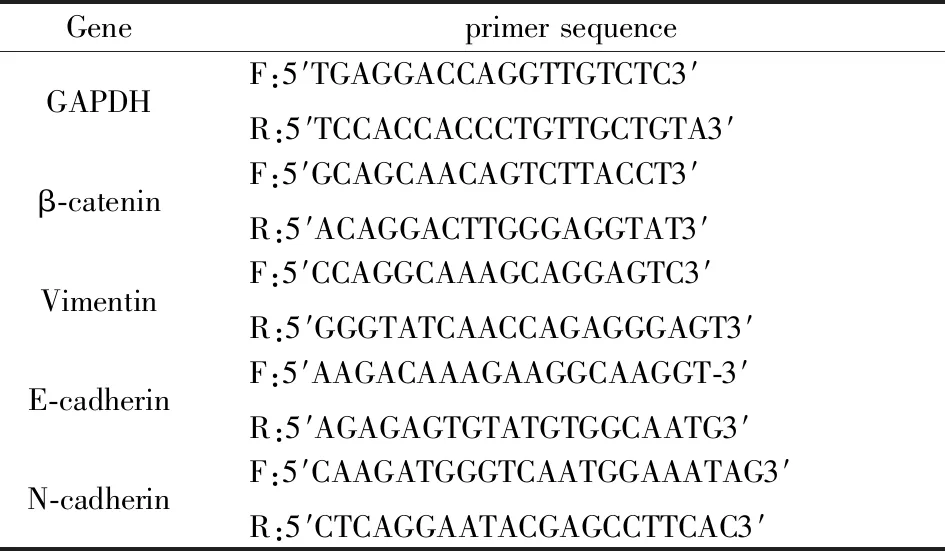
表1 RT-qPCR引物序列
1.7 Western blotting法
细胞用冷PBS洗涤后应用细胞裂解液细胞,提取各组细胞蛋白,BCA法测定蛋白质浓度。加入上样缓冲液后煮沸变性10 min,取30 μg加样,通过12%SDS-PAGE凝胶电泳,通过湿转仪器将蛋白转移至PVDF膜。1×TBST溶液(含5%脱脂奶粉)室温封闭1 h,加入一抗后4 ℃过夜。TBST洗膜3次,加入二抗,1 h后TBST清洗后加入ECL显影,凝胶成像分析仪采集图像,使用图像分析软件(IMAGE J)分析条带灰度值,β-actin为内参,计算目的蛋白表达水平。
1.8 统计分析
2 结果
2.1 PDS抑制喉癌Hep2细胞的存活率
MTT实验检测结果发现,各给药组与对照组(0 mg·L-1)相比,PDS处理24 h后细胞存活率没有显着变化(P>0.05,图1A),而PDS处理48 h时,从75 mg·L-1开始细胞存活率明显下降,并随着剂量增加,Hep2细胞的生长受到显着抑制(P<0.05,图1B)。

n=3.*P<0.05 and **P<0.01 vs 0 mg·L-1 group.
2.2 PDS抑制喉癌Hep2细胞的迁移
与CON组(65.7%±3.5%)相比,用100 nmoL·L-1DEX(31.6%±5.6%)和150 mg·L-1PDS(4.3%±1.7%)处理48 h的细胞显示更低的划痕愈合率,明显抑制了细胞迁移能力(P<0.05,图2)。
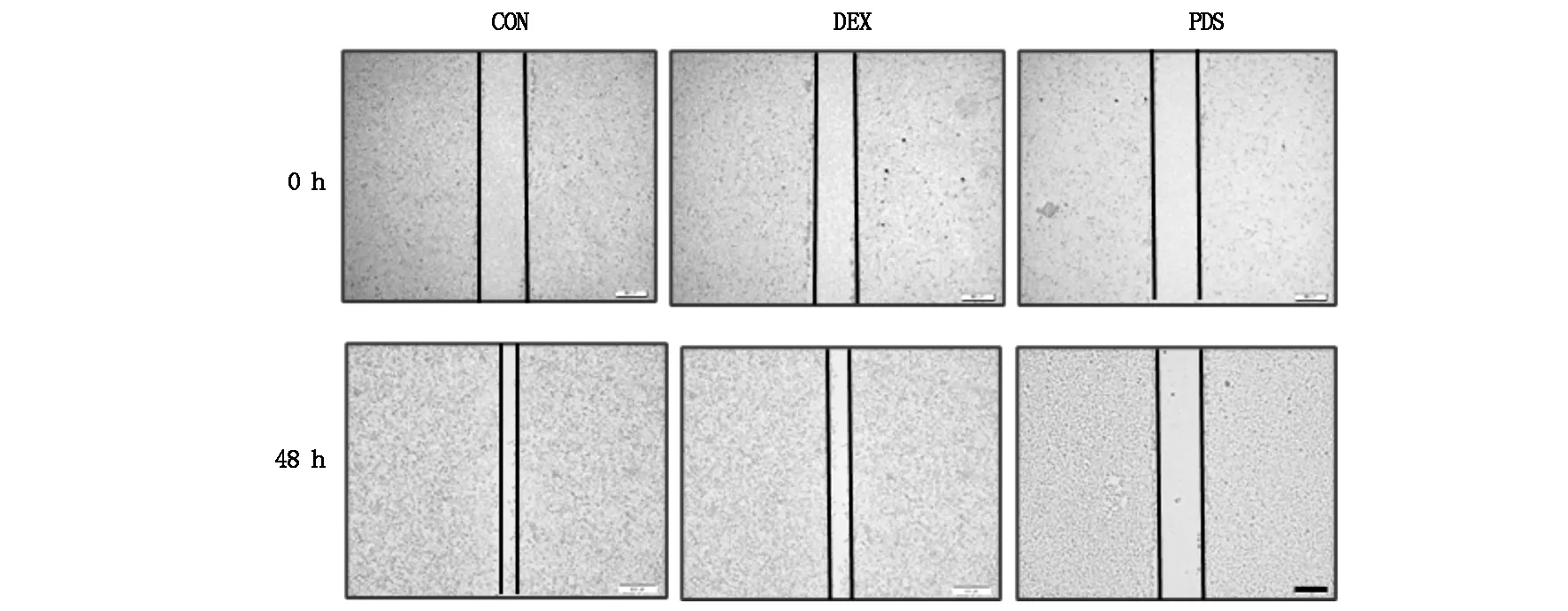
CON,control;PDS,PDS group;DEX,Dexamethasone group.
2.3 PDS抑制喉癌Hep2细胞的上皮-间质转化
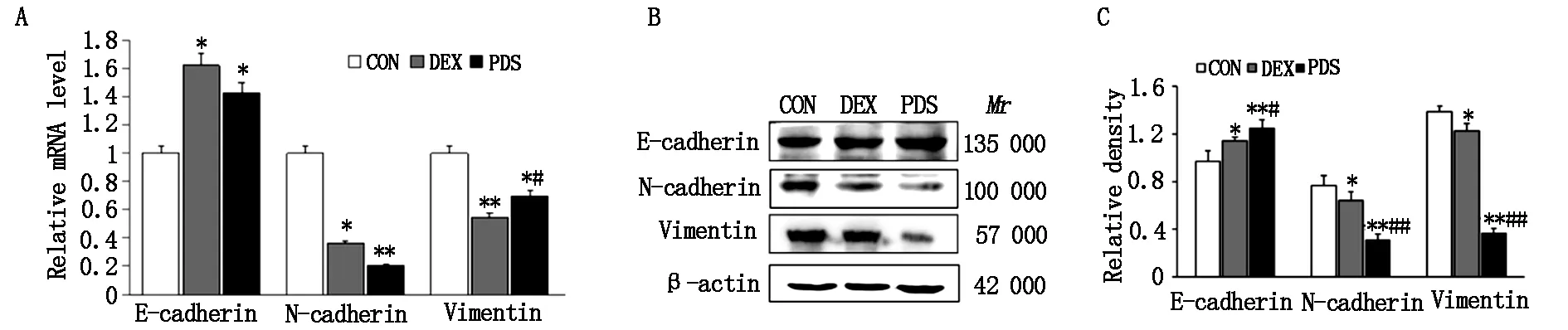
HE染色后的形态学分析显示,PDS和地塞米松处理48 h后细胞的表面积和周长显着增加,触角消失,由纺锤形和多角形,逐渐呈鹅卵石样形态,存在分化成上皮细胞的趋势(图3)。间充质细胞标志物N- E-cadherin和vimentin的mRNA和蛋白表达水平明显降低(P<0.05),而上皮细胞分化标志物E-cadherin的mRNA和蛋白表达水平明显增加(P<0.05,图4)。表明PDS具有和地塞米松一样抑制EMT,抑制细胞迁移的作用。
2.4 PDS抑制β-catenin的表达
与CON组相比,PDS组和地塞米松组β-catenin的mRNA和蛋白表达水平明显降低(P<0.05),并且PDS对β-catenin蛋白水平较地塞米松的影响更为明显(P<0.01,图5 B、C)。

CON,control;PDS,PDS group;DEX,Dexamethasone group.
n=3.*P<0.05,**P<0.01 vs CON group,#P<0.05,##P<0.01 vs DEX group.CON,control;PDS,PDS group;
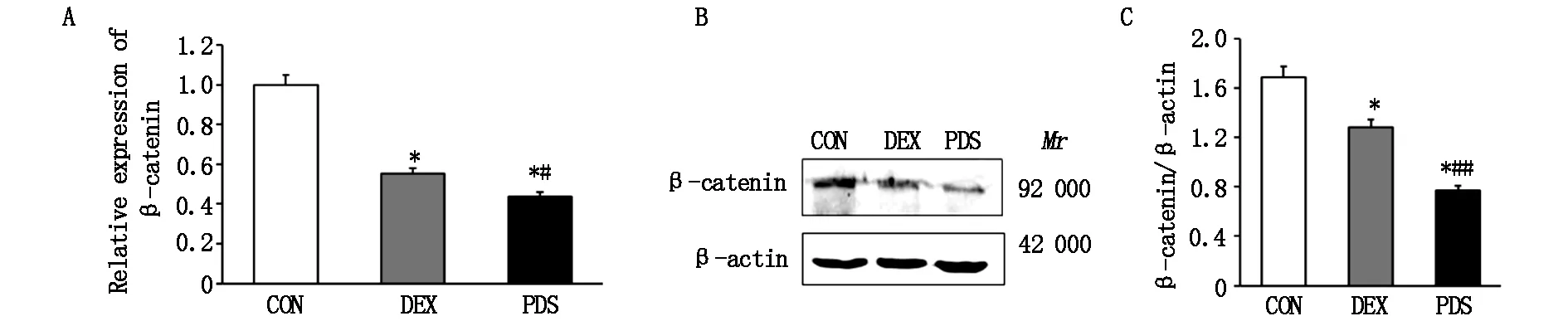
n=3.*P<0.05 vs CON group,#P<0.05;##P<0.01 vs DEX group.CON,control;PDS,PDS group;DEX,Dexamethasone group.
3 讨论
人参、三七等中药的提取物,因其潜在的抗癌功能而受到广泛关注,Fan X等最近研究发现人参二醇皂苷通过调节JAK2-STAT3信号通路,显著抑制人胰腺癌细胞系 PANC-1 和 Patu8988 的增殖并诱导细胞凋亡[6]。Xiao S等也发现人参二醇皂苷通过线粒体途径促进人肝细胞癌细胞凋亡[7]。本研究选用喉癌Hep2细胞,观察了PDS对细胞增殖和迁移的影响,发现PDS可以明显抑制喉癌Hep2细胞生长,划痕实验结果表明PDS处理后48 h细胞迁移能力受到抑制,为PDS在抗肿瘤临床上的应用提供了新的研究方向。
Chen XJ等报道PDS可抑制EMT,调节细胞黏附分子和MMPs的表达和活性抑制肿瘤细胞侵袭[5]。PDS的有效成分Rg1和Rg3可通过抑制TGF-β1诱导的EMT来抑制肝癌细胞系HepG2或肺癌细胞A549的迁移和侵袭[8]。本研究探讨了PDS对Hep2细胞的迁移能力影响的机制。Park MT等因为PDS与地塞米松的结构类似,发现其可通过糖皮质激素受体下调MMP-9 有助于抑制 HT1080 人纤维肉瘤细胞的侵袭能力[9]。这与本研究的HE染色的形态学分析结果相吻合,PDS或地塞米松处理48 h后,Hep2细胞的表面积和周长都显著增加,存在分化成上皮细胞的趋势。E-cadherin是分布在上皮细胞表面的钙依赖性黏附分子,作为上皮细胞标志物,其功能丧失与鳞癌等的转移性传播,侵袭和预后不良有关,是EMT的标志之一[10]。在本研究中,PDS抑制Hep2细胞中间充质细胞标志物N-cadherin的表达并诱导E-cadherin的表达。另一种重要的间充质生物标志物是Vimentin,其表达是上皮细胞经历EMT的特征[11]。在本研究中,PDS也明显下调了Vimentin在Hep2细胞中的表达,进一步证明了PDS具有地塞米松一样抑制喉癌细胞EMT过程的作用,进而抑制了细胞的迁移能力。
Wnt/β-catenin被认为是EMT过程中最重要的信号传导途径蛋白之一。Wnt信号通路被激活,通过切断β-catenin的降解途径,β-catenin转移到细胞核中,调节下游基因C-myc,Snail等的表达,促进肿瘤细胞EMT,发生转移[12]。对天然药物成分、基因干扰等多研究显示,对Wnt/β-catenin途经的抑制作用可明显逆转EMT过程,并影响肿瘤细胞的迁移和侵袭能力[13]。本研究中通过PDS处理观察到Hep2细胞对β-catenin信号传导的抑制作用,并在蛋白质和基因水平上得到证实。这些结果提供了PDS抑制Hep2细胞中Wnt/β-catenin和TGF-β信号传导的最新证据,这可能是PDS抑制Hep2细胞中EMT的主要分子机制。
总之,本研究发现PDS抑制Hep2细胞的EMT与迁移能力,这与抑制喉癌细胞的Wnt/β-catenin信号传导有关。
