猪轮状病毒VP4、VP6蛋白原核表达及多克隆抗体的制备
2023-01-31王奕斐洪大林边金妮韦祖樟黄伟坚欧阳康
王奕斐,洪大林,米 雪,杜 琛,边金妮,陈 樱,韦祖樟,黄伟坚,欧阳康*
(1.广西大学 动物科学技术学院 广西高校动物疫病预防与控制重点实验室,广西 南宁 530005;2.广西壮族自治区兽用生物制品工程研究中心,广西 南宁 530005)
轮状病毒(rotavirus,RV)是一种能导致人类和动物病毒性腹泻的重要病原体,据世界卫生组织估计,RV感染大多在亚洲以及非洲的发展中国家流行,每年导致近45万名儿童丧生,年龄都在5岁以下[1]。猪轮状病毒(porcine rotavirus,PoRV)是呼肠孤病毒科,轮状病毒属的成员之一,多见于病原感染导致的幼年仔猪腹泻。PoRV是一种无包膜的双链RNA病毒,电子显微镜观察呈“车轮状”。其基因组均为双链RNA分为11个节段,分别编码6种结构蛋白(viral structural protein,VP)与6种非结构蛋白(non-structural protein,NSP),在VP中,VP4和VP7蛋白分别决定了病毒的P型与G型;VP6组成了病毒内衣壳蛋白,免疫原性较强,是决定RV分组的特异性抗原,可作为RV感染血清抗体检测的重要候选抗原[2]。
病毒外层是由内衣壳蛋白VP6、外衣壳蛋白VP7以及纤突蛋白VP4组成,它们是病毒3种重要的抗原,分别为群抗原、中和抗原和血凝素抗原。其中,有血凝作用的抗原VP4可诱导机体产生中和抗体。VP4编码区翻译776个氨基酸,其相对分子质量为88 ku,在病毒蛋白总量中约占1.5%,作为病毒生命周期中最重要的蛋白,在病毒繁殖及病毒—受体结合过程中起到关键作用[3]。VP4蛋白又称蛋白酶—敏感蛋白,它在蛋白水解酶作用下可裂解为VP8*和VP5*,该反应在病毒侵入细胞过程中十分重要[4]。VP6作为主要结构蛋白有着维持病毒粒子稳定的重要作用,其在病毒粒子中含量最丰富,在病毒蛋白总量中约占51%,主要以三聚体形式组成完整病毒粒子的中间层,且免疫原性十分良好[5]。VP6在病毒的复制、装配过程中起到重要作用,对病毒转录酶、复制酶来说是必需亚基,并且还有激活转录酶、促进mRNA合成等作用[6]。RV在演化过程中分出了多种G型与P型,但VP6基因在不同分型之间高度保守,所以由其编码的VP6蛋白是亚单位疫苗的首选,有着连续的抗原表位,在研制合成肽疫苗方面潜力巨大[7]。
任晓峰等[3]对PoRV VP4全长进行了原核表达以及兔源抗体的制备,其抗体效价为1∶105,经过Western blot与IFA检测多抗具有良好的抗原抗体反应性。原霖等[8]利用杆状病毒表达系统在昆虫细胞中成功表达VP6基因完整编码区,并对可溶性表达蛋白进行了纯化,特异性良好。本研究目的为利用原核表达系统表达VP4基因抗原性较好的部分抗原位点区域及VP6全长蛋白,制备PoRV兔源多克隆抗体,通过免疫印迹分析与间接免疫荧光分析评价多克隆抗体特异性。旨在为特异性检测方法建立以及疫苗效价评估等方面的研究提供参考。
1 材料与方法
1.1 病毒与细胞PoRV 18GXGG株、培养细胞Marc-145细胞(非洲绿猴胚胎肾细胞)均由本实验室保存提供。
1.2 主要试剂Primer Star酶、DL5000 DNA Marker均购自于宝生物工程(大连)有限公司;CutSmart Buffer、BamHⅠ内切酶、HindⅢ内切酶、SalⅠ内切酶购自NEB(北京)有限公司;DH5α、BL21(DE3)感受态细胞购自广西南宁康维生物科技有限公司;表达载体pET-32a质粒由本实验室保存;BCA Protein Assay Kit购自于宝日医生物技术(北京)有限公司;His-Tagged Protein Purification Kit购自于康为世纪生物科技有限公司。
1.3 实验动物新西兰大白兔3只,体质量为2.0~2.5 kg/只,由广西大学动物科学技术学院教学科研基地提供。本研究遵循实验动物福利伦理原则,严格按照广西大学实验动物伦理委员会规定执行。
1.4 方法
1.4.1抗原位点预测及引物设计 根据米雪等[26]对18GXGG株同源性分析及遗传进化分析结果显示VP4核苷酸序列与P[7]型韩国株(MF940546.1)、P[7]型中国株(AY523636.1)同源关系较近,同源性分别为99.88%,99.63%,遗传进化树为同一分支,亲缘关系较近,而A群PoRV VP6序列相对保守。故参考该分析对序列进行了抗原表位预测,在线网址:http://imed.med.ucm.es/Tools/antigenic.pl。通过DNAStar Protein软件对氨基酸序列进行分析,选取VP4蛋白抗原性较强的2个区段(20~360 aa、553~776 aa)对包含了部分抗原位点的区域以及VP6完整编码区进行原核表达。预期扩增18GXGG株VP4部分片段1 023 bp(20~360 aa)、672 bp(553~776 aa)以及VP6完整开放阅读框1 191 bp。设计3对引物(表1),由擎科(南宁)生物公司合成。

表1 扩增引物信息
1.4.2VP4、VP6基因的扩增 提取PoRV 18GX-GG分离株总RNA,使用引物分别进行RT-PCR对VP4及VP6基因序列进行扩增,PCR反应产物通过琼脂糖凝胶电泳进行鉴定,并进行胶回收。RNA反转录体系25.0 μL:5×Buffer 5.0 μL,dNTP mix 2.0 μL,M-MLV Reverse Transcriptase 0.5 μL,下游引物1.0 μL,RNasin酶抑制剂0.5 μL,RNA模板16.0 μL。42℃反转录1.0 h。PCR反应体系25.0 μL:Primer Star 12.5 μL,上、下游引物各0.5 μL,cDNA模版3.0 μL,ddH2O补至25.0 μL。VP4片段PCR反应条件:95℃预变性3 min;98℃变性10 s;55℃退火5 s;72℃延伸10 s;共32个循环;72℃延伸10 min;VP6片段PCR反应条件:95℃预变性3 min;98℃变性10 s,58℃退火5 s,72℃延伸15 s,共32个循环;72℃延伸10 min。
1.4.3重组表达质粒pET32a-VP4-672、pET32a-VP4-1023、pET32a-VP6的构建与鉴定 胶回收产物和 pET-32a空载体进行酶切,酶切产物进行反应液回收。然后使用T4DNA连接酶进行连接,16℃过夜。将连接产物转化至DH5α感受态细胞,挑取单个菌落进行菌液PCR,筛选出阳性菌液进行扩菌。最后抽提质粒,并进行双酶切鉴定,经电泳鉴定为阳性的重组质粒送生工(南宁)生物公司测序。
1.4.4重组质粒表达条件的优化及表达形式的鉴定 将测序正确的重组质粒转化至BL21感受态细胞,经菌液PCR鉴定阳性的菌液扩菌至6 mL培养基,37℃培养至D600 nm=0.6时收集1 mL菌液作为未诱导对照,分别设置诱导剂终浓度为0.2,0.4,0.6,0.8,1.0 mmol/L,16℃过夜诱导后处理样品,SDS-PAGE鉴定。然后使用探索的最佳诱导终浓度进行诱导时间探索,设置诱导时间分别为4,8,12,16,20 h,16℃诱导后处理样品,SDS-PAGE鉴定。利用确定的最佳诱导浓度及诱导时间大量扩繁阳性菌液,诱导后离心,加入细菌裂解液重悬后进行超声破碎,离心后分别取上清与沉淀样品处理,进行SDS-PAGE鉴定。
1.4.5VP4、VP6的纯化 经表达形式鉴定VP4、VP6均为包涵体表达,收集沉淀,利用8 mol/L尿素充分溶解后用0.22 μm滤器过滤。使用镍柱法蛋白纯化试剂盒对蛋白进行纯化。使用BCA试剂盒测定纯化后各管收集液浓度。并取各管收集液样品处理,进行SDS-PAGE鉴定。
1.4.6VP4、VP6多克隆抗体的制备及抗体效价测定 首免前采集兔血清作阴性对照。初免按照1 mg/只的剂量,将纯化后的蛋白与弗氏完全佐剂1∶1充分混合后,对兔进行背部皮下多点注射。除首次免疫外其余免疫均用蛋白与弗氏不完全佐剂混合。2周后进行次免,间隔1周进行三免,再次间隔1周进行四免,四免结束7 d后进行心脏采血,收集血清,分装保存。以纯化的蛋白为抗原包被酶标板,以各蛋白对应的多克隆抗体血清为一抗,HRP-山羊抗兔IgG为二抗,利用间接ELISA方法进行血清效价测定,酶标仪测定D450 nm处数值。
1.4.7多克隆抗体的Western blot验证 纯化后的蛋白取40 μL加入10 μL Loading Buffer,沸水煮10 min。样品进行SDS-PAGE电泳,根据蛋白条带大小剪取大小合适的PVDF膜,进行转膜,转膜结束洗涤液润洗3次,5%的脱脂奶粉37℃封闭2 h,洗涤液润洗3次,多克隆抗体1∶1 000稀释,在37℃分别孵育对应蛋白2 h,洗涤液润洗3次,HRP-山羊抗兔IgG 1∶5 000稀释,37℃孵育1 h,洗涤液润洗5次。显色1 min,使用Western blot蛋白印迹成像仪进行拍照并保存。
1.4.8多克隆抗体间接免疫荧光试验 将Marc-145细胞铺于96孔细胞板,待细胞铺满单层时,将PoRV经胰酶处理后接种96孔板,病毒感染48 h后,弃掉细胞培养基,用PBS润洗3次,加入冰甲醇-20℃固定30 min,PBS润洗3次,1%BSA室温封闭1 h,PBS润洗3次,VP4、VP6阴、阳性血清1∶200稀释后37℃孵育2 h,PBS润洗3次,山羊抗兔IgG 1∶500稀释,37℃避光作用1 h,PBS避光润洗3次,DAPI避光室温作用10 min,PBS避光润洗3次。荧光显微镜下观察并拍照保存。
2 结果
2.1 抗原位点预测结果VP4-672、VP4-1023基因片段及VP6完整编码区抗原表位预测结果见表2。
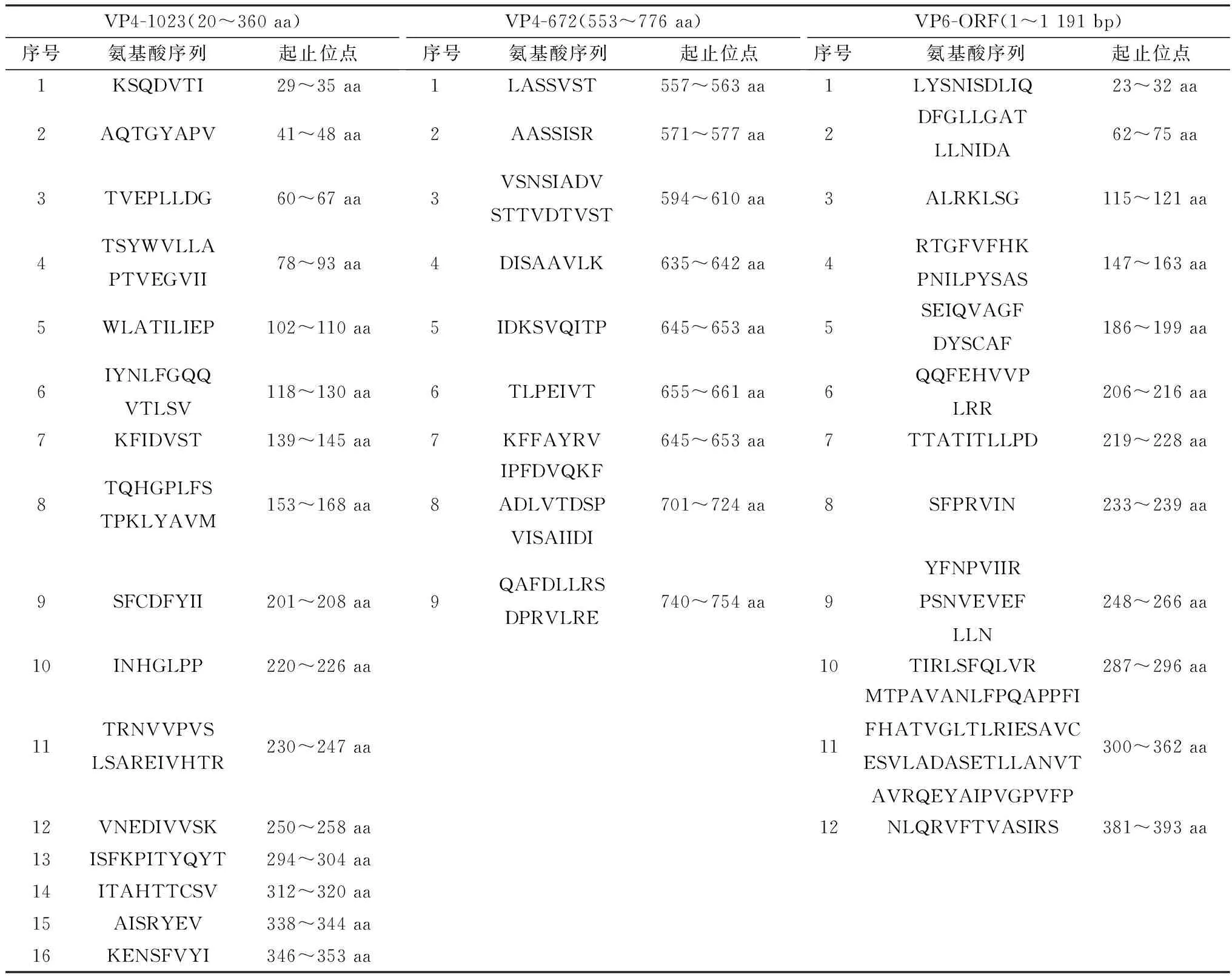
表2 VP4-672、VP4-1 023、VP6基因片段抗原位点预测
2.2 质粒pET32a-VP4-672、pET32a-VP4-1023、pET-32a-VP6的构建与鉴定以PoRV毒株总RNA为模板,将扩增出的片段分别克隆至pET-32a载体,得到的重组质粒分别命名为pET-32a-VP4-672、pET-32a-VP4-1023、pET-32a-VP6。对重组质粒进行双酶切鉴定,结果如图1所示,酶切产物经电泳检出目的片段和pET-32a载体片段,与预期大小一致。测序结果与毒株18GXGG序列同源性100%,表明重组表达质粒构建成功。
A.重组质粒pET-32a-VP4-672鉴定结果(M1.DL5000 DNA Marker;1.双酶切);B.重组质粒pET-32a-VP4-1023鉴定结果(M2.DL5000 DNA Marker;2.双酶切);C.重组质粒pET-32a-VP6鉴定结果(M3.DL5000 DNA Marker;3.双酶切)
2.3 重组质粒表达条件的优化及表达形式的鉴定SDS-PAGE电泳结果表明,不同诱导剂终浓度对VP4、VP6蛋白表达效果影响较小;诱导时间对VP4-672蛋白表达影响较小,但随诱导时间的延长,VP4-1023、VP6蛋白条带变粗,提示表达量有所增加。考虑到诱导剂毒性作用以及菌液生长时间过长可能会有杂菌的产生,故将诱导剂浓度定在1.0 mmol/L,16℃诱导12 h。按最佳条件大量扩菌后,通过对菌体破碎后的上清和沉淀分析,结果如图2所示,VP4、VP6重组蛋白均主要以包涵体形式表达。

A.重组质粒pET-32a-VP4-672表达形式鉴定(M1.10~180 kDa 蛋白Marker;1.32a空载;2.诱导后;3.破碎后上清;4.破碎后沉淀);B.重组质粒pET-32a-VP4-1023表达形式鉴定(M2.10~180 kDa蛋白Marker;1.32a空载;2.诱导后;3.破碎后上清;4.破碎后沉淀);C.重组质粒pET-32a-VP6表达形式鉴定(M3.14~100 kDa蛋白Marker;1.32a空载;2.诱导后;3.破碎后上清;4.破碎后沉淀)
2.4 重组蛋白的纯化SDS-PAGE分析纯化后的重组蛋白条带大小与预期大小相符,如图3所示。纯化后的蛋白在其他位置均无明显杂带,使用BCA蛋白定量试剂盒测定蛋白质量浓度:VP4-672最高1.91 g/L;VP4-1023最高1.42 g/L;VP6最高0.64 g/L。

A.重组蛋白VP4-672纯化后鉴定(M1.14~100 kDa 蛋白 Marker;1~3.纯化蛋白洗脱峰);B.重组蛋白VP4-1023纯化后鉴定(M2.14~100 kDa 蛋白 Marker;1~3.纯化蛋白洗脱峰);C.重组蛋白VP6纯化后鉴定(M3.14~100 kDa 蛋白 Marker;1~3.纯化蛋白洗脱峰)
2.5 多克隆抗体效价的测定利用间接ELISA方法测定抗体效价,当阳性血清孔D450 nm值与阴性血清孔的D450 nm值的比值(P/N)>2.1时,最高稀释度为该多克隆抗体的效价。纯化后的兔抗PoRV VP4-672蛋白多克隆抗体效价约为1∶16 384 000;VP4-1023蛋白多克隆抗体效价约为1∶4 096 000;VP6蛋白多克隆抗体效价约为1∶8 192 000(图4)。
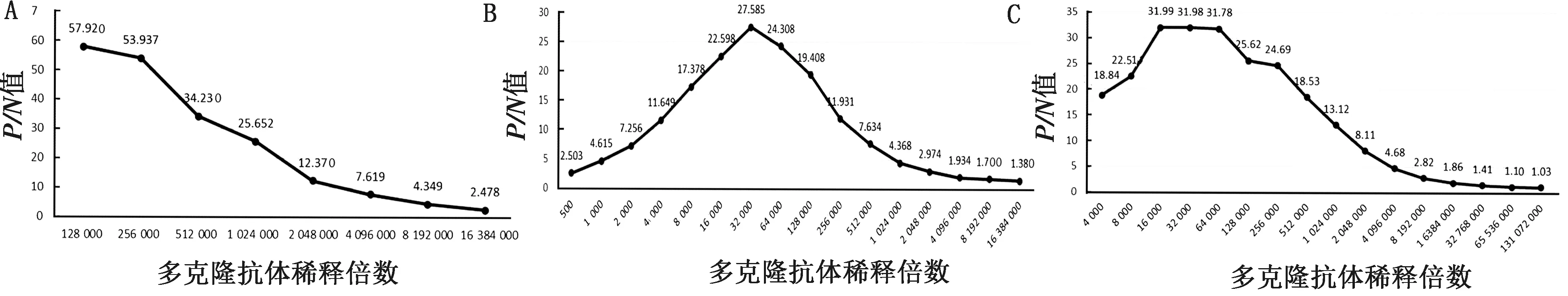
A.VP4-672多克隆抗体效价检测;B.VP4-1023多克隆抗体效价检测;C.VP6多克隆抗体效价检测
2.6 多克隆抗体的Western blot验证多克隆抗体进行Western blot结果如图5所示,兔抗多克隆抗体均能够与对应结构蛋白特异性结合,VP4-672、VP4-1023、VP6在44,58,64 kDa处分别显示特异性反应条带,与预期条带大小一致,表明其均有较好反应原性。

A. VP4-672多克隆抗体Western blot(M1. 14~100 kDa Protein Marker;1.纯化后蛋白VP4-672);B.VP4-1023多克隆抗体Western blot(M2.14~100 kDa Protein Marker;2.纯化后蛋白VP4-C);C.VP6多克隆抗体Western blot(M3.14~100 kDa Protein Marker;3.纯化后蛋白VP6)
2.7 多克隆抗体间接免疫荧光试验间接免疫荧光对兔源VP4、VP6多克隆抗体进行鉴定,结果显示多克隆抗体血清组出现黄绿色荧光,而阴性血清对照则没有可见荧光。结果如图6~8所示,制备的VP4、VP6兔源多克隆抗体能够很好地识别PoRV并与之结合,具有良好的特异性。

A~C.VP4-672多克隆抗体识别感染PoRV的Marc-145细胞(×20);D~F.阴性血清对照(×20)

A~C.VP6多克隆抗体识别感染PoRV的Marc-145细胞(×20);D~F.阴性血清对照(×20)
3 讨论
RV是一种人畜共患病毒,危害人和多种动物,每年在全世界范围内导致近20万人死亡[9]。PoRV能够引起仔猪腹泻,传染性强、流行范围广、发病率高等是其感染特征,该病毒感染动物后致死率不高,但常与其他病原体混合感染导致患病动物病情加重,致死亡率升高,对我国养猪业的健康发展有较大阻碍作用。PoRV在我国呈全国性流行,抗体阳性率最高为95.7%,病毒阳性率最高为68.4%,在有、无腹泻症状的猪只中均可检测到[10]。中国流行的PoRV G基因型为G9、G11、G2、G4、G5、G26和G3,P基因型多以P[13]、P[19]、P[23]为主[11]。目前我国主要流行的G5P[7] 型RV也属各大洲最为流行的OSU毒株[12]。
病毒纤突蛋白VP4在胰酶作用下可裂解成2个亚单位,VP8*(1~231 aa)和VP5*(248~776 aa),VP8*位于棘突末端,负责病毒—配体相互作用,而VP5*通过构象重排和膜融合促进病毒穿透宿主细胞[13]。其中VP8*包含了VP4主要抗原位点,在VP4特异性中和反应中起到关键作用,VP5*片段在RV不同基因型之间具有交叉反应性,而VP8*片段具有很高的型特异性,对RV的诊断、研制亚单位疫苗方面以及抗病毒药物的研究等方面意义相当重要[14]。且研究发现,VP8*是一种重要的中和抗原蛋白,在其蛋白亚基上包含的5个线性B细胞表位中有3个表位都参与病毒的中和反应[15]。参考ETHAN等[13]的研究,本试验选取的片段672 bp(553~776 aa)包含在VP5*基因片段末端结构域中,经抗原表位预测共包含9个,而1 023 bp(20~360 aa)包含了VP8*基因片段除N-末端片段外所有抗原表位区、胰酶裂解过程中切除的残基(232~247 aa)以及VP5*基因片段部分抗原结构域,经抗原表位预测共包含16个。构建完成VP4 2个片段的原核表达质粒,均以包涵体形式在E.coli中表达了重组蛋白,且纯化效果及抗原性和免疫原性较好,以期为后续VP4蛋白入侵机理等研究提供参考。
VP6开放阅读框内编码了6组以上成串的稀有密码子,在E.coliBL21(DE3)中即使更改诱导条件,蛋白也显示不表达或表达量极低,更换为可提供某些稀有密码子的E.coliRosetta(DE3)宿主菌,VP6蛋白可大量表达[16]。CHOI等[17]通过E.coliRosetta(DE3)宿主菌对人RV CJN株全长VP6蛋白进行了表达,结果显示该种类宿主菌可将蛋白表达量提高5~10倍,又将VP6密码子进行了优化,重组蛋白的表达量有进一步提高。TONG等[18]通过研究指出,使用重组腺病毒对人RV VP6进行表达时,优化密码子后也可提高蛋白表达量。本研究虽然利用E.coliBL21(DE3)原核表达系统表达PoRV全长VP6,并未对密码子进行优化,但纯化后重组蛋白产量可满足兔源多抗制备试验需求。
本试验通过构建PoRV VP4部分片段及VP6完整开放阅读框的原核表达载体重组质粒,经过表达条件探索,发现诱导浓度对3个重组质粒的表达量影响较小,考虑到诱导终浓度高于1.0 mmol/L会产生一定的毒性影响,而又期望其表达量尽可能高,故选用1.0 mmol/L作为诱导终浓度。诱导时间探索结果显示,诱导时间长短对VP4-672片段表达影响较弱,但随着时间延长,VP4-1023片段以及VP6片段表达量均有提高,考虑到随诱导时间的延长,IPTG对菌体的毒性影响以及杂菌生长概率也会增长,故选用16℃诱导12 h作为时间条件。对表达蛋白进行纯化,制备的多克隆抗体,经初步鉴定、免疫动物实验、Western blot及IFA试验显示,表达产物和多克隆抗体均具有良好的抗原性和免疫原性。
根据RV群抗原VP6的差异可将该病毒分为A~F 6个群[19],绝大多数哺乳动物为A群,腹泻猪中检测到的最主要的均为A群。而根据VP7和VP4抗原性的不同,又将A群分为不同的基因型,由VP7决定其G型,由VP4决定其P型[20]。交叉免疫在轮状病毒不同基因型间较少或不存在,但由VP4和VP7决定的基因型有包含现象,1个P基因型可能覆盖数个G基因型,不同P型RV的特异性表位大都集中在VP8*蛋白的71~204 aa之间[21]。王璐等[22]经过研究发现G5与G9基因型感染人与动物会发生重排现象产生新的基因型,并可致婴幼儿腹泻。自冯力等[23]研制出猪腹泻病毒三联苗,我国G5型PoRV明显减少。但在中国和亚洲其他地区,越来越多的G9型PoRV从仔猪腹泻样品中被分离出来[24-28],其增长趋势明显。中国近年也有G9P[7]流行的报道[29]。近年亚洲地区流行前3位的A群PoRV基因型分别为:G5(29.4%)、G3(25.4%)和G9(11.37%);P[7](41.6%)、P[6](9.9%)和P[23](8.73%)[30]。本试验室分离得到的PoRV 18GXGG株通过遗传进化分析结果显示,18GXGG株为A群G9 P[7]型,VP4核苷酸序列与P[7]型韩国株(MF940546.1) 、P[7]型中国株(AY523636.1)同源关系较近,同源性分别为99.88%,99.63%[26]。因此,对其VP4部分片段以及VP6的表达可为今后研究基因工程苗,或新型诊断方法的建立等提供参考。RV不同毒株基因组序列之间存在较大差异,造成其血清型的多型性,其中很重要的一点便是在同一宿主感染了2个不同血清型的RV毒株时,基因片段之间存在明显“漂移”和“转变”现象,在转录复制过程中发生交换,交叉或者重排,导致病毒的血清型变异[31]。当今国际畜产品贸易飞速发展,导致PoRV新血清型出现的几率明显增加。因此,需要时刻监测流行株血清型变化情况,对目前流行血清型的毒株进行蛋白层面的研究,可为预防PoRV提供有效数据以及技术支撑,对疫苗研究与应用提供理论依据。
