肝细胞癌相关固醇⁃O酰基转移酶1基因的生物信息学分析
2023-01-30程日娜王晓宇马庆孔令华张宇奇秦凯莉赵莹珠苏丹弓韬郭睿
程日娜,王晓宇,马庆,孔令华,张宇奇,秦凯莉,赵莹珠,苏丹,弓韬,郭睿
山西医科大学基础医学院生物化学与分子生物学教研室,山西 太原 030001
根据2020年全球癌症报告最新数据统计,肝癌全球发病率居第六位,中国发病率居第四位[1]。肝癌仍为我国主要的癌症之一。肝癌预后较差,因此,早期治疗多选择手术切除,晚期多服用化疗药物进行治疗[2⁃3]。但长期使用化疗药物不仅具有较大的毒性,且易产生耐药性,因此,探索新的肝癌治疗方案尤为重要[4]。最新研究发现,调节脂酰辅酶A:胆固醇酰基转移酶(acyl⁃coenzyme A:cholesterol acylt⁃ransferase,ACAT)可有效抑制肝细胞癌的迁移和增殖[5]。ACAT 又称固醇⁃O 酰基转移酶(sterol O⁃acylt⁃ransferase,SOAT),属于膜结合O⁃酰基转移酶(mem⁃brane⁃bound O⁃acyltransferase,MBOAT)家族,是一种细胞内酶[6⁃8]。1993年,ACAT基因第 1 次被鉴定,目前在哺乳动物体内已被证明有SOAT1 以及SOAT2两种亚型[9⁃10]。此外有研究发现,SOAT 在肝细胞中的活性90%主要是同工酶SOAT1发挥作用[10]。
SOAT 可催化胆固醇以胆固醇脂(cholesteryl esters,CE)的形式储存于脂质滴中。研究表明,在多类肿瘤细胞中脂质滴数量较高,相比于正常组织,CE已被证明是脂质滴的主要成分[11]。因此,针对CE 的储存可成为治疗癌症的一个潜在指标[10,12]。LI 等[13]报道了胆固醇酯化与胰腺癌转移的关系,结果显示,通过抑制SOAT1 活性减少CE 的生成可显著抑制原位小鼠胰腺癌肿瘤的生长。SOAT1的表达是调节胰腺癌的一个潜在标志。BEMLIH 等[14]则发现了一种新型SOAT1 抑制剂来治疗胶质母细胞瘤,通过使用该抑制剂明显降低了SOAT1表达以及CE的数量,从而抑制了胶质母细胞瘤的生长并诱导细胞凋亡。此外,JIANG 等[5]通过蛋白组学分析发现,SOAT1 可作为肝癌S⁃Ⅲ亚型的标记物以及治疗靶标。
本研究采用生物信息学方法对SOAT1基因的结构性质、相关功能以及蛋白质相互作用进行分析,深入探索SOAT1基因相关的肝癌发病机制,以期为肝癌的相关治疗提供新的理论依据。
1 材料与方法
1.1SOAT1基因与蛋白质的相关信息 通过美国国立生物技术信息中心(National Center for Biotechno⁃logy Information,NCBI)获得,网址:https://www.ncbi.nlm.nih.gov/。
1.2SOAT1基因的生物信息学分析 SOAT1相关信息由以下软件分析预测:ProtParam(http://web.expasy.org/protparam/)、Protscale(http://web.expasy.org/protscale/)、SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP⁃4.0/)、TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)。采用以下软件或数据库对SOAT1的组织表达特异性和亚细胞定位等进行分析:NCBI 相关数据库、PSORT Ⅱ(https://psort.hgc.jp/form2.html)。采用以下软件对SOAT1 的结构进行预测:NCBI 相关数据库、SOPMA(https://npsa⁃prabi.ibcp.fr/cgi⁃bin/npsa_automat.pl?page=npsa_sopma.html)、SWISS ⁃MODEL(https://swissmodel.expasy.org/)。SOAT1的蛋白 互作关系预测软件:STRING(http://string⁃db.org/)。采用以下软件得到SOAT1 的翻译后位点修饰情况:NetNGlyc1.0Sever(http://www.cbs.dtu.dk/services/NetNGlyc/)、NetOGlyc4.0Server(http://www.cbs.dtu.dk/services/NetOGlyc/)、Netphos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)。
2 结果
2.1 SOAT1 的基本性质 登录NCBI 官网对SOAT1基因进行检索分析,SOAT1基因定位于人1号染色体1q25.2,外显子个数为17。SOAT1 蛋白的GenBank序列号为AAH28940.1,共有550 个氨基酸残基,分子量为64 734.61,分子式为C3059H4541N743O767S23。经ProtParam 分析统计,SOAT1 蛋白中亮氨酸(Leu)所占比例最高,达11.10%;而半光氨酸(cys)所占比例最低,仅为1.60%。SOAT1 蛋白中带负电的残基总数(天冬氨酸残基+谷氨酸残基)为46,带正电的氨基酸残基总数(精氨酸+赖氨酸)为58,理论等电点(PI)为9.08,因此,该蛋白偏碱性。ProtParam 软件同时给出该蛋白在水中280 nm 测得的消光系数。假设所有成对的cys残基均形成胱氨酸时,Abs 0.1%(= 1 g/L)为 1.950,消光系数为126 210 M⁃1cm⁃1;当所有cys残基均消除时,Abs 0.1%(=1 g/L)为1.942,消光系数为125 710 M⁃1cm⁃1。此外,该蛋白在哺乳动物网织红细胞中的半衰期为30 h,其中不稳定性指数(Ⅱ)为36.71,低于阈值(40),因此为稳定蛋白。其中脂肪指数达92.67,亲水性平均值(GRAVY)为0.190。
Protscale 软件对SOAT1 蛋白的亲水性分析显示,最低点分别为位于 21 和 24 位谷氨酸,23 和 25 位天冬氨酸,得分均为-3.400;而最高点位于150 位的异亮氨酸,得分为3.700。SOAT1的大部分氨基酸残基位于0 点以上的疏水区域,且ProtParam 预测该蛋白亲水性平均值为0.190,两者结论一致,因此,该蛋白为疏水性蛋白质。见图1。
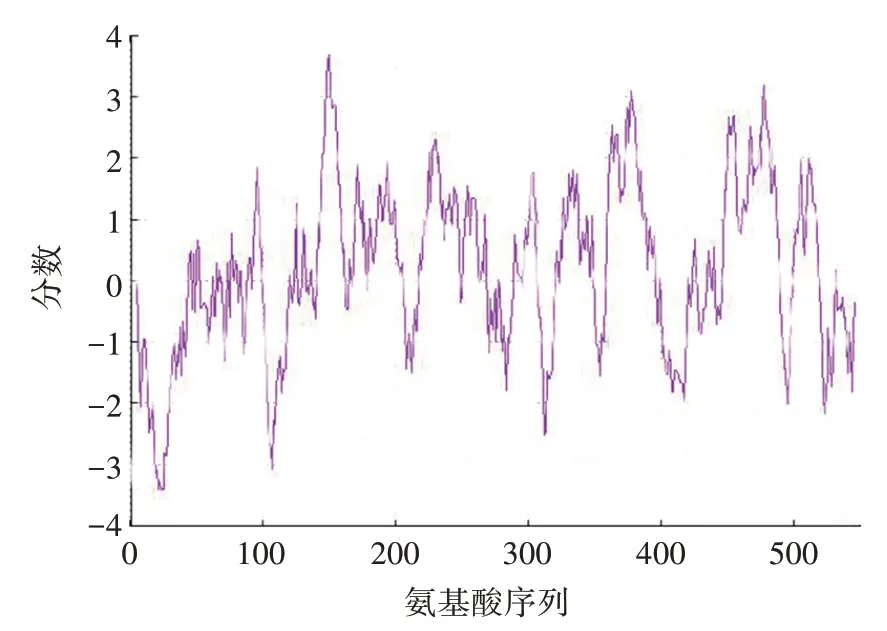
图1 SOAT1蛋白的亲疏水性分析Fig.1 Hydrophilicity and hydrophobicity analysis of SOAT1 protein
使用SignalP 4.0 Server 对SOAT1 信号肽进行预测分析,其中C 为区分是否为反应切位点,S 判断是否为分泌蛋白,Y 值为前两者的综合分析。分析显示,C 值最大位于 66 位,得分为 0.109;Y 值最大则位于38 位,得分为0.111。这些值均未达到阈值,因此预测SOAT1 为无信号肽。见图2。此外,SecretomeP 2.0a Server(http://www.cbs.dtu.dk/services//)对非经典蛋白质分泌做出了预测,该蛋白的NN⁃得分为0.731,超过了哺乳动物推荐阈值(0.6),因此,SOAT1为非经典分泌蛋白。
图2 SOAT1蛋白的信号肽分析Fig.2 Signal peptide analysis of SOAT1 protein
由 TMHMM Server v.2.0 对 SOAT1 的跨膜结构进行预测,结果显示,SOAT1 蛋白存在8 个跨膜结构域,1⁃139 位于膜内,163⁃183 位于膜外,204⁃223 位于膜内,247⁃317 位于膜外,341⁃360 位于膜内,384⁃436位于膜外,460⁃463位于膜内,487⁃500位于膜外,519⁃550位于膜内,是一个跨膜蛋白。见图3。
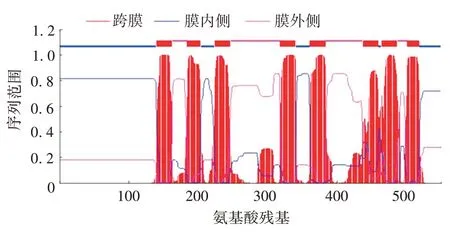
图3 SOAT1蛋白的跨膜结构预测Fig.3 Prediction of transmembrane structure of SOAT1 protein
2.2 SOAT1的组织表达特异性和亚细胞定位 使用NCBI 中Nucleotide 数据库对来自27 个不同组织的95 个人的组织样本进行RNA⁃Seq,结果显示,SOAT1在肾上腺中表达量最高,其中每百万reads 中来自于某基因每千碱基长度的reads数(reads per kilobase per million mapped reads,RPKM)为(68.851 ± 5.939);在皮肤组织中表达量最低,RPKM 为(1.012± 0.286)。见图4。对SOAT1 进行亚细胞定位发现,该蛋白大部分存在于细胞膜中,占比为73.90%;少部分位于内质网和线粒体中,占比分别为21.70%和4.30%。
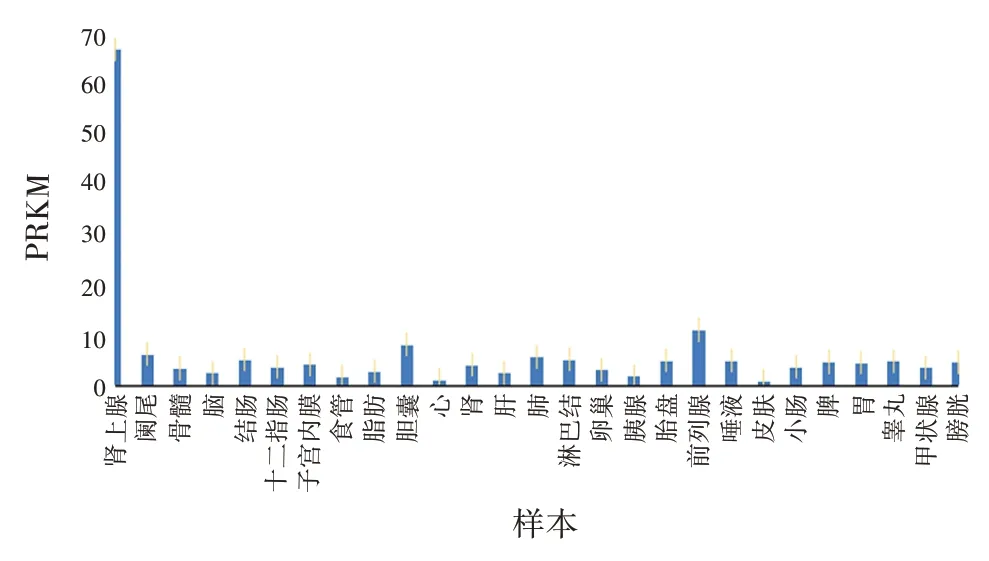
图4 SOAT1在正常组织中的表达特异性Fig.4 Expression specificity of SOAT1 in normal tissues
2.3 SOAT1 的二级和三级结构 通过SOPMA 软件预测SOAT1的二级结构,其中α⁃螺旋为主要结构,占比51.82%,是SOAT1 蛋白二级结构的主要构成原件;其次为无规则卷曲,占31.45%;延伸链和β⁃转角分别占比13.09%和3.64%。见图5。综上,该蛋白高级结构稳定维持,因此可更好地发挥蛋白质相应功能。
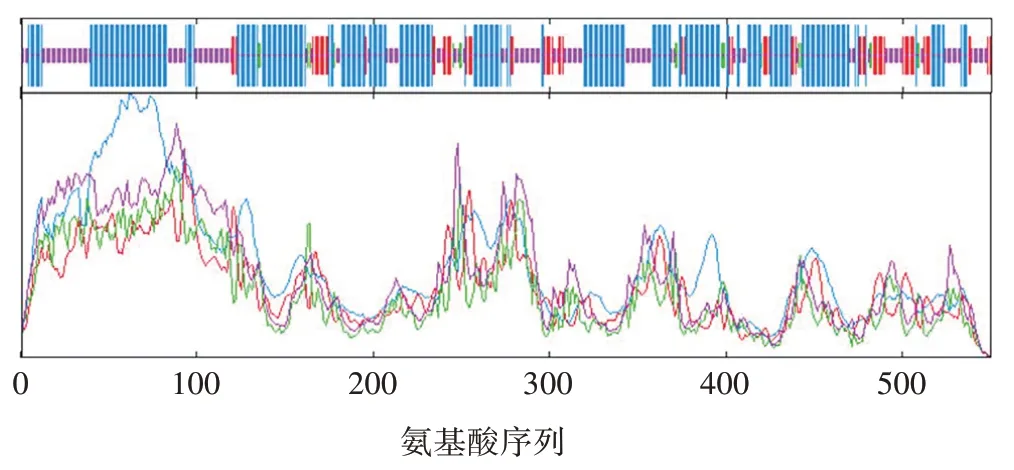
图5 SOAT1蛋白的二级结构预测Fig.5 Prediction of secondary structure of SOAT1 protein
使用NCBI Conserved Domain 数据库进行同源性对比,氨基酸序列第171⁃520 位属于MBOAT 超家族结构域,见图6。膜蛋白的MBOAT 家族包含多种酰基转移酶。
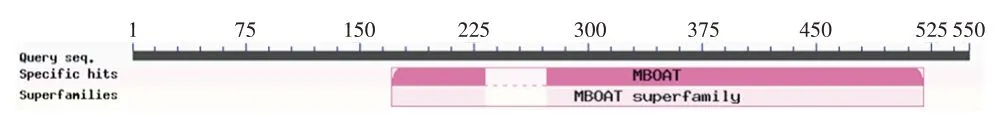
图6 SOAT1的保守结构域Fig.6 Conserved domain of SOAT1
使用 SWISS⁃MODEL 对 SOAT1 蛋白三级结构进行预测,该软件使用了8 个模板进行建模,得到了1个标准模板。该模型氨基酸序列的模型覆盖率为88%,GMQE 为0.61,QMEAN 为-4.98。因此该模型是标准三级结构。见图7。
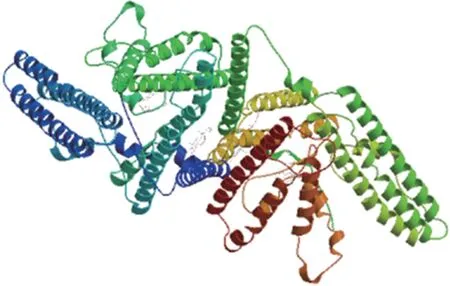
图7 SOAT1蛋白的三维结构预测Fig.7 Prediction of tertiary structure of SOAT1 protein
2.4 SOAT1 翻译后修饰位点 NetNGlyc 1.0 Sever对N⁃糖基化位点进行预测发现,可能具有4 个N⁃糖基化位点,而只有2 个超过阈值,为最可能的糖基化位点,分别位于319(得分为0.506 4)和406 位(得分为0.550 4)。使用NetOGlyc 4.0 Server 软件预测O⁃糖基化位点,一共预测出3 个位点,分别位于33、286和 287 位,对应的得分分别为0.509 134、0.523 38 和0.759 24。因此,287 位可能是主要的O⁃糖基化位点。而Netphos 3.1 Server 预测结果显示,可能有46个磷酸化位点,得分大于0.9的位点可达14个,其中16位丝氨酸、71位丝氨酸以及127位丝氨酸得分,均为0.992,因此可能性最大。
2.5 SOAT1 的蛋白相互作用关系预测 STRING 软件对SOAT1进行了蛋白质相互作用网络预测,设置置信度大于 0.7,结果 SOAT1 与 10 个蛋白(CYP46A1、CYP27A1、CYP7A1、CYP11A1、DHCR24、DHCR7、DH⁃CR24、CH25H、SOAT2、STS)有密切联系。见图8。
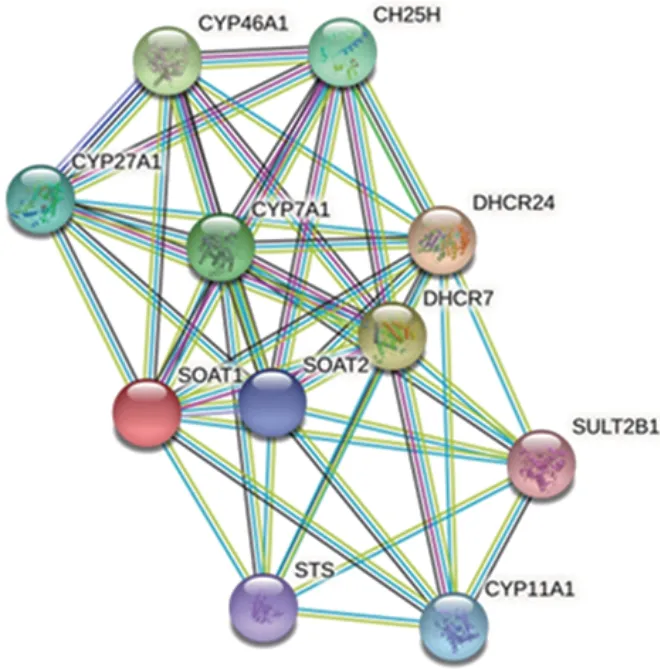
图8 SOAT1的蛋白相互作用网络Fig.8 Protein interaction network of SOAT1
SOAT1 涉及到的KEGG 通路见表1,该蛋白主要参与的信号通路有6 种,其中hsa00120、hsa00100、hsa04979、hsa00140 等通路均与脂质类代谢通路相关。且SOAT1 蛋白还参与了PARP 通路,与细胞凋亡调节相关。此外,GO分析同样显示了SOAT1与相关蛋白参与胆固醇的生物合成以及分解代谢,见表2。

表1 SOAT1蛋白网络中涉及到的KEGG通路分析Tab.1 Analysis of KEGG pathway involved in SOAT1 protein network
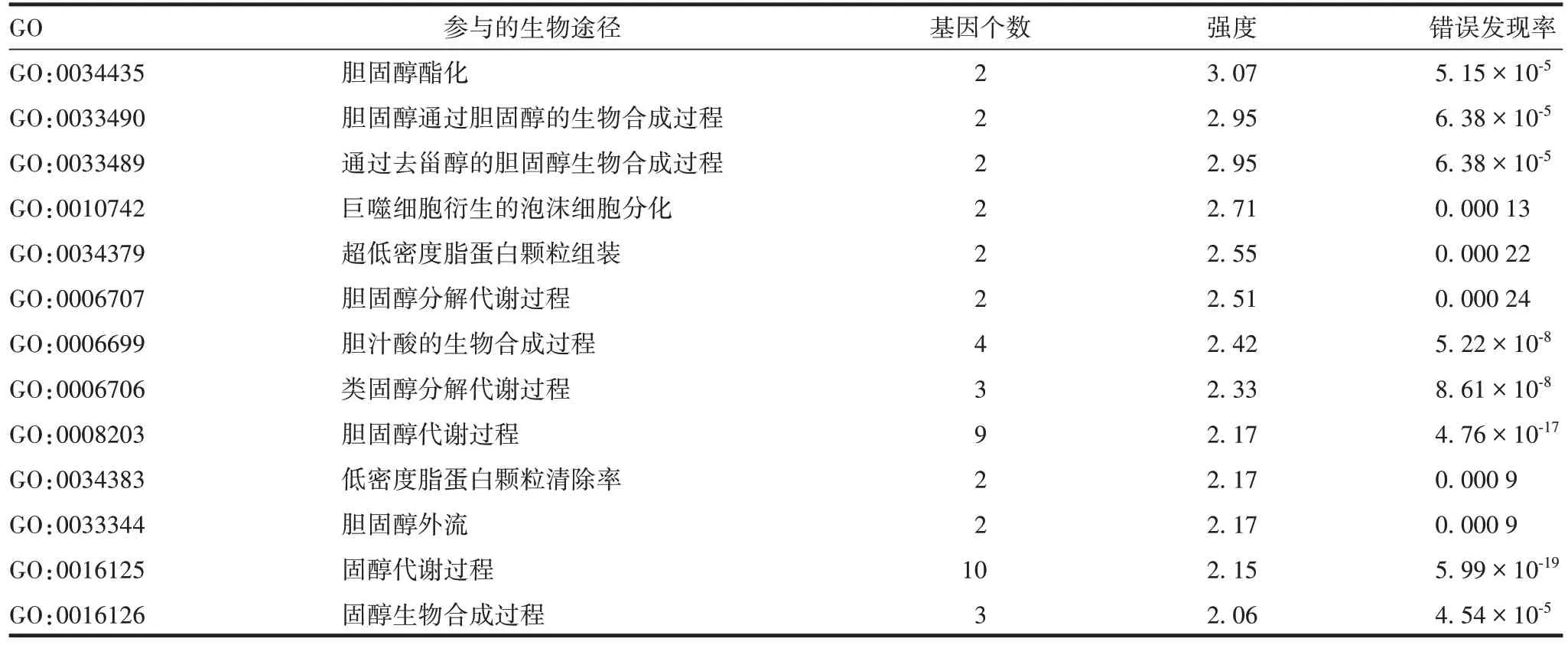
表2 SOAT1的GO分子功能分析Tab.2 GO molecule function analysis of SOAT1
3 讨论
SOAT1 已被证明与多种癌症的进展有关,近年来尤其发现与肝细胞癌具有一定的联系。通过使用生物信息学工具分析发现,SOAT1 是一种疏水性蛋白,属于膜蛋白的MBOAT 家族,具有8 个跨膜结构域,大部分位于细胞膜中,属于非经典途径蛋白。SOAT1 蛋白在多种组织细胞均有表达,但大部分位于肾上腺组织,在皮肤组织表达最低。蛋白质相互作用预测多为与胆固醇合成代谢相关蛋白。经预测,有2 个高可信度N⁃糖基化位点、3 个O⁃糖基化位点以及14 个可信度高的磷酸化位点,因此,多种功能修饰证明SOAT1在胆固醇代谢途径的关键作用。
KEGG 通路以及 GO 分析预测发现,SOAT1 蛋白主要参与的是胆固醇的合成以及分解代谢过程,其中预测到SOAT1 同时也参与PARP 通路。在多种代谢途径,脂质代谢一直被认为与癌症的迁移相关[13],通过研究也发现,多种类型癌细胞中胆固醇积累较高,而PARP 通路又是经典的凋亡通路[15],临床多通过使用PARP 抑制剂调节该通路实现癌症的治疗[5,14]。异常的胆固醇常诱导细胞氧化应激以及凋亡的发生。蛋白相互作用网络分析得到的相关蛋白,如 CYP46A1、CYP27A1、CYP7A1、CYP11A1 等均是胆固醇代谢通路的关键蛋白质,对维持胆固醇的稳定具有重要作用。此外,与SOAT1 蛋白相互作用的DH2R24 蛋白被证实在肝癌细胞中的表达明显高于肝细胞,且DH2R24 可调节凋亡相关蛋白caspase 3 的表达[16]。不仅如此,STRING 分析所得到的其他蛋白也被相关文献报道参与凋亡的调节[13,16],因此推断SOAT1与细胞的凋亡进展具有紧密的联系。已有研究阐明胆固醇的调节通路与PARP 通路均与癌细胞的发生发展密切相关[5,14],综合对比 SOAT1 的预测结果,可以推断SOAT1 与多种蛋白质相互作用参与两种信号通路,最终导致胆固醇异常积累以及调节细胞凋亡,从而影响肝细胞癌的进展。
多项研究发现抑制SOAT1在多种癌症治疗中具有一定的作用,近年SOAT1 被预测作为S⁃Ⅲ亚型的标记物以及治疗靶标,通过生物信息学研究预测该蛋白的结构以及功能,使得对SOAT1 与肝细胞癌相互作用的机制有了一定的了解,但具有一定的局限性。更加深入的作用机理还需通过详细的实验研究进行分析。
