一起牦牛呼吸道疾病的病原学诊断
2023-01-29蒋娇娇
蒋娇娇,岳 华,汤 承
(西南民族大学,四川成都 610041)
牦牛是青藏高原特有的牛种,为牧民们提供了重要的生产生活资料。我国牦牛主要分布在西藏、青海、四川、甘肃、云南等地,饲养数量超过1 500 万头,是世界上拥有牦牛数量最多的国家,占世界牦牛总数的95%以上[1]。牛呼吸道综合征(bovine respiratory disease complex,BRDC)是严重危害养牛业的一类疾病,除发热外,主要表现咳嗽、流鼻涕及呼吸困难等呼吸道症状,发病率和死亡率都较高[2]。病毒、细菌和支原体等都可引起BRDC,其中病毒包括牛病毒性腹泻病毒(bovine viral diarrhoea virus,BVDV)、牛副流感病毒3 型(bovine parainfluenza virus type 3,BPIV-3)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、牛冠状病毒(bovine coronavirus,BCoV)、牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)和牛腺病毒3型(bovine adenovirus type 3,BAdV-3)等,常见细菌和支原体包括多杀性巴氏杆菌(Pasteurella multocida,Pm)、溶血性曼氏杆菌(Mannheimia haemolytica,Mh)和牛支原体(Mycoplasma bovis,Mb)等[3]。一般认为病毒常作为原发性病原可侵害牛呼吸道黏膜并使机体抵抗力下降,引起条件性致病菌的继发感染,从而加重病牛的临床症状[4]。引起BRDC 的病因复杂,且常为多病原混合感染,而各种病原引起的临床症状相似,往往需要实验室检测来确定病原。尽管牦牛群中暴发BRDC 的报告很多,但多数报道是针对细菌进行的检测[5-7],而对BRDC 样本进行病毒检测和分离的报告很少,这在一定程度上制约了牦牛BRDC 的防控。
2022 年2 月,川西北高原某地牦牛暴发以发热、流涕、呼吸困难、个别母畜流产为特征的疾病。该地养殖牦牛16 000 余头,至5 月底约3 000 头发病,发病率约为18.8%,1 600 余头死亡,死亡率约为10.0%。本研究旨在通过对该地发病牦牛进行病原学诊断,确定引起BRDC 的病原,为该地牦牛呼吸道疾病防控提供参考。
1 材料与方法
1.1 材料
2022 年5 月,当地兽医部门送检13 头发病牦牛(编号1~13)的20 份样本,包括8 份鼻拭子样本、4 份全血样本、2 份流产中阴道拭子样本(以下简称流产拭子)、5 份肺脏样本和1 份胎盘组织样本(表1);BCoV、BVDV、IBRV、BAdV-3、BPIV-3、BRSV、Mb、Pm 及Mh 等病原阳性核酸,由西南民族大学动物医学实验室保存。
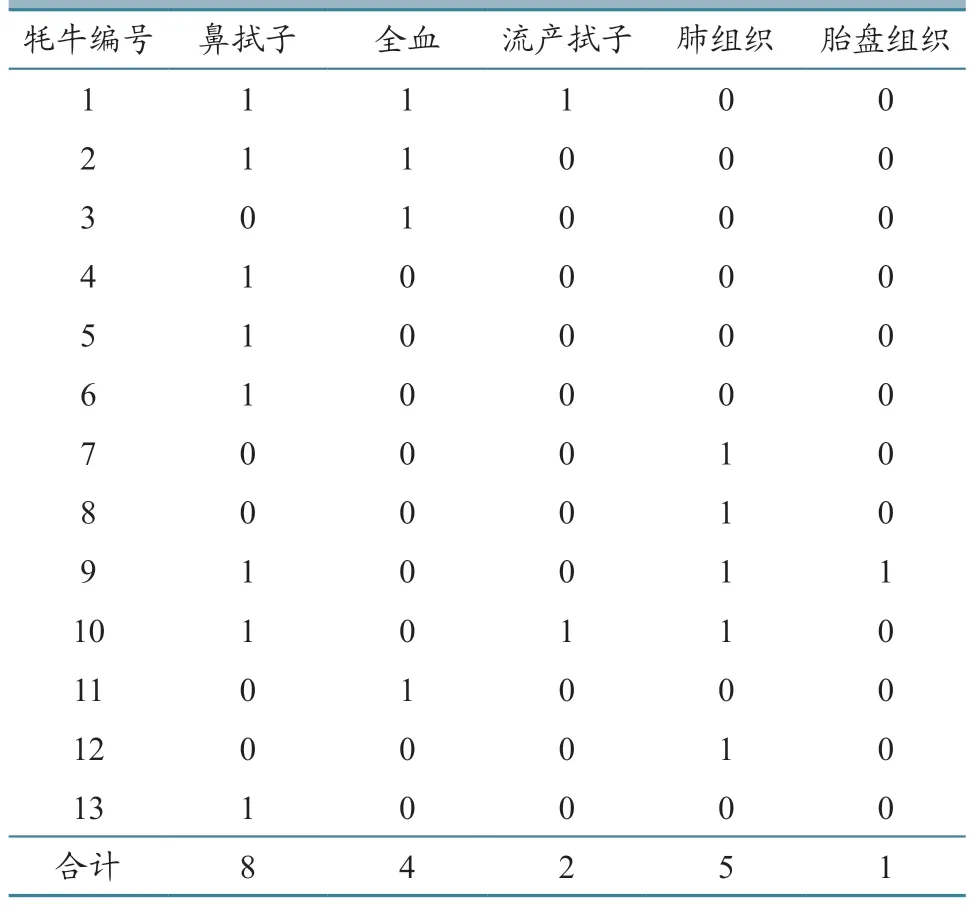
表1 20 份不同组织样本来源 单位:份
1.2 主要试剂及仪器
TrizolTMReagent、Prime ScriptTMRT、DL 2 000 DNA Marker 等,购于南京诺唯赞生物公司;TaKaRa T3 Super PCR Mix,购自擎科生物;Life ECO 基因扩增仪,购于杭州博日科技有限公司产品;凝胶成像系统、核酸蛋白电泳仪,购于Bio-Rad 公司产品;高速离心机,购于Eppendorf 公司。
1.3 样品处理和核酸提取
在鼻拭子、流产拭子、全血样本以及捣碎的胎盘和肺脏组织样本中,分别加入5 mL PBS 溶液吹打混匀,涡旋3 min,10 000 r/min 离心3 min后取上清液备用。
用酚-氯仿抽提法提取样本DNA,用Trizol法提取样本RNA,再反转录合成cDNA。反转录体系:DEPC-treated Water 8 μL,5×Reaction Mix 4 μL,Supreme Enzyme Mix 3 μL,RNA 5 μL;反应条件:25 ℃ 10 min,55 ℃ 15 min,85 ℃ 5 min。
1.4 病原检测
参照文献报道的PCR 方法,分别对20 份样品进行BVDV、BPIV-3、IBRV、BCoV、BRSV、BAdV-3、Pm、Mh 和Mb 等9 种BRDC 相关病原检测,引物信息见表2。阳性样品的PCR 产物,送往生工生物工程(上海)股份有限公司测序,以验证检测结果的准确性。
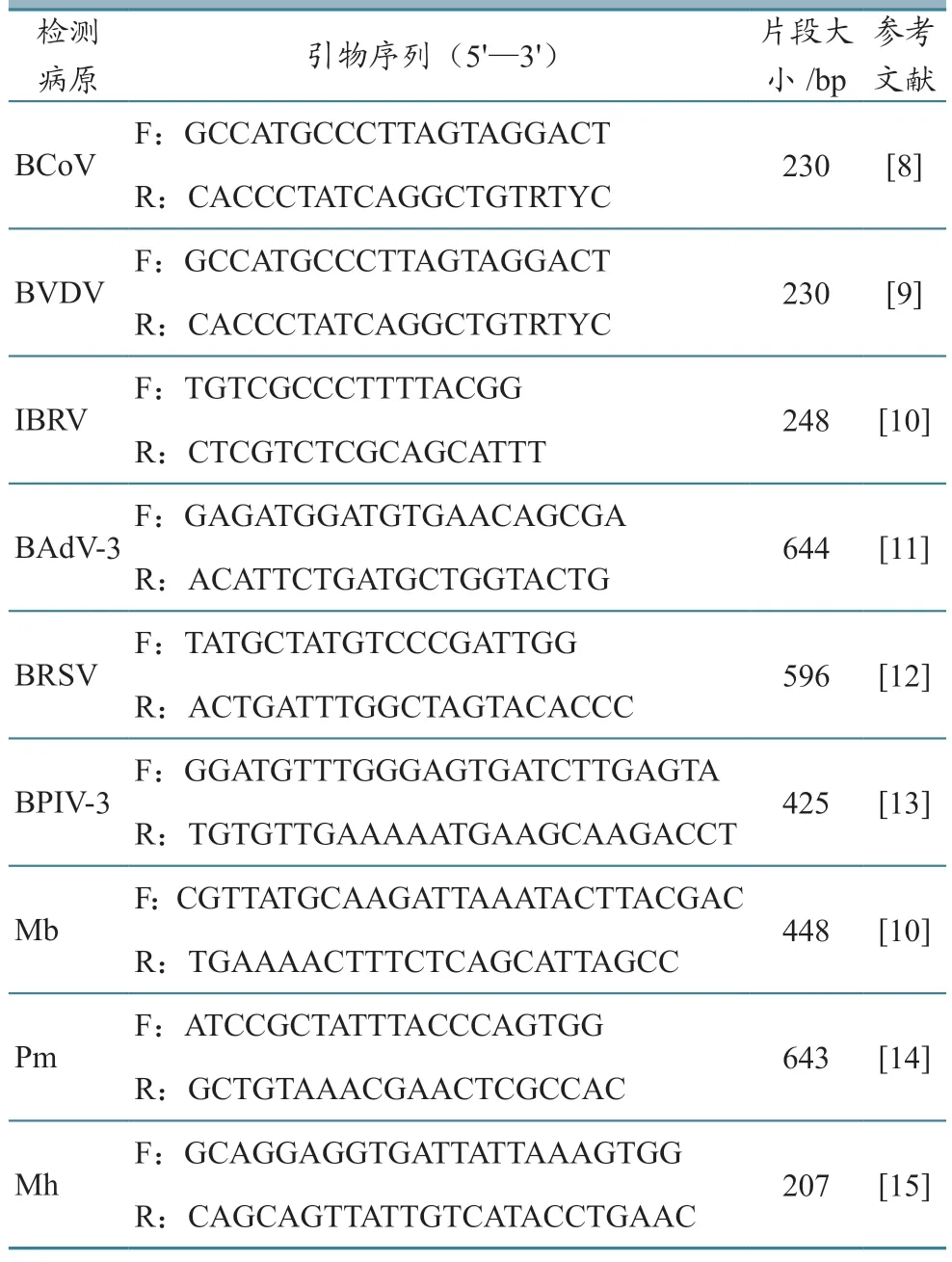
表2 PCR 检测引物信息
1.5 IBRV 分型鉴定
参照文献[16]报道的方法扩增IBRV 完整gC基因序列,根据gC编码的氨基酸序列[17]建立进化树确定IBRV 基因型。
1.6 Pm 分型鉴定
参照文献[18]报道的方法进行A、B 和D 型荚膜抗原分型,参照文献[19]报道的方法进行E和F 型荚膜抗原分型。
2 结果
2.1 PCR 检测
相关病原的PCR 检测结果(表3)显示:在20 份样本中共检测出IBRV、BAdV-3 和Pm 3 种病原,其他病原未检出;4 份全血样本中检测出3 份IBRV、1 份BAdV-3 阳性,1 份胎盘组织样本中检出IBRV 阳性,8 份鼻拭子样本中检出3 份IBRV、5 份BAdV-3 阳性,2 份流产拭子中检出2 份BAdV-3 阳性,5 份肺脏组织样本中检出4 份Pm阳性;IBRV+BAdV-3 混合感染率为23.1%(3/13),IBRV+Pm 混合感染率为15.4%(2/13),BAdV-3+Pm 混合感染率为15.4%(2/13),IBRV+BAdV-3+Pm 混合感染率为15.4%(2/13)。阳性扩增产物经过测序均为特异性扩增,进一步证实该地牦牛暴发的呼吸道疾病由IBRV、BAdV-3 和Pm 3 种病原感染引起。

表3 3 种病原阳性样本的来源牦牛分布
2.2 IBRV 分型
成功获取了7 份阳性样本中的完整gC基因。基于氨基酸进化树的分析结果(图1)显示:本研究检出的IBRV 阳性样品与1.2 型毒株聚为一大支,故可判断引起该地牦牛呼吸道疾病暴发的是1.2 型IBRV。
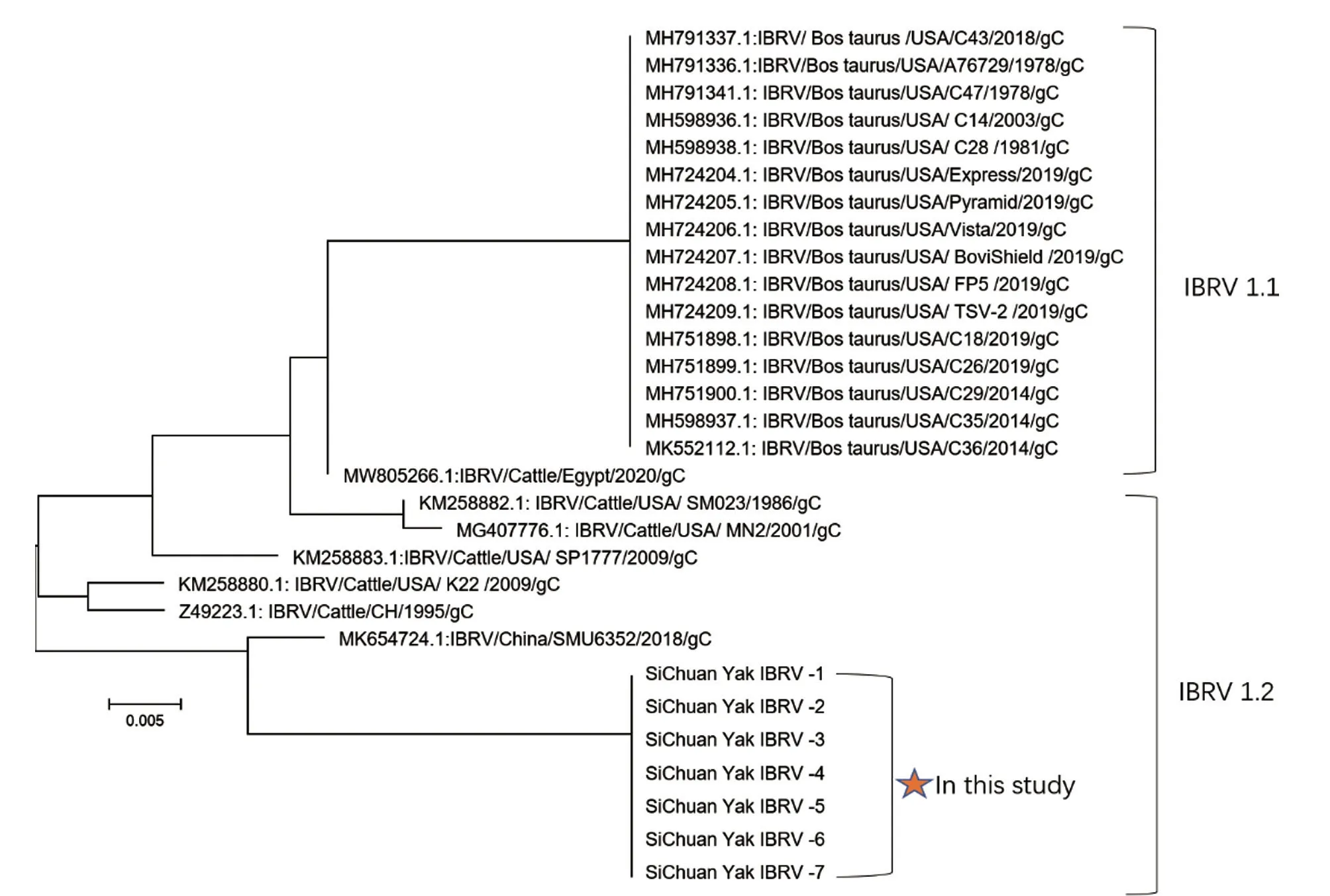
图1 IBRV gC 基因氨基酸进化树
2.3 Pm 分型
对4 份Pm 阳性样本进行荚膜抗原分型鉴定,结果发现4 份样本均为A 型(图2)。

图2 Pm 阳性样本荚膜抗原分型结果
3 讨论
本研究对川西北某地牦牛暴发的以发热、流涕、呼吸困难、个别母畜流产为特征的疫病进行了9 种主要呼吸道病原检测,综合病原检测结果和临床资料分析,确定该起病情是由1.2 型IBRV、BAdV-3 和A 型Pm 感染引起的。由于存在多病原混合感染,加之当地牦牛饲养管理粗放,基层兽医力量薄弱,早春牧草匮乏导致营养摄入不足,高原天气较为寒冷等因素,加重了此次病情,以至牦牛发病率和死亡率均较高。
巴氏杆菌病是由Pm 引起的一种牛急性败血性传染病,在青藏高原牦牛中多呈散发或地方流行,一年四季均可发生。近年来,关于牦牛巴氏杆菌病的报道较多,在青海、甘肃等地均有该病发生[20-21],给牦牛养殖业造成了严重经济损失。Pm 血清型Cater 分型法根据不同的荚膜抗原将Pm分为5 个血清型[19]。过去在牦牛群中流行的Pm 主要为B 型[22-24],而本研究检出的为A 型,证实了A 型Pm 在川西北地区的存在和流行;近年在西藏牦牛中也分离出了A 型Pm[25-26],因此有必要进一步加强对牦牛A 型Pm 流行情况的调查。A、B 型Pm 的交叉保护效果不好[27],此次发病牦牛接种过B型Pm疫苗,因而未能防御A型Pm对牦牛的感染。
IBRV 主要导致牛呼吸系统和生殖系统疾病,根据其gC基因编码的氨基酸差异可以将其划分为1.1 型与1.2 型,两者的抗原性有差异。有资料[17]显示,1.1 型IBRV 易引起呼吸道疾病,而1.2 型易引起生殖疾病。IBRV 在西藏、青海、四川等牦牛主产区广泛流行,但还未见对牦牛源IBRV 进行分型的报道[28-32]。本研究检出的7 份IBRV 阳性样品均为1.2 型,发病牛主要表现为呼吸道症状,也有部分牛表现为流产,并且在流产胎盘中也检出了1.2 型IBRV,这也证实了1.2 型IBRV 在该地牦牛中的存在和流行,而且引起的临床症状也发生了变化,因此有必要进一步研究1.2 型IBRV 对牦牛的致病性及其在牦牛中的流行情况,
BAdV-3 也是引起BRDC 的病原体之一,可引起支气管炎和支气管肺炎[33]。BAdV-3 在我国牛群中广泛存在和流行[34-35],但是还未见关于BAdV-3感染牦牛的报道。本研究在发病牦牛的鼻拭子、血液、流产拭子中均检出了BAdV-3,表明该病毒可以引起牦牛的全身感染,并证实BAdV-3 在该地牦牛群中的存在和流行,因而丰富了牦牛BRDC 的病原谱,为牦牛BRDC 的防控提供了参考。
4 小结
本研究通过对发病牦牛进行相关病原PCR 检测及分型鉴定,确诊该起牦牛BRDC 的暴发由1.2型IBRV、BAdV-3 和A 型Pm 感染引起,证实了BAdV-3 与1.2 型IBRV 在该地牦牛中的存在和流行,提示有必要加强这3 种病原的监测和研究。
