苜蓿与根瘤菌专一性共生及可遗传性共生体选育
2023-01-29康文娟刘畅师尚礼
康文娟,刘畅,师尚礼
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中‐美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
根瘤菌(Rhizobium)是一类与豆科植物共生形成根瘤,将大气中的无机氮固定转化为有机氮,从而供给植物营养的有益细菌。苜蓿与根瘤菌的共生固氮作用对苜蓿产量和品质的改善至关重要。草地畜牧业发达国家在种植苜蓿时均普遍接种根瘤菌,然而由于多种内在(如苜蓿基因型和根瘤菌基因型)和外在(主要包括土壤理化因子、草地种植年限、播种方式、根瘤菌剂接种方式和土著根瘤菌等)因素的影响,人工接种根瘤菌剂的结瘤固氮效果不太理想[1]。内生根瘤菌(Endophytic rhizobia)是指定殖于宿主植物不同组织内部,外部不引起任何病理反应,能优先结瘤固氮并具有明显促生作用的内生菌群[2-3]。内生根瘤菌普遍存在于苜蓿种子中,且通过种子进行垂直传播。利用内生根瘤菌的结瘤促生优势及其稳定遗传特性,通过接种构建“根瘤菌-苜蓿”共生体,培育内生根瘤菌苜蓿共生体新种质,是解决人工接种根瘤菌剂低效问题的重要途径,也是推进农业高质量发展的有效措施。笔者从苜蓿根瘤菌共生效应高效利用的角度出发,提出了 “共生育种”的概念,阐述了苜蓿-根瘤菌共生育种的理论基础、实施过程及其一般程序。
1 共生固氮效应的应用现状
土壤氮素供应不足是农业生产中普遍存在的问题。依靠化学肥料解决作物缺氮问题,可在一定时期内促进作物增产。然而,我国已进入高质量发展阶段,应牢固树立绿水青山就是金山银山的发展理念,走可持续发展之路,仅依靠化学氮肥提高作物产量和品质既不符合国家政策,也无益于经济和生态文明建设。1886年,德国植物化学家H.Hellriegel 和 H.Wilfarth 等[4]研究证明豆科植物能固定空气中的氮。1888 年,荷兰学者 M.W.Beijerinck[5]从豆科植物根瘤中分离出第一株固氮细菌纯培养物,并将其命名为根瘤菌(Rhizobium)。从此,关于根瘤菌与豆科植物共生固氮的研究逐渐成为各国学者关注的焦点[6]。共生固氮是指微生物与植物紧密生活在一起,由固氮微生物在与植物共生的状态下直接将大气中的分子态氮转化成化合态氮的过程[7]。广义上,由共生固氮体系产生的对共生双方的生长促进作用以及对共生环境的改良作用即为共生固氮效应,而在豆科植物-根瘤菌固氮体系中,共生效应指共生系统的干物质和蛋白质生产效率[8]。豆科植物与根瘤菌共生固氮体系从空气中固定的总氮量达到 200~400 kg/(hm2·a)[9],极大程度上减少了化学肥料的使用,具有良好的经济和生态效益。
目前,人工接种根瘤菌是提高豆科作物和牧草产量及其品质的重要方法之一,主要是通过播种前拌种或制成包衣种子等方式将适宜的根瘤菌剂接种于豆科作物或饲料作物。1893年,Nobbe 和 Hiltner首次针对德国的豆科作物进行商业根瘤菌剂的生产[10-11],随后美国、加拿大和澳大利亚等国也在种植豆科作物时接种商业根瘤菌剂[12]。我国从1980年开始进行豆科牧草根瘤菌资源的采集、鉴定、保藏、评价及利用研究,研制出了多种商业根瘤菌剂产品[13]。由于根瘤菌株与宿主的匹配性、自然环境差异,土著根瘤菌竞争及多种生物与非生物胁迫等因素显著影响了目标根瘤菌在豆科植物根部接种的成功率[14],导致人工接种根瘤菌剂的效果不佳。而且,与内生根瘤菌相比,“优良植物品种选育-匹配根瘤菌株筛选-根瘤菌剂研制-根瘤菌剂接种”的根瘤菌剂应用程序,一定程度上增加了菌剂载体基质及其他环境因子对植物与根瘤菌株专一性识别因子(如类黄酮、结瘤因子、表面多糖等)的影响[15],可能淡化苜蓿基因型与根瘤菌生物型间的专一性识别及精准性结合,削弱共生固氮体系中豆科植物与根瘤菌的微协调互作过程,限制根瘤菌固氮潜力的充分发挥。
2 共生育种
共生是指一个有机体与另一个不同的有机体紧密接触,并通过长期协同进化产生新的结构和新陈代谢,最终形成的互利关系[16]。有的共生生物需要借助共生来维系生命,属于专性共生(Obligate symbiosis);有的共生只是提高了共生生物的生存几率,并不会对宿主产生影响,属于兼性共生(Facultative symbiosis)。共生关系有时是不对称的,很可能出现一种生物是专性共生而另一种生物是兼性共生的现象。植物与微生物的共生体系主要包括蓝藻共生体系(蓝藻与真菌、苔藓、蕨类、裸子和被子植物)[9]、豆科植物共生体系(根瘤菌与豆科植物)、非豆科植物共生体系(根瘤菌与榆科植物[9]、弗兰克氏放线菌(Frankia)[17]与桤木属、杨梅属、美洲茶属等植物[8])及丛枝菌根真菌(Ar‐buscular mycorrhizal fungi,AMF)共生体系(与禾本科植物等)[18]。
育种是通过创造遗传变异、改良遗传特性,以培育优良生物新品种的技术。育种以遗传学为理论基础,需综合应用生态、生理、生化、病理和生物统计等多种学科知识。植物育种又称为以高产、稳产、优质、高效为目标的品种创制[19]。目前的植物育种方法主要包括聚合育种、诱变育种、杂交育种、单倍体育种、多倍体育种、基因工程(转基因)育种、细胞工程育种、植物激素育种、分子设计育种、组学辅助育种(Genomics-assisted breeding,GAB)[20-21]等。这些植物育种方法均是建立在植物种单独改造的原理之上,以植物自身的遗传基础或基因为研究对象,以植物变异群体(基因或基因组发生了变化的群体)为试验材料,人工选择获得农艺性状优良稳定的植物品种。然而,就牧草育种而言,以“牧草之王”紫花苜蓿(豆科)和“禾草之王”羊草(禾本科)为例,其多倍体遗传、严重的近交衰退、异花授粉、自交不亲和及品种内个体间具有较大的遗传变异和表型差异等特点,严重限制了其功能基因组研究和育种发展[22]。
共生育种(Symbiosis breeding)是指通过两种密切接触的不同生物之间形成的互利关系创造两种生物互利的遗传变异,改良互利的遗传特性,以培育优良共生生物新组合的技术。两种不同生物的共生育种有别于单种生物育种,是生物育种的新技术,对生物育种理论与技术的拓展具有十分重要的意义。
3 苜蓿与根瘤菌共生育种的理论基础
苜蓿与根瘤菌的共生育种是指以“苜蓿-内生根瘤菌”和谐共生、互利共栖的生活方式为基础,以选育的优良苜蓿基因型品种和高效精准匹配的固氮根瘤菌生物型为材料,通过接种将目的根瘤菌生物型导入亲属关系密切的苜蓿基因型品种的植物组织,利用根瘤菌在苜蓿植株体内的运移和定殖特性建构内生根瘤菌种子,并使高效共生固氮特性通过种子在代际间稳定传递的育种方法。
3.1 苜蓿与根瘤菌的共生方式
实现苜蓿与根瘤菌共生育种的关键在于明确二者互利共生的具体方式。依据根瘤菌发挥其共生作用的主要位置及其方式,可将苜蓿与根瘤菌的共生分为:(1)结瘤共生,即根瘤菌在植株根部结瘤并在根瘤内进行固氮共生[22];(2)组织内生共生,即根瘤菌以内生菌的方式生活在未离体植物组织内,增强植物抗逆性[23],并随着植株生长不断运移和定殖到根部进行结瘤固氮[24-25];(3)联合共生,即根瘤菌主要存在于根际土壤[26]或丛枝菌根真菌-植物-根瘤菌的共生体界面[27],二者相互作用共同发挥其固氮、促生、抗逆和土壤修复等功能的过程[28];(4)种子内生共生,即根瘤菌通过结瘤共生、内生共生或联合共生等途径进入并定殖在苜蓿种子内,随着种子发芽优先进入植物组织或土壤,再次以结瘤共生、内生共生或联合共生的方式发挥共生互惠作用[29]。因此,种子内生共生是构建苜蓿与根瘤菌共生体、创制高效固氮共生体新种质的主要方式。
3.2 苜蓿内生根瘤菌的结瘤固氮、抗逆及促生优势
与外源根瘤菌相比,内生根瘤菌受外部自然环境及土著根瘤菌的影响较小,在结瘤竞争等方面有明显优势[24]。从苜蓿植株体内分离的根瘤菌株,回接后依然对植株结瘤能力、生物量和粗蛋白含量有显著促进作用[30-31]。同时,内生根瘤菌对抗生素、盐、pH和高低温等胁迫条件均具有不同程度的抗性[32-34],可有效提高苜蓿植物抗生物胁迫和非生物胁迫能力[33,35]。内生根瘤菌能通过分泌生长素IAA和溶解有机磷、无机磷等促进植株生长[30,36]。祁娟[33]研究发现,分离自不同紫花苜蓿品种的22株内生根瘤菌中有14株能够溶解有机磷,溶磷圈D/d 比值在1.117~2.567;有1株菌能溶解无机磷,D/d比值达到2.31;有73%的菌株具有分泌IAA的能力,其中分泌能力中强以上的菌株占90%[33]。
3.3 苜蓿内生根瘤菌的垂直稳定传播特性
苜蓿种子中存在大量内生根瘤菌,随着种子的萌发和幼苗的生长,内生根瘤菌会不断的运移并定殖在苜蓿植株的不同部位[37-38];其中根毛是根瘤菌分布的主要部位,植株地上部分根瘤菌数量不足根内的0.23%,且仅存在于茎、花芽、花(荚果)。到达花蕾以后,根瘤菌采用两种可能的路径经由繁殖器官垂直传播到下一代植株种子[23]:(1)在现蕾期和花期,存在于花粉表面和子房壁的根瘤菌进入子房壁和珠被的细胞间隙,或通过由花粉萌发后穿过柱头和花柱到达珠被的花粉管进入胚珠;(2)在花期和结荚期,根瘤菌先富集于子房壁,再通过子房壁与胚珠珠被联结的营养输送通道进入胚珠;前者使根瘤菌进入胚珠并迅速增殖,后者使根瘤菌伴随着营养物质一同补充到种子中去[39]。
3.4 植物与微生物的共生育种
目前以植物和微生物共生体为直接对象的育种主要在内生真菌与其共生的禾草植物之间[40-41]。禾草内生真菌通过种子进行垂直传播,具有高效、稳定和安全的种传特性,遗传性状表达稳定[42-43]。这种类似于“可遗传性”的特征是植物内生菌作为植物育种手段为人类所利用的必要保障[44],被誉为“下一代的分子育种”[45]。利用内生真菌对禾草抗性的提升进行的植物、牧草和草坪草育种体系已初步建立,为苜蓿与根瘤菌的共生育种奠定了良好基础。
因此,在内生根瘤菌共生方式和功能如此多样、遗传性状稳定又较容易获得的基础上,利用共生育种的思想,可通过向苜蓿植株导入特异性功能根瘤菌,培育苜蓿植株与目的根瘤菌的共生种质或品种。
4 苜蓿与根瘤菌共生育种的实施过程
4.1 苜蓿根瘤菌种质资源筛选
优良根瘤菌种质资源(主要指高效结瘤固氮根瘤菌株、促进生长根瘤菌株和抗逆性根瘤菌株)的筛选是苜蓿与根瘤菌共生育种的关键。苜蓿根瘤菌的结瘤能力受到苜蓿品种、季节和土壤类型的影响,与苜蓿品种专一性匹配的根瘤菌株在适宜的光、温、水及土壤综合条件下才能发挥较强的结瘤能力和较高的根瘤存活率[46]。促生根瘤菌株是指能够通过固氮、溶磷和/或分泌生长素等促进植物生长的根瘤菌。苜蓿根瘤菌具有较强的溶解有机磷和分泌生长素IAA(3‐吲哚乙酸)的能力,实验室通常采用蒙金娜有机磷和PKO无机磷固体培养基以及比色法对溶磷和IAA能力强的根瘤菌株进行鉴定[47]。抗逆性根瘤菌株包括耐盐、耐酸碱、耐高低温和耐旱等菌株,通过野外根瘤菌分离纯化和室内抗逆性能力测试,可筛选出高抗逆性根瘤菌株,为苜蓿新种质创新和品种选育提供优良根瘤菌资源。甘肃不同生态区域的苜蓿根瘤菌株抗逆性普遍较强,且具有菌株种质和地域差异性[46]。
苜蓿根瘤菌存在着菌株、促生功能和环境分布的多样性,三者之间的协同是苜蓿根瘤菌存在与发展的必然趋势。通过扩大品种和区域范围的研究,可筛选出固氮、促生、抗逆单个功能强大或多个功能兼得、促生效应更加突出的优良菌株资源。因此,优良根瘤菌种质资源的筛选应综合考虑根瘤菌生态分布与固氮、促生、抗逆等方面,采用区域分类→田间调查→分离→初筛选→多功能复筛选的筛选程序。
4.2 苜蓿与根瘤菌共生性状相向变异选择强化
快速、准确地选择苜蓿与根瘤菌种群中具有共生性状相向变异的组合,筛选具有强烈共生优越性的苜蓿品种和根瘤菌株,再通过构建内生根瘤菌苜蓿种子强化共生性状的相向变异,是培育苜蓿-根瘤菌共生新种质的捷径。共生性状相向变异组合的筛选需进行大量根瘤菌株接种苜蓿品种的试验,如将分离自5个紫花苜蓿(Medicago sativa)品种的32株中华根瘤菌(Sinorhizobium meliloti)进行回接,基于主成分分析从14个共生指标中筛选出地上干重为共生效应代表指标,比较分析接种与未接种(CK)苜蓿品种的地上干重差异显著性[8,48]。当接种根瘤菌的苜蓿品种地上干重显著高于未接种CK时,将共生效应标记为“正效应”E(Effective),表明苜蓿品种与根瘤菌株的共生相向性变异强烈;显著低于CK时(P<0.05)标记为“负效应”I(Inhibitive),表明苜蓿品种与根瘤菌株的共生相向性变异较弱;与CK差异不显著时标记为“无效应”O(Noneffective),表明苜蓿品种与根瘤菌株间不存在共生相向性变异[22]。研究发现1株根瘤菌最多可与2个苜蓿品种产生强烈的相向性变异,共生优越性强(图1)。利用苜蓿品种和根瘤菌株专一性相向共生组合构建种子共生体,培育共生种质,可进一步强化优良共生性状的相向性变异,使其随共生种子稳定续传。
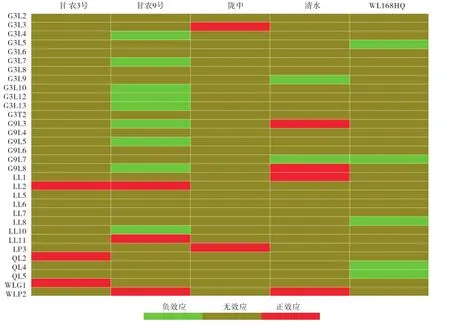
图1 Sinorhizobiun meliloti菌株在5个苜蓿品种上的共生效应Fig.1 Symbiotic efficiency of E.meliloti strains on five alfalfa cultivars
4.3 苜蓿与根瘤菌共生体构建和共生种子培育
苜蓿与根瘤菌共生体构建是通过外部接种使根瘤菌侵入植株体内,运移并大量定殖于苜蓿种子,培育出内生根瘤菌并能稳定结瘤固氮发挥共生效应的种子的过程。前期研究表明,在甘农5号紫花苜蓿花期和结荚期利用花部喷射和根部浇灌方法接种荧光标记根瘤菌gn5f和12531f,收获的种子中均能检测到gn5f和12531f[24-25,49]。在甘农5号和WL343HQ 紫花苜蓿品种植株的不同生育时期,采用适宜的接种方法(如根部浇灌、主根微破损浇灌、花部喷射、荚果皮喷射、切根浸润、切叶涂抹等)、添加适宜的外源物质(如硼、赤霉素、苦参碱、磷酸氢二钾、黄腐酸等)接种荧光标 记 根 瘤 菌RhizobiumLH3436(f3436f)、gn5f和12531f,能在收获初期及保存6个月后的种子中分别检测到 3种荧光标记根瘤菌[25,49-51]。
4.4 共生性状代际间垂直续传及三性检测
苜蓿与根瘤菌共生种子的共生性状在代际间的垂直续传及其“三性检验”,即特异性、一致性和稳定性检测,是验证共生种质培育成功与否的关键。收获含有荧光标记根瘤菌gn5f和12531f的甘农5号紫花苜蓿种子,采用(S1)25 ℃+自然湿度(45%RH)、(S2)25 ℃+硅胶干燥(20%RH)、(S3)4 ℃+冰箱冷藏湿度(55%RH)和(S4)-4 ℃+冰箱冷冻湿度(50%RH)条件贮藏3年后种植,次代苜蓿植株组织和种子中依旧可检测到两种荧光标记根瘤菌[29]。在S1条件下贮藏的内生gn5f的种子和S2条件下贮藏的内生12531f的种子形成的次代植株,其苗期单株结瘤数、根瘤等级、固氮酶活性、单株叶片数、株高、根长、地上鲜重、地上干重、根鲜重、根干重较CK(不含根瘤菌的种子形成的次代植株)分别有不同程度的增长[29],说明内生根瘤菌种子在适宜的条件下贮藏时,其共生性状能够在代际间垂直续传,且次代植株的共生性状明显优于未内生根瘤菌的种子,共生特异性明显,稳定性和一致性较强。然而,内生根瘤菌苜蓿种子的共生性状究竟能续传多少代,特异性、稳定性和一致性如何延续,需要进行更长时间和空间的验证和跟踪。
5 苜蓿与根瘤菌共生育种的一般程序
综上,采用共生性状相向性变异强烈的优良苜蓿品种与根瘤菌株组合进行共生育种,在适宜的外源扰动物质、接种方法和贮藏条件的选择下,构建内生高效结瘤固氮根瘤菌的种子,并通过检验种子内生根瘤菌在植物代际间的传代和功能延续性,可获得良好的苜蓿-根瘤菌共生新种质。
基于多年的苜蓿与根瘤菌专一性相向共生理论研究与实践,提出共生育种的一般步骤为:① 优良根瘤菌种质筛选或创制;②苜蓿品种与根瘤菌共生性状相向性变异选择;③ 目的生物型根瘤菌内栖苜蓿繁殖体形成共生贮主——种子;④ 内栖根瘤菌苜蓿种子稳定保藏条件选择;⑤ 种子内栖根瘤菌代际续传能力和共生效应检验;⑥内栖根瘤菌苜蓿种子后代群体主要性状特异性、稳定性、一致性检验。
