三江源区高寒草地根系-土壤C、N、P生态化学计量特征
2023-01-29王春燕杨冲宋成刚王文颖
王春燕 ,杨冲 ,宋成刚 ,王文颖
(1.兰州大学学报医学版编辑部,甘肃 兰州 730000;2.青海师范大学地理科学学院,青海 西宁810008;3.青海师范大学生命科学学院,青海 西宁 810008)
生态化学计量学是一门研究生态交互作用的新兴学科,是将生态学的研究方法和原理与化学计量学进行结合,对生态系统中的元素分布和元素关系进行研究,以实现生态系统的养分循环和供需平衡[1-3]。碳(C)、氮(N)、磷(P) 作为生态系统最重要的生源元素,对生态系统的结构和功能具有重要的作用,目前,生态化学计量学的研究主要集中在C、N、P 3种元素上[4-6]。
在草地生态系统中,根系是植物的重要组成部分,伴随着根系脱落物、分泌物和溢泌物而产生的C、N、P养分循环对生物地球化学循环有重要的生态学意义[7]。土壤C、N、P是土壤养分的重要组成部分,是植物生长、发育的物质基础,能够控制和调节植物生长的生态过程[8-9]。土壤与根系之间通过物质和信息交换形成了复杂的交互作用关系,因此,研究根系-土壤系统C、N、P的含量变异特征及其动态分布对于揭示草地生态系统养分循环特征具有重要意义。生态化学计量内稳性是生态化学计量学存在的前提和基础,内稳性是指生物体在变化的环境中保持体内元素组成相对稳定的能力,不同的植物种类以及不同的生长阶段和环境,植物的内稳性指数也会发生变化,内稳性指数不仅可以反应植物的稳定性特征以及对环境的适应策略,同时优势种的内稳性强度也是反映生态系统稳定性以及生产力的重要参数,一般来讲,高等植物比低等植物具有更高的内稳性[10-12]。植物对生态化学计量内稳性的调节功能表现为植物对自身的生理和生化分配进行调整以及调节根系对营养元素吸收和释放,通过对植物根系内稳性的研究,可以有效的帮助我们理解植物与环境之间的互馈作用以及植物的生态策略和适应性[13-15]。Bai等[16]的研究发现,氮肥添加会改变植物生态化学计量内稳性与生态系统特性的关系;庾强[17]对内蒙古草原植物化学计量内稳性的研究表明,内稳性指数变动范围很大(1.93~14.49);Chen等[18]研究了我国红壤山区芒萁(Dicranopteris dichotoma)的入侵机制,发现该物种成功入侵贫瘠土壤的主要原因是化学计量内稳性较高;Yan[19]研究了亚热带森林生态系统中马尾松(Pinus massoniana)逐渐消失的原因,发现马尾松P的内稳性低,表明P的限制作用导致马尾草演替后期无法存活。
三江源区位于青藏高原腹地,是我国重要的天然草地,素有“中华水塔”之称,具有重要的经济价值和生态功能[20-21]。近几十年来由于全球气候变化以及人类活动的影响,叠加三江源区生态系统的脆弱性和难恢复性,形成大面积的次生裸地,造成表层土壤C、N、P的大量流失,同时,土壤养分流失导致土地生产力大幅下降,降低了根系与土壤之间的养分输入和周转,这两个过程相互影响相互促进,直接或间接影响根系-土壤系统的C、N、P含量特征和循环过程[22-24]。目前,关于三江源区不同高寒草地根系-土壤生态化学计量特征的研究较少,本研究以三江源区不同类型高寒草地为研究对象,采集各高寒草地土壤、植物根系样品并进行分析,并进行如下2个方面的研究:运用生态化学计量学原理,探究处在不同高寒环境中的植物根系对C、N、P营养元素的响应以及不同类型高寒草地的植物群落在C、N、P养分平衡方面的差异,有助于更好地理解植物对环境的适应机制以及C、N、P养分利用策略。对不同类型高寒草地植物根系化学计量内稳性特征进行探究,了解植物根系内稳性特征对不同类型高寒草地的响应机制以及影响内稳性特征的主要因素,有助于理解和预测不同类型高寒草地根系-土壤系统C、N、P养分的限制条件和循环状况,以期为三江源区高寒草地植被的恢复、保护和利用提供理论依据。
1 材料和方法
1.1 研究区概况
研究地点位于青海省三江源国家自然保护区,E 89°45'~102°23',N 31°39'~36°12',属于青藏高原腹地,海拔3 500~4 800 m,年温差小日温差大,日照时间长,平均年日照时数达到2 500 h,居全国前列,该区气候寒冷,一年只有冷暖2季,没有4季之分,冷季持续时间长达7~8个月,全年无绝对无霜期,属高寒大陆性气候;年降水量262.7~772.8 mm,多集中在5~10月,区内河流密布,湖泊、沼泽众多,是世界上海拔最高、面积最大、湿地类型最丰富的地区;草地类型主要以高寒草原、高寒草甸和高寒湿地为主,局部地区有人工草地分布,畜牧业为当地主要生产方式,放牧家畜主要为藏羊和牦牛(图1)。
图1 研究区示意图Fig.1 Schematic diagram of the study area
1.2 样地设置
本研究中,共设置高寒草原(G1)、高寒草甸(G2)、沼泽草甸(G3)、人工草地(G4)等4种不同类型的高寒草地(表1)。其中人工草地是高寒草甸极度退化后,人工翻耕种植垂穗披碱草的草地。每个草地类型包括3个10 m×10 m的重复样地,重复样地彼此间尽可能使它们有相近的地形、植被和土壤类型(样地之间空间距离1~3 km,避免假重复),这样共计12个样地。G1草地在禁牧区(禁牧年限为7 a),无放牧。G2、G3、G4草地为冬季牧场,均在冷季放牧)。G1草地在玛多县,玛多县主要植被类型为高寒草原和高寒湿地,G2,G3,G4草地在玛沁县,玛沁县主要植被类型为高寒草甸和高寒湿地。

表1 样地详细信息Table 1 Details of sampling locations
1.3 样品采集与处理
2017年8 月中旬,在每个类型样地采用随机步程法设置3个样方,对每个样方用全球定位系统(GPS)进行定位,并用植物样方调查表对植物群落进行调查,然后将样方中的植被齐地面剪下,在剪完植被的样方上用土钻采集根系和土壤样品,测定深度为20 cm,分为2层,每10 cm为1层,重复3次,将3次重复分层混和为1个混合样,然后将土样分层分别用自封袋封装带回实验室,用孔径1 mm土筛进行根土分离,将筛分出来的土样风干进行土壤C、N、P测定。将剩余的土壤、植物根系和石砾等混合物进行清洗,分离出根系,不区分死根和活根,然后置于烘箱65 ℃度烘干至恒重,粉碎研磨过筛(0.25 mm),用于进行根系C、N、P测定。
1.4 测定项目与方法
采用高温外热重铬酸钾氧化-容量法测定植物根系和土壤有机C含量[25],采用半微量凯氏定N法测定植物根系和土壤全N含量[25],采用钼锑抗比色法测定植物根系和土壤全P含量[25]。
1.5 数据处理和统计分析
内稳态理论认为植物体能够维持自身体内化学元素的组成,不随外部环境的变化而剧烈改变,而是将体内化学元素的组成维持在一定的范围内,植物体维持能力高低可用内稳性指数H来表示;H值越高说明植物体保持其体内自身化学元素组成在稳定状态的能力越强,适应环境的能力也越强;反之则说明植物保持其体内自身化学元素组成在稳定状态的能力越弱,适应环境的能力较差。内稳性指数(H)采用生态化学计量内稳性模型计算[26]:

经对数转换后为:

式中:y表示样地中植物根系的C、N、P含量或其化学计量比值,x表示对应的土壤中C、N、P含量或其化学计量比值,c为常数。为方便统计,多用1/H来衡量内稳性的强弱,若拟合方程未达到显著水平(P≥0.05)或 1/H≤0,为严格内稳态;0<1/H<0.25,为内稳 态 ;0.25<1/H<0.5,为 弱 内 稳 态 ;0.5<1/H<0.75,为弱敏感型;1/H>0.75,为敏感型。
数据记录用Excel 2007完成,作图用ArcGIS、GraphPadPrism8完成,数据统计分析用SPSS 21完成,数据方差分析前均进行正态性和方差齐性检验,若不符合则进行对数转换使其满足正态性,利用Lev‐eneTest检验其方差齐性,用方差分析(ANOVA,LSD)比较不同处理间差异显著性,所有检验均在P=0.05水平下进行,用平均值和标准差表示测定结果。用Pearson法进行相关性分析,用MATLAB2017进行内稳性指数的数据拟合。
2 结果与分析
2.1 不同类型高寒草地植物根系C、N、P含量
由图2可知,高寒草原G1、高寒草甸G2、沼泽草甸G3、人工草地G4中0~10 cm根系C含量分别为32.26%、26.42%、28.9%、45.28%,10~20 cm根系C含量分别为32.02%、28.42%、29.27%、44.47%,G4草地0~10、10~20 cm根系C含量显著高于其他3个样地(P<0.05),G1,G2,G3草地相互之间差异不显著;G1,G2,G3,G4草地植物 0~20 cm根系 C平均含量分别为32.14%、27.42%、29.09%、44.88%,G4草地根系C含量显著高于其他3个样地(P<0.05),G3草地植物根系C含量显著高于G1和G2(P<0.05),G1和 G2之间差异不显著。G1,G2,G3,G4草地植物0~10 cm根系全N含量分别为1.87%、1.38%、1.55%、1.17%,G1草地根系全N含量与G3草地之间差异不显著,但显著高于G2和G4草地(P<0.05),G2,G3,G4草地之间相互差异不显著;G1,G2,G3,G4草地植物10~20 cm根系全N含量分别为1.49%、1.29%、1.43%、0.82%,G1,G2,G3草地根系全N含量相互之间差异不显著,但均显著高于G4草地(P<0.05);G1,G2,G3,G4草地植物0~20 cm根系全 N平均含量分别为1.68%、1.33%、1.49%、1.00%,G1草地植物根系全N含量最高且与G3草地差异不显著,G2与G3草地之间差异不显著,G4草地植物根系全N含量最低且与其他3个草地差异显著(P<0.05)。G1,G2,G3,G4草地 0~10 cm 根系全 P 含量分别为0.07%、0.16%、0.18%、0.15%,10~20 cm根系全P含量分别为0.07%、0.11%、0.15%、0.11%,G3草地植物0~10 cm和10~20 cm根系全P含量最高,且与G1草地差异显著(P<0.05),与G2和G4草地相互之间差异不显著,G1,G2,G4草地之间差异不显著;G1,G2,G3,G4草地植物0~20 cm根系全P平均含量分别为 0.07%、0.13%、0.16%、0.13%,G2,G3,G4草地相互之间差异不显著,但均显著高于G1草地(P<0.05)。
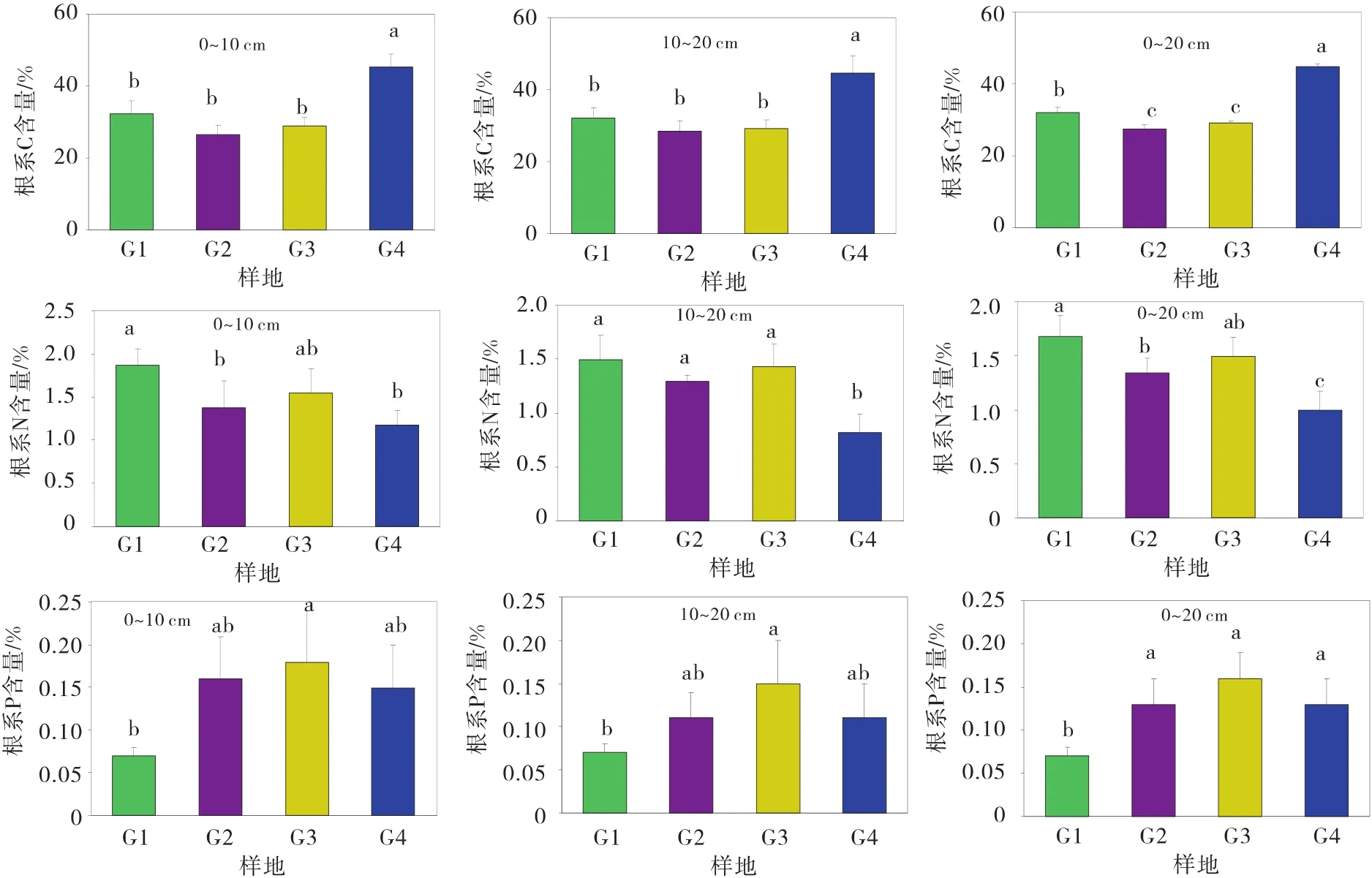
图2 根系C、N、P含量Fig.2 Contents of C,N and P in roots
2.2 不同类型高寒草地土壤C、N、P含量
由图3可知, G1,G2,G3,G4草地中 0~10 cm 土壤有机C含量分别为1.21%、11.25%、16.15%、2.35%,G2和G3草地0~10 cm土壤有机C含量显著高于 G1和G4草地(P<0.05),G2和G3草地差异不显著,G1和 G4草地差异不显著;G1,G2,G3,G4草地10~20 cm土壤有机C含量分别0.8%、7.87%、13.18%、2.18%,0~20 cm土壤有机C平均含量分别为 1.00%、9.56%、14.66%、2.63%,G3草地 10~20 cm土壤有机C含量和0~20 cm土壤有机C平均含量显著高于其他3个草地(P<0.05),G2草地显著高于G1和G4草地(P<0.05),G1和G4草地差异不显著;G1,G2,G3,G4草地0~10 cm土壤全N含量分别为0.14%、0.6%、1.15%、0.36%,10~20 cm土壤全N含量分别为0.13%、0.35%、0.86%、0.31%,在0~10 cm和10~20 cm土层,G3草地土壤全N含量显著高于其他草地(P<0.05),G2显著高于 G1草地(P<0.05),但和G4草地差异不显著,G1和G4草地差异也不显著;G1,G2,G3,G4草地 0~20 cm土壤全N平均含量分别为0.14%、0.47%、1%、0.34%,4种草地相互之间均差异显著(P<0.05);G1,G2,G3,G4草地0~10 cm土壤全P含量分别为0.04%、0.14%、0.17%、0.09%,4个草地相互之间均差异显著(P<0.05);G1,G2,G3,G4草地 10~20 cm 土壤全 P 含量分别为0.05%、0.12%、0.15%、0.08%,G2和G3草地之间差异不显著,G1和G4草地之间差异不显著,G2和G3草地均显著高于G1和G4草地(P<0.05);G1,G2,G3,G4草地0~20 cm土壤全P平均含量分别为0.04%、0.13%、0.16%、0.08%,4种草地相互之间均差异显著(P<0.05)。
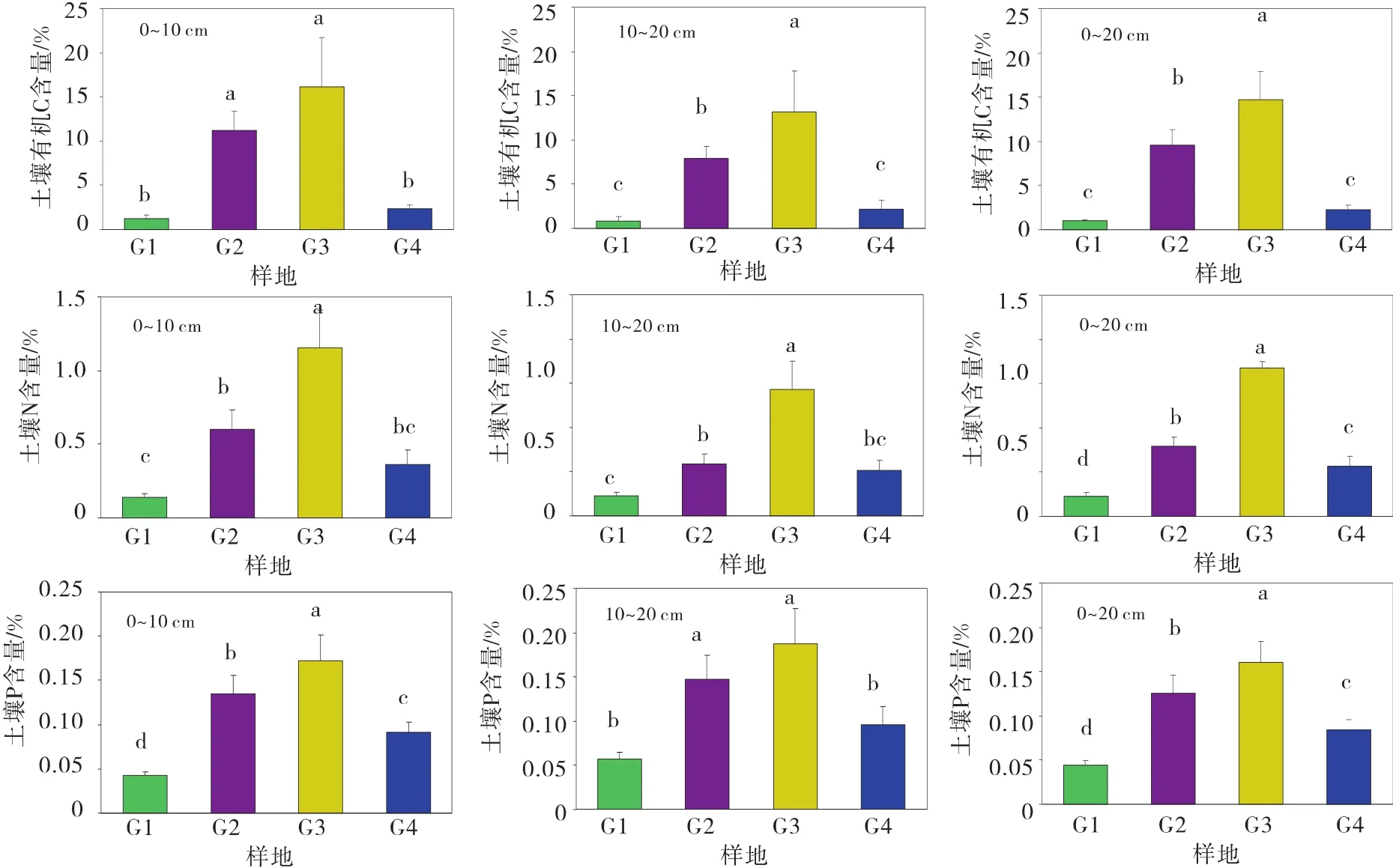
图3 土壤C、N、P含量Fig.3 类 Contents of C,N and P in soil
2.3 不同类型高寒草地植物根系C、N、P化学计量比
由图4可知,G1,G2,G3,G4草地植物 0~10 cm根系C:N值为17.28~39.43,10~20 cm根系C∶N值为 20.85~55.96,0~20 cm根系 C:N值为 19.35~46.02,各草地植物0~10、10~20、0~20 cm根系C∶N值变化规律一致,G4草地C∶N值最高且与其他3个草地差异显著(P<0.05),G1,G2,G3草地相互之间差异不显著。G1,G2,G3,G4草地植物 0~10 cm 根系C:P值为172.18~434.51,G1草地根系C:P值最高且与其他3个草地之间差异显著(P<0.05),G4草地根系 C∶P值显著高于 G2和 G3草地(P<0.05),G2和G3草地差异不显著;G1,G2,G3,G4草地植物 10~20 cm根系C∶P值为211.25~452.74,0~20 cm根系C:P值为183.71~443.03,10~20 cm和0~20 cm根系C:P值变化规律一致,G1与G4草地差异不显著,G2与G3草地差异不显著,G1与G4草地根系C∶P值显著高于 G2和G3草地(P<0.05)。G1,G2,G3,G4草地植物0~10 cm根系N∶P值为8.14~25.16,10~20 cm根系 N∶P值为 7.81~21.37,0~20 cm 根系 N∶P值为7.77~23.14,各草地植物 0~10、10~20、0~20 cm 根系N∶P值变化规律一致,G1草地植物根系N∶P值最高且与其他3种草地差异显著(P<0.05),G2,G3,G4草地相互之间差异不显著。

图4 根系C、N、P化学计量比Fig.4 Stoichiometric ratio of root C,N and P
2.4 不同类型高寒草地土壤C、N、P化学计量比
由图5可知,G1,G2,G3,G4草地 0~10 cm 土壤的C∶N值为6.76~19,G2草地C∶N值最高且与G4草地差异显著(P<0.05),与G1和G3草地相互之间差异不显著,G1,G3,G4草地相互之间差异不显著;10~20 cm土壤C∶N值为5.72~23.55,G2草地C∶N值最高与G3草地差异不显著,与G1和G4草地差异显著(P<0.05),G1,G3,G4草地相互之间差异不显著;0~20 cm土壤C∶N平均值为6.73~20.19,G2草地C∶N值最高且与其他3个草地差异显著(P<0.05),G3草地土壤C∶N值显著高于G1和G4草地(P<0.05),G1和 G4草地差异不显著。G1,G2,G3,G4草地 0~10 cm土壤C∶P值为25.96~92.25,10~20 cm土壤C∶P值为17.02~86.81,G2与G3草地之间差异不显著,G1与G4草地之间差异不显著,G2与G3草地土壤C∶P值显著高于G1与G4草地(P<0.05);0~20 cm土壤C∶P值为22.82~90.63,G3草地土壤C∶P平均值最高且与其他3种草地差异显著(P<0.05),G2草地土壤C∶P值显著高于 G1和G4草地(P<0.05),G1和 G4草地差异不显著。G1,G2,G3,G4草地0~10 cm土壤N∶P值为3.26~6.9,G3草地N∶P值最高且与其他3个草地差异显著(P<0.05),G1,G2,G4草地相互之间差异不显著;10~20 cm土壤N∶P值为2.94~6.02,G3草地N∶P值最高与G4草地差异不显著,与G1,G2草地差异显著(P<0.05);0~20 cm土壤N∶P值为3.09~6.33,G3草地N∶P平均值最高且与其他3种草地差异显著(P<0.05),G1,G2,G4草地相互之间差异不显著。

图5 土壤C、N、P化学计量比Fig.5 Stoichiometric ratio of soil C,N and P
2.5 植物根系-土壤C、N、P含量相关性分析
根系-土壤C、N、P含量间具有一定的相关性。土壤有机C与土壤全N、土壤全P、根系全P含量间呈极显著正相关关系(P<0.01),与根系C含量呈显著负相关关系(P<0.05),土壤全N与土壤全P、根系全P含量间呈极显著正相关关系(P<0.01),土壤全P含量和根系全P含量间呈极显著正相关关系(P<0.01),根系有机C与根系全N含量间呈显著负相关关系(P<0.05)。根系与土壤C、N、P含量之间相互影响,但影响程度以及耦合关系存在较大差异(表2)。

表2 根系与土壤C、N、P含量相关性分析Table 2 Correlation analysis of C,N and P contents in roots and soil
2.6 植物根系-土壤C、N、P化学计量比相关性分析
土壤C∶N与土壤C∶P呈极显著正相关关系(P<0.01),与根系C∶P呈极显著负相关关系(P<0.01);土壤C∶P与根系C∶P呈极显著负相关关系(P<0.01),与土壤N∶P呈显著正相关关系(P<0.05);土壤N∶P与根系C∶P呈显著负相关关系(P<0.05);根系 C∶P与根系 N∶P呈显著正相关关系(P<0.05)(表3)。

表3 根系与土壤C、N、P化学计量比相关性分析Table 3 Correlation analysis of stoichiometric ratios of C,N,and P contents in roots and soil
2.7 植物根系生态化学计量内稳性特征
在G1草地植物根系C含量为内稳态,根系N,P含量以及C∶N、C∶P、N∶P均为严格内稳态;在G2草地植物根系C、N、P含量以及C∶P、N∶P均为严格内稳态,C∶N为弱内稳态;在G3草地植物根系C,N含量以及C∶N、C∶P均为严格内稳态,植物根系P含量为敏感态,N∶P为弱内稳态;在G4草地植物根系C含量以及C∶N、C∶P、N∶P均为严格内稳态,根系N含量为弱敏感态,根系P含量为敏感态(表4)。

表4 根系生态化学计量的内稳性特征Table 4 Internal stability characteristics of roots eco stoichiometry
3 讨论
根系作为草地生态系统中生物能存在的一种形式,积累和储存了大量的养分元素,其凋落分解后将养分归还土壤,直接参与草地生态系统物质循环过程[27]。C、N、P元素在植物体内含量的高低和分布影响着植物的生长发育和群落的动态,根系-土壤C、N、P含量之间的相互关系对植物养分的吸收利用情况及其与土壤间的养分供需平衡关系有很好的指示作用[28-29]。本研究中,高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm根系C含量分别为32.02%、28.42%、29.27%、44.47%,其中高寒草甸和沼泽草甸根系 C 含量与胡向敏等[30]、聂志刚等[31]的研究结果相一致,但明显低于中国草地植物根系C含量的平均值(42.37%)[32],原因可能是高寒草甸和沼泽草甸根系发达,细根及幼根较多,新陈代谢速率较高,需要较高的N、P含量来维持生理活动的正常进行,而吸收利用土壤N、P时需要消耗更多的根系C[33]。高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm根系N含量分别为1.68%、1.33%、1.49%、1.00%,与宁志英等[34]的研究结果相一致,高于全球植物根系N含量平均值和中国草地植物根系N含量平均值(1.11%、0.92%)[32,35]。高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm根系全P含量分别为0.07%、0.13%、0.16%、0.13%,与鄢燕等[36]的研究结果相一致,也与中国草地植物根系P含量平均值(0.1%)[32]较为一致。植物根系较高的N、P水平可能是因为植物为适应高海拔缺氧寒冷的环境在短期内通过根系吸收更多的N、P 来提高生长、发育速率。
土壤是陆地生态系统的重要成分,是植物赖以生存的物质基础,根系与土壤直接接触,是植物生命活动的重要场所[37]。本研究中,高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm土壤有机C含量分别为1.00%、9.56%、14.66%、2.63%,其中,沼泽草甸土壤有机C和全C含量最高,可能是因为沼泽土水分过多,湿生植物生长旺盛,植物根系十分发达,根系生物量较高,且沼泽环境具有明显的积水和低温特征,土壤处于缺氧状态,有机物质分解缓慢,土壤中存在大量未分解或半分解的有机残体[38-39];高寒草原的土壤有机C含量较低,一方面可能是因为高寒草原土壤的沙化程度较高,土壤通透性及含氧量相对较高,土壤呼吸作用强烈,导致土壤有机C有降低的趋势[40],另一方面土壤有机质主要来源于植物地上部分的凋落物及地下的根系,植物每年都有大量有机物质进入土壤,并通过微生物的活动,逐渐变为土壤有机C,而高寒草原植物有着相对较低的地上和地下生物量。高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm土壤全N含量分别为0.14%、0.47%、1.00%、0.34%,沼泽草甸土壤全N含量显著高于其他草地,可能是因为土壤全N的95%来源于土壤有机质[41],而沼泽草甸的土壤有机质含量最高,而高寒草原的土壤全N含量最低,可能与高寒草原有机质含量总体比较低有关。高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm土壤全P含量分别为0.04%、0.13%、0.16%、0.08%,高寒草原土壤全P含量最低,可能是因为土壤P素主要受气候和成土母质的影响,而高寒草原土壤干燥,沙化严重,pH较高,影响了岩土中P素的矿化。
根系C含量与土壤C含量呈显著负相关关系,这与已有的研究结果[42]相一致,说明植物 C的主要来源不是土壤,而是植物的光合作用;根系C含量与根系N含量呈显著负相关关系,这与已有的研究结果[34]一致,可能是因为根系吸收N需要消耗根系C;根系P含量与土壤C、N、P含量呈极显著正相关关系,说明根系P含量受土壤养分状况的影响明显。
植物根系C、N、P等营养元素不单受植物种类自身的内稳态机制的影响,同时还受土壤理化性质、气候条件、外部干扰等因素的影响,植物根系C∶N和C∶P可以反映N、P利用效率和生长速率,N∶P则反映植物受N或P的限制情况[43]。本研究中,高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm根系C∶N分别为19.35、20.68、19.7、46.02,0~20 cm根系 C∶P分别为443.03、208.08、183.71、360.29,与唐仕姗等[44]、张永亮等[45]的研究结果相一致,但不同类型高寒草地根系C∶N和C∶P均低于全国平均水平(59.15和844.07)[32],这说明三江源区高寒草地植物的 N、P 元素利用效率较高,事实上,Reich P B[46]和马玉珠[47]所做的理论工作也证实植物的养分利用效率随着温度的降低、纬度的增加而增加。高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm根系N∶P分别为23.14、10.17、9.28、7.77,高寒草原植物根系 N∶P高于全国平均水平(13.5)[48],其他 3类高寒草地均低于全国平均水平(13.5)[48]。N、P 元素在植物体内含量的高低影响着植物的生长和群落的动态,二者共同限制着植物的代谢过程,其生态化学计量比N∶P对植物养分可获得性及其与土壤间的养分供需平衡关系有很好的指示作用,但不同区域、不同群落的养分限制性元素评判标准并不统一。一般认为[49-51]当植物N∶P>16时,植物的生长受P限制,N∶P<14时,植物的生长受N限制,当14
本研究中,高寒草原、高寒草甸、沼泽草甸、人工草地 0~20 cm 土壤 C∶N 分别为 7.5、20.19、14.56、6.73,全球土壤C∶N平均水平(14.31)[54],我国温带土壤C∶N平均水平为10~12[55],高寒草原和人工草地土壤C∶N较低,说明这两类高寒草地土壤硝酸盐有着较高的淋溶风险[56],再者由于土壤C分解速率与土壤C∶N呈显著的负相关关系,因此土壤C∶N可以作为预测有机质分解速率的一个重要指标。另外土壤C含量受植被凋落物和枯落物养分归还的影响,高寒草原植被稀疏,地上生物量小,凋落物和枯落物输入较少,而人工草地作为冬季牧场以及刈割的原因,地上植被对于土壤的归还作用受到干扰,可能是高寒草原和人工草地土壤C∶N较低的原因。高寒草原、高寒草甸、沼泽草甸、人工草地0~20 cm土壤C∶P分别为22.82、75.99、90.63、27.1,N∶P 分 别 为 3.09、3.81、6.33、4.02,与中国土壤C∶P和N∶P平均水平(61、5.2)[57]相比,高寒草原和人工草地有着较低的C∶P,结合高寒草原、高寒草甸和人工草地N∶P均较低的现象,说明研究区高寒草原和人工草地的有机C含量相对较低,并且高寒草原、高寒草甸和人工草地可能均存在N素有效性低的情况。
本研究中,根系C∶P与土壤C∶N、C∶P、N∶P之间均呈显著负相关关系,说明根系P含量主要受土壤有机C和土壤全P的共同影响;根系C∶P与根系N∶P呈显著正相关关系,进一步说明根系对土壤环境N、P的应对策略会影响根系对C的固存。土壤C∶P与土壤C∶N、土壤N∶P之间呈显著正相关关系,此结果与多数研究结果[58-61]一致,可能是因为土壤C、N通常高度藕合,此外,土壤中的粘土矿物、碳酸盐和有机质能缓慢固定来自基岩的P,反过来,较高的土壤P含量可进一步加强固N作用和有机质的积累过程[62],最终导致土壤C∶P与土壤C∶N、土壤N∶P之间的强相关关系。
生态化学计量内稳性能够较好地反映生物对环境变化的生理和生化适应,不同草地类型其植物根系所表现出来的内稳性特征也不同[63]。本研究中,高寒草原植物根系 C、N、P、C∶N、C∶P、N∶P均具有内稳性,即具有保持其自身化学元素组成相对稳定的能力,可能是因为高寒草原海拔最高,生境严酷,植物受土壤水分和养分的双重限制,种间竞争激烈,根系必须采取一些生理策略努力保持自身化学元素的相对稳定,以便把有限的资源最优地输送到不同结构和功能中,增加植物的生态幅宽度,以适应环境的选择。高寒草甸植物根系C∶N属于弱内稳态,说明高寒草甸植物根系C、N含量受土壤环境的影响较大,但由于根系C主要来源于植物的光合作用,说明高寒草甸的土壤环境通过影响根系对N的吸收能间接影响根系对C的固存。沼泽草甸植物根系P属于敏感态,N∶P是弱内稳态,说明沼泽草甸植物根系N、P均受土壤环境的影响,所以沼泽草甸特殊的过湿土壤环境对莎草科植物等地上植被的生长发育和分布具有决定性的影响,一旦过湿的土壤环境发生退化,地上植被随之发生演替。人工草地植物根系N是弱敏感态,根系P是敏感态,说明二者受土壤环境的影响较大,土壤环境的改变可能会导致人工草地的退化以及毒杂草的入侵,另据报道[64],高寒牧区多年生人工草地建植时的鼠洞平整以及施肥等措施显著改变了土壤的初始环境,但随着建植时间的稀释效应,人工草地普遍存在建植3~5 a后急速退化的现象,因此,作为牧用的人工草地必须进行必要的调控管理。
4 结论
1) 三江源区高寒草原、高寒草甸、沼泽草甸、人工草地植物0~20 cm根系C、N、P含量均值分别为32.02%、28.42%、29.27%、44.47%,1.68%、1.33%、1.49%、1.00%,0.07%、0.13%、0.16%、0.13%;0~20 cm土壤 C、N、P含量均值分别为1.00%、9.56%、14.66%、2.63%,0.14%、0.47%、1%、0.34%,0.04%、0.13%、0.16%、0.08%。
2) 高寒草甸、沼泽草甸、人工草地0~20 cm植物根系N∶P远小于14,尤其是人工草地更为明显;高寒草原N∶P不但远大于16,且大于23。此结果为各草地后续进行植物生长限制因子的判断提供重要的数据基础。
3) 高寒草原植物根系内稳性较高,高寒草甸植物根系C∶N属于弱内稳态,沼泽草甸植物根系P属于敏感态,N∶P是弱内稳态,人工草地植物根系N为弱敏感态,根系P为敏感态。此结果可为分析各草地的退化原因提供判断依据。
