心肌肌球蛋白激动剂治疗心力衰竭的研究进展
2023-01-29吴刘洋严琪琦王利宏
吴刘洋 严琪琦 王利宏
当前,全世界心力衰竭(下称心衰)患者约有2 600万,在美国和欧洲每年需要住院治疗的心衰患者超过100万[1]。我国≥35岁的居民中,心衰患病率为1.3%,约1 370万患者,其中约50%是射血分数降低的心衰(heart failure with reduced ejection fraction,HFrEF)[2-3]。目前,HFrEF的药物治疗已从之前的强心、利尿、扩血管的血液动力学治疗策略,转变为神经内分泌拮抗治疗策略。近些年,一些新型药物如血管紧张素受体-脑啡肽酶抑制(angiotensin receptor-neprilysin inhibition,ARNI)、钠-葡萄糖协同转运蛋白-2(sodium-dependent glucose transporters 2,SGLT-2)抑制剂在HFrEF患者治疗中表现出显著的临床获益,更是在《2021年美国心脏病学会专家共识决策路径:优化心力衰竭的治疗》中推荐使用[4]。尽管目前针对心衰的治疗方法有所进步,但HFrEF发病率和病死率仍居高不下,住院治疗后5年生存率仅为25%,迫切需要新的治疗药物加入心衰治疗中。目前尚在临床研究阶段的新型药物心肌肌球蛋白激动剂(omecamtiv mecarbil,OM)因其独特的作用机制,且能改善HFrEF患者心功能,得到广泛关注。本研究对OM的研究进展作一综述。
1 概述
OM是一种小分子、选择性心肌肌球蛋白的激动剂[5],其能选择性激活心肌肌球蛋白的S1结构域,但不激活骨骼肌、平滑肌的肌球蛋白,提高腺苷三磷酸(adenosine triphosphate,ATP)-腺苷二磷酸(adenosine diphosphate,ADP)能量转换率,从而提高心肌收缩力[6],属于正性肌力药物(图1)。
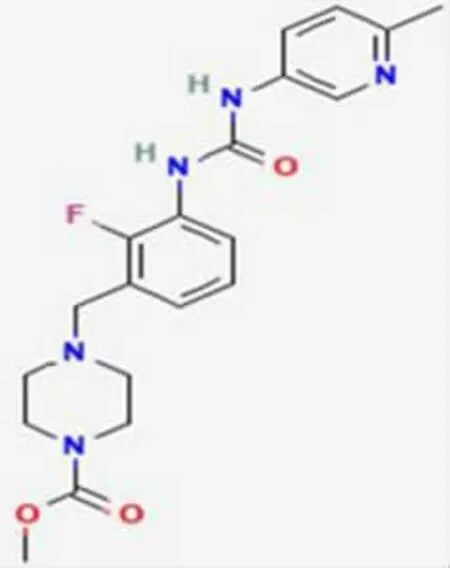
图1 OM的化学结构式
2 相关研究背景
自1775年Withering将毛地黄应用于治疗心衰以来,正性肌力药一直用于治疗心衰患者。从严格意义上,正性肌力药物可定义为在不改变心率和负荷条件下增强心肌收缩性能的药物。然而,负荷条件和心率在心衰患者中并不固定不变,可能会被一些正性肌力药物改变。正性肌力药物有些能增加心率,有些具有直接或间接的血管扩张作用可改变心脏前后负荷。因此,正性肌力药物应用导致心肌收缩性能改善也大部分是由于负荷和心率的变化[7]。目前临床上常用的正性肌力药物,如肾上腺素能受体激动剂(多巴酚丁胺、多巴胺)、磷酸二酯酶抑制剂(米力农)和钙增敏剂(左西孟旦)通过环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和细胞内钙处理机制,增加心肌收缩力,但这些药物的使用与氧耗增加、细胞内Ca2+浓度增加、心率加快、低血压、心律失常和病死率升高有关[8]。理想的正性肌力药包括:(1)应在不改变心功能其他参数的情况下选择性地增强心脏泵血功能;(2)不应大幅增加心脏能量消耗;(3)不应增加心律失常的发生率[9]。由于这些要求很难通过机械收缩上游的相互作用来满足,因此下游步骤肌球蛋白与肌动蛋白结合成为研究的重点。OM正是通过与肌球蛋白的重链结合激活S1结构域从而增加心肌收缩力,且不改变心肌细胞cAMP及Ca2+浓度变化。
3 作用机制
肌节是肌肉收缩和舒张的基本单位。两条相邻Z线之间区域为一个肌节,包括一个位于中间含肌球蛋白(粗肌丝)的A带和其两侧含肌动蛋白(细肌丝)的各1/2的I带。肌球蛋白是骨骼肌、心肌和平滑肌产生力的运动蛋白[10]。心肌肌节的激活可通过调节蛋白对Ca2+敏感或直接激活心脏肌球蛋白实现。OM通过直接激活肌球蛋白这一途径从而增加心肌收缩力。在每次心肌收缩中,肌膜去极化激活L型钙通道使Ca2+内流,Ca2+结合与肌质网膜中的钙结合位点,引起肌质网内Ca2+释放[11]。这个过程称为钙触发钙释放[12]。在舒张状态,肌球蛋白的头部(也称作横桥,具有ATP酶活性)将ATP水解,同时与ADP和磷酸基团(phosphate,Pi)结合,此时横桥对细肌丝中肌动蛋白的结合位点具有高亲和力,当细胞内Ca2+浓度升高,Ca2+与肌钙蛋白结合从而暴露出肌动蛋白上的横桥结合位点,两者结合导致横桥构象改变从而使心肌细胞收缩,同时与横桥结合的ADP和Pi解离,再与ATP结合,结合ATP后的横桥对细肌丝中肌动蛋白的结合位点亲和力降低导致横桥与肌动蛋白分离。分离的横桥再次分解ATP而重复上述过程,即完成1个横桥周期[13]。研究人员将来自牛心脏(心肌)、兔腰大肌(骨骼肌)、鸡胃(平滑肌)中分离纯化得到肌球蛋白、肌动蛋白、肌钙蛋白和原肌球蛋白,重组制备成异源肌钙蛋白-原肌球蛋白调节的肌动蛋白-肌球蛋白复合物,发现OM只选择性激活心肌肌球蛋白的S1结构域,但不激活其他肌球蛋白,即不激活骨骼肌、平滑肌。OM能增加横桥与肌动蛋白结合的数量,加速ATP水解,可提高ATP-ADP转换速率,使肌球蛋白与肌动蛋白从弱结合状态到强结合状态的转变速率加快[6]。从弱到强结合状态的转变是整个肌动蛋白-肌球蛋白ATP酶循环中限速步骤[14](图2),正是OM对肌球蛋白激活作用使心肌收缩力增加。

图2 ATP酶循环过程
4 相关研究进展
在犬心力衰竭模型中,OM的应用使犬心肌收缩力增加,具体表现为左心室缩短分数(fraction shortening,FS)增加,每搏输出量增加,心输出量增加[15]。研究者在健康志愿者中进行了研究,发现OM能使收缩期射血时间、FS和射血分数(ejection fraction,EF)呈剂量依赖性增加[16]。在COSMIC-HF2期试验中,OM治疗20周可增加左心室收缩期射血时间和每搏输出量,缩小收缩末期和舒张末期内径,降低N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平[17]。上述研究结果发现促使3期GALACTIC-HF试验EF≤35%或更低的心衰患者中进行,以此验证OM的有效性及安全性[18]。
GALACTIC-HF 3期试验纳入了8 256例EF≤35%有症状的慢性心衰患者(包括住院患者和门诊患者),在标准心衰治疗基础上分为OM组和安慰剂组,分别接受OM(根据药代动力学决定剂量,25 mg、37.5 mg或50 mg/次,2次/d)或安慰剂治疗。研究观察的主要结局是由首次心衰事件(因心衰住院或紧急就诊)或心血管原因死亡构成的复合结局。随访中位时间21.8个月,两组分别有1 523例(37.0%)和1 607例(39.1%)发生了主要结局事件(HR=0.92,95%CI:0.86~0.99,P<0.05)。两组分别有808例患者(19.6%)和798例患者(19.4%)因心血管原因死亡(HR=1.01,95%CI:0.92~1.11,P>0.05)。在美国堪萨斯城心肌病患者生存质量量表总分相对于基线的变化方面,两组差异无统计学意义(P>0.05)。第24周时,在OM组中,中位NT-proBNP水平相对于基线的变化比安慰剂组小10%;前者的心肌肌钙蛋白I中位水平比后者高4 ng/L。两组的心脏缺血和室性心律失常事件发生率相似。最后得出结论是,在HFrEF患者中,OM组的复合结局(心力衰竭事件或心血管原因死亡)发生率低于安慰剂组。值得注意的是,LVEF<28%的有症状患者的获益更大。但次要终点的结果发现,OM并没有降低心血管死亡、首次因心衰住院和全因死亡的发生率[19]。在对GALACTIC-HF人群进行事后分析发现OM治疗可减少严重心衰患者发生首次心衰事件或心血管死亡时间的复合终点发生[20]。此外,在一项最新的METEORIC-HF研究中,研究人员发现服用OM后HFrEF患者的运动能力并未改善[21]。5展望
虽然近年有大量心衰药物涌现,但多数药物仍处在临床试验阶段,且部分药物的临床试验结果并不乐观,未来需要进一步探究不同药物的机制及临床效果。对慢性HFrEF患者,OM可提高EF和心搏出量,降低心室率;对急性心衰患者,OM显示出剂量依赖性,高剂量药物可改善呼吸困难症状,降低心室率和收缩压,但并不增加临床事件和心律失常的发生率[22]。对于当前治疗选择有限的心衰患者,OM的出现或许给他们带来新的曙光。尽管METEORIC-HF的研究结果不够理想,但研究重点已从最初降低病死率、改善不良反应等硬终点转变到生活质量、运动能力的评价。期待未来有更多关于心衰患者提高运动能力和改善生活质量的研究发表。