后尿道弯曲角度对尿流率的影响及预测下尿路症状患者膀胱出口梗阻的意义
2023-01-29贾旭东
贾旭东,何 文,张 明
(1.首都医科大学附属天坛医院超声科,北京 100069;2.河北医科大学第二医院泌尿外科,河北 石家庄 050000)
良性前列腺增生(benign prostatic hyperplasia, BPH)引起的下尿路症状(lower urinary tract symptoms,LUTS)在老年男性中越来越多见,LUTS最常见的病因为前列腺增生导致的膀胱出口梗阻(bladder outlet obstruction,BOO),其次为膀胱收缩力减低和逼尿肌过度活动等[1]。目前临床公认的诊断金标准为尿动力学参数。BOO的发生机制错综复杂,因此需要对BOO的成因进行更细致全面的分析,发掘出更有临床意义的新诊断指标。分别沿前列腺尿道起始处及垂直于耻骨长轴后尿道末端做切线,两线相交,此角因囊括后尿道因此可称为后尿道弯曲角(posterior urethral curvatyre , PUC)。本研究根据数学模型初步研究PUC与最大尿流率Qmax的关系,并对良性前列腺增生患者的前列腺总体积(total prostate volume,TPV)、移行区体积(transition zone volume,TZV)、移行区指数(transition zone index,TZI)、前列腺突出膀胱程度(intravesical prostatic protrusion,IPP)、前列腺尿道角(prostatic urethral angle,PUA)、前列腺特异性抗原(prostatic specific antigen,PSA)、尿道长度(urethral length,UL)、前列腺症状评分(international prostate symptom score,IPSS)、膀胱出口梗阻指数(bladder outflow obstruction index,BOOI)与PUC之间的相关性进行评估,分析比较其对前列腺增生引起的下尿路症状的诊断价值及预测价值。
1 资 料 与 方 法
1.1一般资料 选取2019年1月—2021年8月就诊于河北医科大学第二医院泌尿外科的男性患者253例,根据患者是否合并下尿路症状,将其分为LUTS组193例和正常对照组60例。所有患者接受了详细的临床评估,包括病史、直肠指检和其他身体检查、国际前列腺症状评分、尿液分析、血清前列腺特异性抗原水平,行腹部超声、经会阴超声和尿动力学检查。
1.2纳入标准与排除标准 纳入标准:有下尿路症状的男性患者,逼尿肌功能正常。排除标准:留置导尿管、前列腺癌或膀胱癌、神经源性膀胱疾病、膀胱炎、膀胱逼尿肌增厚、既往行前列腺手术或盆腔放疗、直肠癌、尿道狭窄、会阴部外伤。
1.3研究方法
1.3.1模型与理论 后尿道弯曲角由θ表示,膀胱压力为P1,后尿道末端的压力为P2,尿道直径为d。尿道起始段尿流速为V1,后尿道末端的尿流速为V2。尿密度设为ρ。为了阐明后尿道弯曲角对尿流率的影响,设定了理想状态下的2个条件:①尿液是不可压缩的流体;②膀胱压力与尿道直径是恒定的。排除了尿道其余部分所产生的因素。后尿道弯曲角的示意图见图1~2。后尿道末端的尿流率(Q)使用以下等式确定:
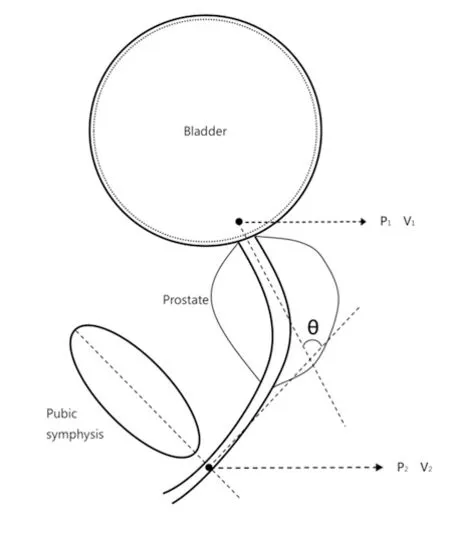
图1 后尿道弯曲角示意图
Q=π(d/2)2V2
(1)
尿流可由纳维尔—斯托尔克斯方程及伯努利方程进行分析。尿液的重力和黏滞力可忽略,为了确定V2,方程可应用如下:
(2)
其中h1和he分别表示尿道壁摩擦损失的能量和后尿道弯曲损失的能量,而摩擦损失的能量极小,在本研究中可以忽略。此外V1=0,P2为大气压既也为0。
he的能量损失定义如下:
(3)
其中弯曲处的损失系数K使用以下等式计算[2]:
k=2.22·10-3θ+4.04·10-6θ2.76
(4)
由(1)、(2)、(3)、(4)可得尿流率Q的公式:
(5)
由公式可以看出尿流率与尿道直径成正比,与后尿道弯曲角成反比。
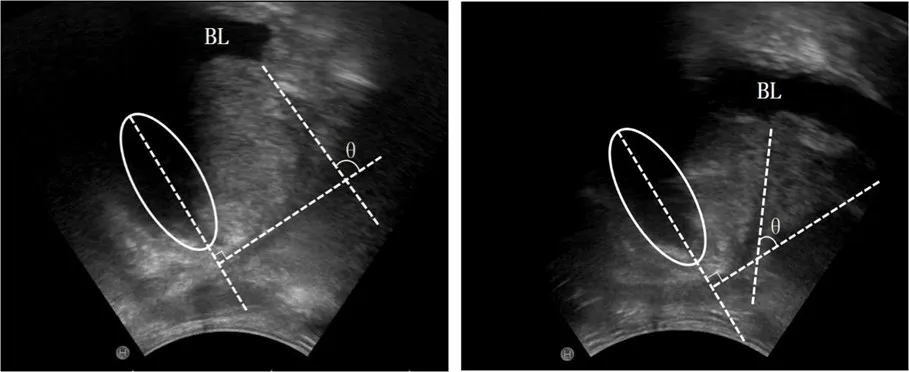
图2 PUC实测示意图 θ=PUC
1.3.2后尿道弯曲角的变化对尿流率的影响 假定膀胱压力为40 cmH2O(1 cmH2O=0.098 kPa),随着后尿道弯曲角从0 °~90 °的变化,计算尿流率的变化率。当后尿道弯曲角从0 °增加至90 °时,尿流率下降约50.9%;当后尿道弯曲角从30 °增加至60 °时,尿流率下降约11.9%;当后尿道弯曲角从30 °增加至90 °时,尿流率下降超过27.4%。
1.3.3超声检查 使用阿罗卡彩色多普勒超声诊断仪。探头在膀胱适度充盈状态下探查前列腺。使用公式计算:TPV=0.52×(前列腺前后径×左右径×上下径)、TZV=0.52×(移行带前后径×左右径×上下径)、TZI= TZV/ TPV。经会阴正中矢状切面清晰显示后尿道并测量长度。根据图1所示方法测量记录PUC。应用经会阴超声测量记录PUA及IPP长度。
1.3.4最大尿流率(maximum free flow rate,Qmax) 采用Laborie Delphis尿动力学检测仪,检测Qmax及膀胱出口梗阻指数BOOI。以BOOI>40为阳性,BOOI<40为阴性。所有患者的最大尿流率数据由同一医师测得。
1.4统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用t检验和U检验,计数资料比较采用χ2检验,采用ROC分析LUTS组后尿道弯曲角度预测BOO的敏感度、特异度及分界点,采用Pearson相关系数(r)进行相关性分析,多元线性回归分析研究BOOI与相关临床参数的关系。P<0.05为差异有统计学意义。
2 结 果
2.1LUTS组与对照组的参数比较 2组PSA 、TPV、TZV、TZI、IPSS、Qmax、BOOI、IPP、PUA、PUC差异有统计学意义(P<0.05);2组年龄及UL差异无统计学意义(P>0.05)。见表1。
表1 LUTS组与正常组的参数比较
2.2PUC<48 °和PUC≥48 °患者相关参数比较 PUC预测BOO的ROC曲线下面积为0.867(95%CI:0.816~0.918),诊断BOO的截断值为48 °,敏感度为88.1%,特异度为75.8%,见图3。根据截断值将LUTS组分为PUC<48 °组与PUC≥48 °组,PUC大的患者(PUC≥48 °)TPV、TZV、TZI、IPP、PUA、IPSS、BOOI更大,Qmax更低(P<0.01)。2组年龄、PSA、UL比较差异无统计学意义(P>0.05),见表2。
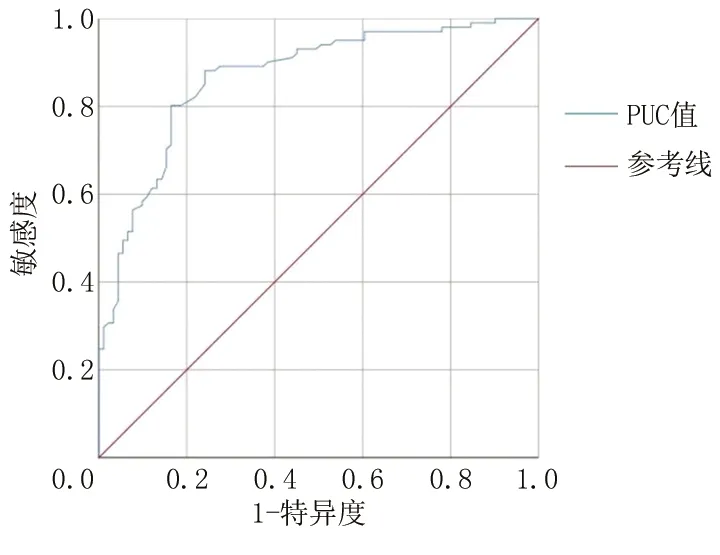
图3 PUC预测BOO的ROC曲线图
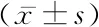
表2 PUC的临床参数
2.3PUC与各指标的相关性分析 将患者的TPV、TZV、TZI、UL、PSA、IPP、PUA、IPSS、Qmax、BOOI与PUC进行Pearson相关因素分析。结果显示TPV、TZV、TZI、IPP、PUA、IPSS、BOOI与PUC呈正相关(P<0.05)。Qmax与PUC呈显著负相关(P<0.05)。UL、PSA与PUC无相关性(P>0.05),见表3。
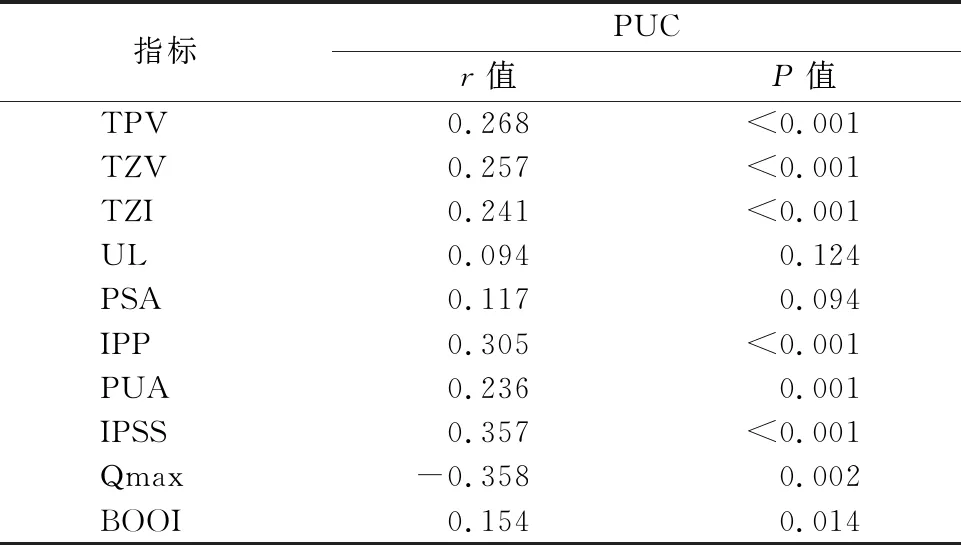
表3 PUC与各指标的相关性分析
2.4BOOI的多元线性回归分析 将TZV、TPV、Qmax、PUA、PUC这些变量纳入多元线性回归中进行分析,结果显示TPV、TZV、Qmax、PUA、PUC是BOOI的主要影响因素。见表4。
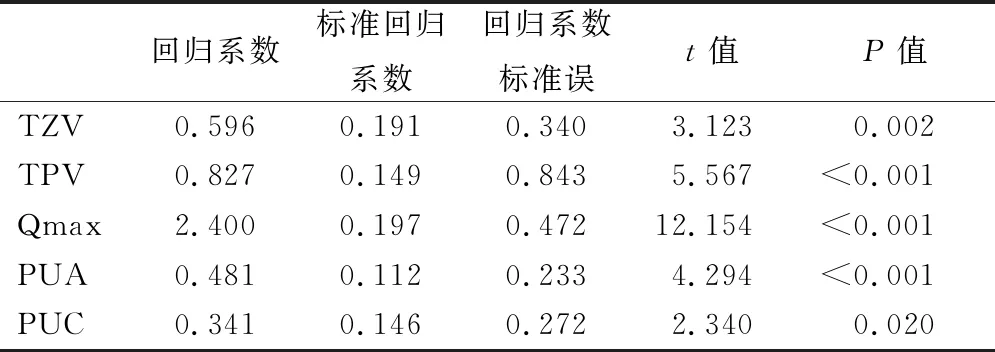
表4 BOOI的多元线性回归分析
3 讨 论
本研究使用流体动力学方法研究后尿道弯曲角对尿流率的影响。Kim等[3-4]已经对尿道中的尿流动力学进行了研究,结果显示排尿过程中通过PUA时能量发生损失,从而导致尿流速的下降。根据数学模型初步研究PUC与尿流率成反比;随着PUC增加,尿流率可能会有明显下降。此外,临床研究也显示Qmax与PUC有相关性,同时PUC也与TPV、TZV、TZI、IPP、PUA、IPSS、BOOI显著相关。
下尿路症状在老年男性患者中越来越多见,不但患者的生活质量受其影响大大降低,而且可能进一步造成膀胱结构功能的不可逆改变,导致更严重的症状。BOO是LUTS发生的最常见原因,前列腺尿道梗阻的程度对于确定LUTS患者的治疗方式及判断治疗后的结果非常重要。但是其作用机制影响因素多,各因素之间错综复杂,虽提出了如“球阀”阻塞理论、尿道压迫等理论[5],目前仍然没有公认的定论。尿动力学检查是评估BOO的金标准[6],这是唯一一项提供BOO可靠且可复制证据的研究。尿动力学检测可诊断包括梗阻和(或)逼尿肌过度活动等男性LUTS的病因,但该检查可能出现血尿、尿路感染等不良反应,不良反应的总发生率达19%[7],而且需要同时进行膀胱和直肠插管,操作繁琐。因此如何准确预测BOO程度成为目前的研究重点。
BOO和PSA之间的关系已经被证实,研究显示PSA为4~6 mg/L的男性患BOO的可能性为65%;PSA为6~10 mg/L的男性患BOO的可能性为81%;PSA≤4 mg/L不是BOO的可靠预测指标[8]。使用PSA作为BOO的预测指标并不完全可靠,因为其也可能因前列腺癌而升高,因此,PSA升高的男性患者也需要评估是否存在前列腺癌。
膀胱残余尿(post-void residual urine,PVR)是临床最常用的评估参数。PVR具有重复性好,测量方便的优点,并且可以一定程度上反映BOO的严重程度,BOO患者的PVR通常增加,多是由于逼尿肌收缩力不足引起。此外,1/3患有BOO的男性不会有明显的PVR。PVR在临床测量中会受到膀胱充盈程度、患者主观意愿、操作者测量手法等多种因素影响,导致测量误差较大,诊断准确性较低。
Lee等[9-10]显示使用超声检测膀胱质量(ultrasound estimated bladder,UEBW)来预测BOO准确性可达87.9%,并且简单无创。但由于与前列腺增生的临床参数相关性不强,测量误差也较大,限制了其在临床中的普及。膀胱壁厚度(bladder wall thickness,BWT)及膀胱逼尿肌厚度(detrusor wall thickness,DWT)受到了持续而且广泛的关注, Chen等[11-12]显示94%的BOO患者在膀胱充满到最大容量时DWT>2 mm,其诊断BOO的准确率接近90%。然而,炎症、肿瘤、膀胱充盈度等因素均会影响测量,导致测值不准确,但在结合IPP的BPH临床分期中,作为辅助测量可能仍然有用。
BPH多发生于移行区和尿道周围腺体区,前列腺腺体和间质成分增生,引起前列腺体积增大,从而向内挤压尿道并且向外膨入膀胱,导致排尿困难等症状。大体积前列腺若没有向内挤压尿道,则尿道路径不会发生受压移位,亦不会引起BOO。若增生前列腺挤压尿道从而导致尿道路径位移,小体积前列腺也可引起BOO。有研究显示PV与梗阻程度无相关性[13]。本研究中显示PV与Qmax相关性小于后尿道弯曲角与Qmax的相关性。对于预测膀胱出口梗阻的指标,IPP比前列腺体积更加精准。Yaris等[14]研究显示前列腺增生患者的下尿路症状加重,PUA角度增大也许是其重要原因。PUA增大即表明膀胱颈抬高挤压尿道使膀胱出口梗阻,从而加重BPH患者的下尿路症状[15]。Boulma等[16]认为BOO时“球形瓣”的形成,是由IPP引起的,与此同时IPP也阻碍了膀胱排尿时的运动。正中叶增大导致前列腺尿道角度增加,前列腺尿道角度增加被认为是导致运动障碍以外的因素的原因。PUC角度的增加可能加重BOO患者膀胱出口梗阻。而从测量原理的角度考虑,PUA增大必然导致PUC增大。本研究中也表面IPP与PUC有明显相关性。
从流体动力学角度考虑,尿道的动力影响因素主要有腹内压、膀胱质量、膀胱壁厚度、逼尿肌厚度等,影响尿道的阻力因素包括前列腺体积大小形态、膀胱颈开口处角度大小、膀胱颈变形、尿道的弯曲程度、尿道内壁的摩擦系数等,这些都会影响尿道排尿。尿道是尿液排出的必经之路,尿道的形态走形内径会直接影响尿流率。本研究的研究重点就是尿道的弯曲程度对排尿的影响。使用经会阴超声可以清晰显示前列腺尿道及尿道膜部,以尿液作为声窗可使得前列腺尿道起始处清晰显示,而尿道膜部在会阴部更接近体表因此显示清晰,这就为后尿道弯曲角测量提供了便利。PUC的变化范围较PUA大,而且更方便测量,这也使PUC成为一个潜在评估指标优势。本研究中排除各种因素,首先通过数学模拟证实了PUC对尿流率的影响,然后通过临床研究,证明PUC与Qmax有相关性(r=-0.358,P=0.002),而且TPV、IPSS、PUA等都与PUC正相关。
本研究仍有很多局限性。在排尿过程中,尿道的解剖结构会发生改变,而PUC是在静止状态下测量的,因此不能反映真实排尿状态。而且也没有考虑尿道管径对尿流率的影响。虽然这个数学模型很简易且包含很多限制,但为前列腺增生的诊断及下尿路症状的评估提出了新的角度,且在临床工作中容易实现,前列腺尿道起始处有膀胱作为声窗且后尿道末端贴近探头所以显示均较清晰,这使得后尿道弯曲角易于测量。
本研究根据数学模型初步研究PUC与尿流率的关系,并对良性前列腺增生患者的BOO与PUC之间的相关性进行评估,比较其在前列腺增生中的诊断价值及预测价值。初步判断经盆底超声测量PUC可以作为评估下尿路症状的预测方法,有利于临床的广泛使用,需要进一步的研究。
