百脉根不定根发育相关基因LcC2DP1的克隆与功能初步分析
2023-01-19马思宇肖芳斌罗雪韦飘宋莉
马思宇,肖芳斌,罗雪,韦飘,宋莉
贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室/贵州省农业生物工程重点实验室,贵阳550025
植物根系具有固持地上组织和吸收水分、养分的双重功能[1],在植物生长发育过程中发挥重要作用[2]。根系的生长状态和分化速度直接影响牧草的长势和产量[3-4]。牧草根系的发育受多种内外环境因子的影响,由蛋白激酶(protein kinases, PK)介导的激素信号途径是其中的主要调控途径[5-6]。蛋白激酶是催化蛋白质磷酸化反应的酶,广泛参与细胞信号感知[7]、传导[8]、基因表达[9]、生长发育调控[10]等过程。根据催化域氨基酸序列的不同,蛋白激酶分为AGC、CaMK、CMGC、PTK和其他共5个类型[11]。CaMK中的C2钙依赖蛋白激酶(C2 calciumdependent protein kinase, C2CDPK)是一类含有C2结构域的蛋白。钙依赖蛋白激酶(CDPK)依赖于Ca2+催化磷酸化反应[12],参与细胞信号转导过程[13]。研究表明,CDPK参与植物根系的生长发育调控,定位于细胞膜的拟南芥CDPK编码基因CPK29参与侧根形成调控[9],苜蓿MtCDPK1表达促进根毛的正常生长[14],水稻OsCDPK5在淹水条件下能保证根系通气组织的正常形成[15]。C2结构域蛋白主要定位于人类和动物的细胞膜系统,具有参与磷脂第二信号产生、GTP酶激活和控制蛋白质磷酸化等重要功能[16-17]。近年来,植物C2CDPK的研究已逐渐受到关注[18-19]。研究发现小麦的C2CDPK基因TaC2DP1在干旱、低温和热胁迫中发挥重要作用[20],旋蒴苣苔的BhC2DP1基因参与脱落酸(ab‑scisic acid, ABA)信号途径调控根的生长[21]。尽管如此,人们对植物C2CDPK的了解仍极为有限。
百脉根(Lotus corniculatusL.)是一种优质的多年生豆科牧草,也是一种良好的蜜源和护坡固土植物,其由匍匐茎发生的不定根所构成的根系系统十分发达。本研究通过RACE扩增法克隆Leo百脉根C2CDPK编码基因LcC2DP1,利用qRT-PCR技术检测该基因的组织表达特异性,通过农杆菌介导的瞬时表达系统对其不定根分化调控功能进行初步分析,以期为揭示百脉根根系发育调控机制提供依据。
1 材料与方法
1.1 材料
所用植物材料为百脉根(Lotus corniculatus‘Leo’),种植于贵州大学贵州省农业生物工程重点实验室试验田。农杆菌(Agrobacterium tumefaciens)菌株GV3101和pSH737植物表达载体均保存于笔者所在实验室。
1.2 LcC2DP1基因克隆
笔者所在课题组前期分析百脉根不定根发育转录组数据[22]中发现,12个C2结构域激酶基因家族成员在不定根发育过程中持续上调表达,其中的LcC2DP1(Lc1g3v0026680)表达最为显著,本研究对该基因进行进一步研究,克隆引物(表1)采用Prim‑er Premier 5.0软件设计,提取百脉根茎、叶、根的总RNA混合反转录成cDNA后作为模板,按照5′RACE和3′RACE试剂盒(TaKaRa, 大连)提供的操作方法进行两轮巢式PCR扩增,首轮PCR产物稀释50倍后取1 μL作为第二轮PCR的模板。50 μL反应体系为:cDNA模板1 μL、引物各2 μL、Taq酶0.5 μL、Buffer 5 μL、2H2O补足体系;PCR反应程序为:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35次循环后再72 ℃ 延伸10 min,之后对PCR产物进行凝胶分离和回收测序。根据已知序列和5′ RACE、3′ RACE测序结果,拼接目的基因全长序列,分析起始和终止密码子位置。根据RACE扩增序列设计2条全长扩增特异性引物(表1),以百脉根cDNA为模板扩增LcC2DP1基因,扩增条件为:94 ℃ 预变性2 min;94 ℃ 变性30 s,55 ℃ 退火30 s,68 ℃延伸1 min,35个循环;68 ℃ 延伸10 min。PCR扩增片段与pMD18T载体连接,热激法转化大肠杆菌DH5α后送生工生物一程(上海)公司测序。
表1 RACE和全长基因克隆扩增引物序列Table 1 RACE and full length gene cloning amplification primer sequence
1.3 LcC2DP1基因结构分析
使用相关的生物信息分析在线工具进行LcC2DP1基因的分子特征分析,其中,理化性质(蛋白质分子质量、等电点、分子式)采用ExPASy Prot‑Param tool(https://web.expasy.org/protparam/)、编码蛋白的亲疏水性采用Protscale(https:∥web.ex‑pasy.org/protscale/)、蛋白结构分析采用SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/)和SWISSMODEL(https://swissmodel.expasy.org/)进行。利用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bio‑inf/plant-multi/)对LcC2DP1基因进行亚细胞定位预测。利用BEDTools[23]获得LcC2DP1基因上游2 000 bp序列(Lotus corniculatusgenome assembly build 3.0)[24],利用在线网站PlantCARE对获得的序列和顺式作用元件进行分析。使用NCBI的BLAST工具筛选出LcC2DP1同源序列后用MEGA X中邻位相连法构建系统发育进化树。
1.4 LcC2DP1基因表达分析
为探究LcC2DP1在百脉根不同组织和不同时期中的表达情况,分别收集Leo百脉根的根、茎、叶以及不定根形成过程中0、3、6、9、12 d根部组织为样本。以百脉根UBI(DQ249171.1)作为内参基因,通过IDT(https://sg.idtdna.com/site/home/home/ses‑siontimeout)在线软件设计LcC2DP1和UBI的扩增引物(表2)。使用实时荧光定量PCR仪(CFX96)检测LcC2DP1基因的时空表达特性,反应体系和反应程序根据TIANGEN miRcutemiRNA试剂盒的说明进行。采用2-△△Ct方法[25]分析基因相对表达量。
表2 qRT-PCR检测引物序列Table 2 Primer sequence used in qRT-PCR detection
1.5 植物表达载体构建及遗传转化
利用限制性内切酶EcoRⅠ和XbaⅠ(TaKaRa, 大连)分别酶切pSH737和pMD18T- LcC2DP1质粒,酶切片段回收后用T4DNA连接酶(TaKaRa,大连)4 ℃连接过夜,构建LcC2DP1基因的植物表达载体,该基因由35S启动子驱动表达,以GUS::NPTII作为报告基因和筛选基因。采用YEP液体培养基培别采用GUS组织化学染色和RT-PCR进行转化鉴定。采用视显微镜(OOX-86)进行拍照,利用根系扫描仪(Epson)和根系分析软件(Win Rhizo)对总根长、根尖数、根系总表面积、根体积和根平均直径等根系指标进行观察及统计分析。
1.6 数据统计与分析
数据统计和显著性分析分别采用Excel 2016软件和DPS 7.05软件,并采用GraphPad Prism 8.2软件进行作图。
2 结果与分析
养所获得的阳性工程菌至对数生长期。参照杨少彤等[26]的方法,通过真空渗透法进行百脉根枝条瞬时转化。转化条件为在12 kPa处理10 min,快速释放压力,再次重复处理1次。每组15株样品,重复3次。以携带GV3101-pSH737质粒转化植株作为对照,分
2.1 LcC2DP1基因克隆
基于百脉根不定根分化转录组筛选的Lc1g3v00 26680序列,对LcC2DP1基因进行RACE扩增,获得的LcC2DP1全长为705 bp,编码235个氨基酸,该序列上游有起始密码子ATG,下游有终止密码子TGA。为了验证拼接序列的正确性,设计引物对LcC2DP1编码区进行扩增,得到1条约700 bp的特异性条带,序列测定结果表明LcC2DP1编码区与拼接结果序列完全一致(图1)。
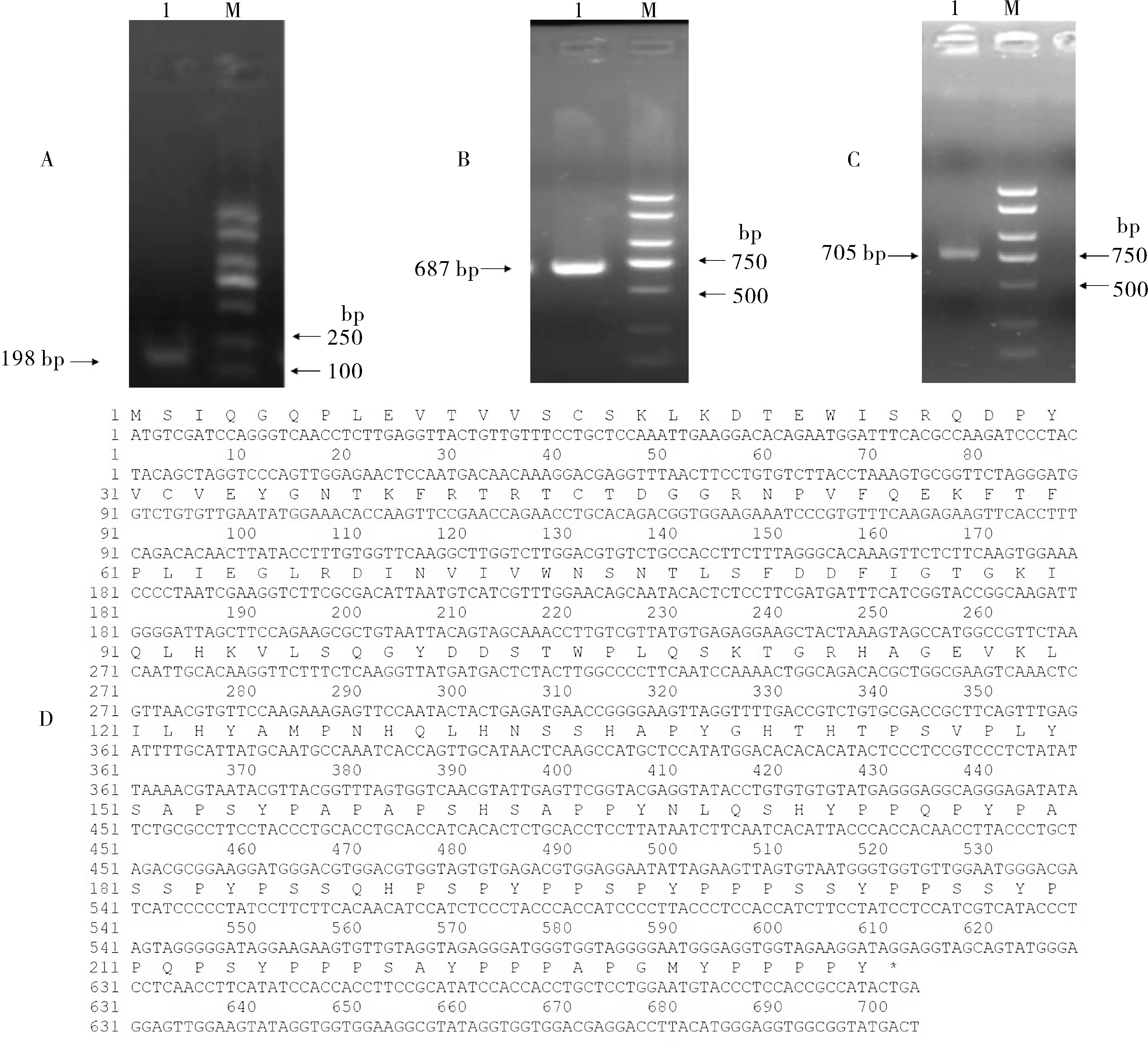
图1 LcC2DP1基因克隆及拼接翻译Fig.1 LcC2DP1 gene amplification and mosaic translation
2.2 LcC2DP1的理化性质
对LcC2DP1基因结构进行分析,结果显示,其编码蛋白含235个氨基酸,相对分子质量为25 952.03,理论等电点为7.17,分子式为C1185H1737N305O344S6,脂肪指数为53.91,不稳定性指数为85.47,是一种不稳定蛋白。对LcC2DP1蛋白质进一步分析,发现其亲水性氨基酸较疏水性氨基酸多(图2A),推测该蛋白属于亲水性蛋白。在LcC2DP1蛋白的二级结构中,α螺旋有19个氨基酸(占8.15%),无规卷曲有175个氨基酸(占75.11%),延伸链有39个氨基酸(占16.74%)(图2B),可确定该蛋白二级结构主要以无规卷曲为主。利用Plant-mPLoc在线分析软件,对LcC2DP1进行亚细胞定位预测,结果显示,LcC2DP1定位在细胞核和细胞膜上(图2C)。用Swiss model对LcC2DP1蛋白进行三级结构预测,结果显示,LcC2DP1蛋白结构包含大量的无规卷曲(图2D),这与预测的二级结构结果一致。对LcC2DP1的全长蛋白序列进行Blast比对并构建系统进化树,结果显示,LcC2DP1与蒺藜苜蓿蛋白同源性最高,为82%(图2E),暗示C2结构域在豆科植物中进化较为保守。
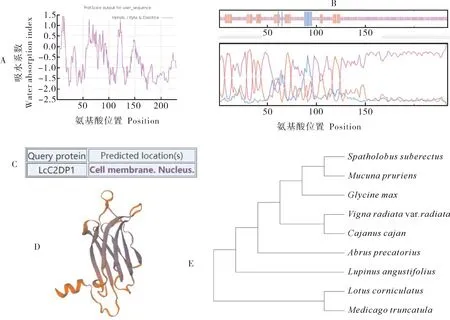
图2 LcC2DP1 基因分子特性Fig.2 Molecular characteristics of LcC2DP1 gene
2.3 顺式作用元件类型
提取百脉根LcC2DP1基因上游2 000 bp序列进行顺式作用元件分析,结果(表3)显示,百脉根LcC2DP1基因除了含有启动子和增强子区域最基本的CAAT-box元件以外,还含有光响应元件(Box-4、AT1-motif、GT1-motif)、转录起始核心启动子元件(TATA-box)以及干旱诱导相关(MBS)的多种顺式作用元件。
2.4 植物表达载体构建
扩增LcC2DP1基因片段,与pSH737植物表达载体连接,双酶切鉴定结果显示,重组质粒酶切后出现705 bp的目的基因条带(图3A)。GV3103农杆菌转化菌株的PCR扩增检测显示,菌体中能扩增出705 bp的LcC2DP1基因条带(图3B),表明植物表达载体pSHLcC2DP1和携带LcC2CDP1基因的工程菌构建成功。

图3 植物表达载体双酶切及农杆菌PCR电泳检测Fig.3 The electrophoretic detection on double enzyme digestion of plant expression vector and PCR of Agrobacterium tumefaciens liquid
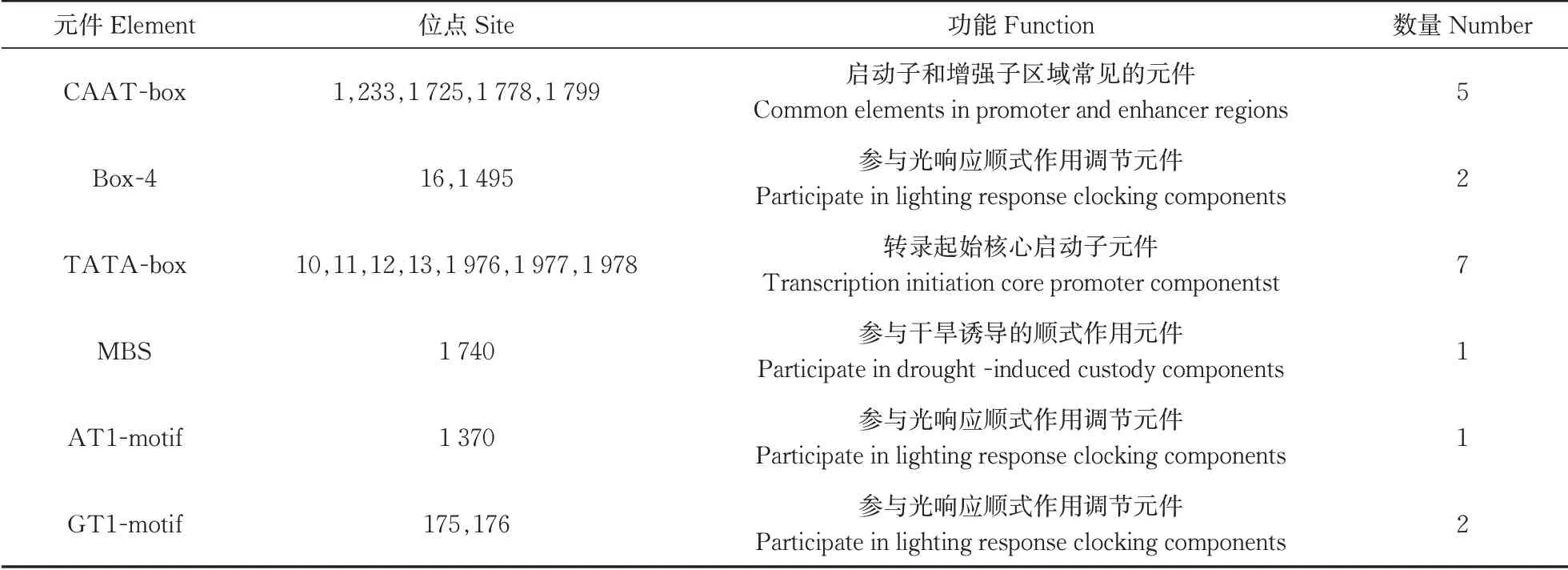
表 3 LcC2DP1基因的主要顺式调控元件Table 3 The main cis-regulatory elements of LcC2DP1 gene
2.5 LcC2DP1基因的表达特征
通过qRT-PCR分析LcC2DP1基因在百脉根不同组织及不定根分化期间的差异表达情况,发现相较于内参基因UBI,LcC2DP1基因在根、茎、叶中均有表达,但主要表达部位为根(1.00±0.00)和茎(7.57±0.36),在叶中表达量(0.15±0.03)最低(图4A)。当瞬时转化后,LcC2DP1基因在百脉根根(相对表达量为6.51±0.32)、茎(相对表达量为9.65±0.35)、叶(相对表达量为0.34±0.06)中表达量均增加,以根中表达变化量最为显著(P<0.01)(图4A);不定根分化的0~9 d,野生型植株(WT)和转LcC2DP1植株(TP)的LcC2DP1基因表达量均逐渐上升,但TP相较于WT变化显著(P<0.05),其中3 d时为1.26±0.09,9 d时表达量最高(2.68±0.35),之后表达量下降,TP同期表达量均高于WT(图4B)。
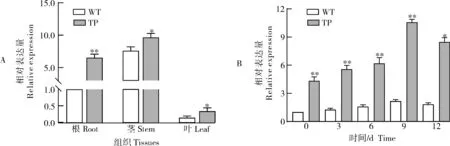
图4 LcC2DP1 基因表达特异性Fig.4 LcC2DP1 gene expression specificity
2.6 LcC2DP1基因在不定根分化中的作用
采用农杆菌介导的真空渗透法将植物表达载体pSHLcC2DP1转化到百脉根中。GUS组织化学染色显示,外源基因转化后3~15 d均可观察到百脉根叶片显示蓝色,外源基因瞬时转化百脉根后可在叶片和根部组织有效表达,随着时间的延长蓝色逐渐加深,到第9天时蓝色最深(图5A),之后蓝色逐渐变浅,外源基因功能鉴定可在转化后15 d内进行。形态学观察发现第6天时不定根形成,之后根系逐渐增多(图5B),利用RT-PCR对转化后9 dLcC2DP1基因转录情况进行检测,发现外源基因有表达(图5C)。
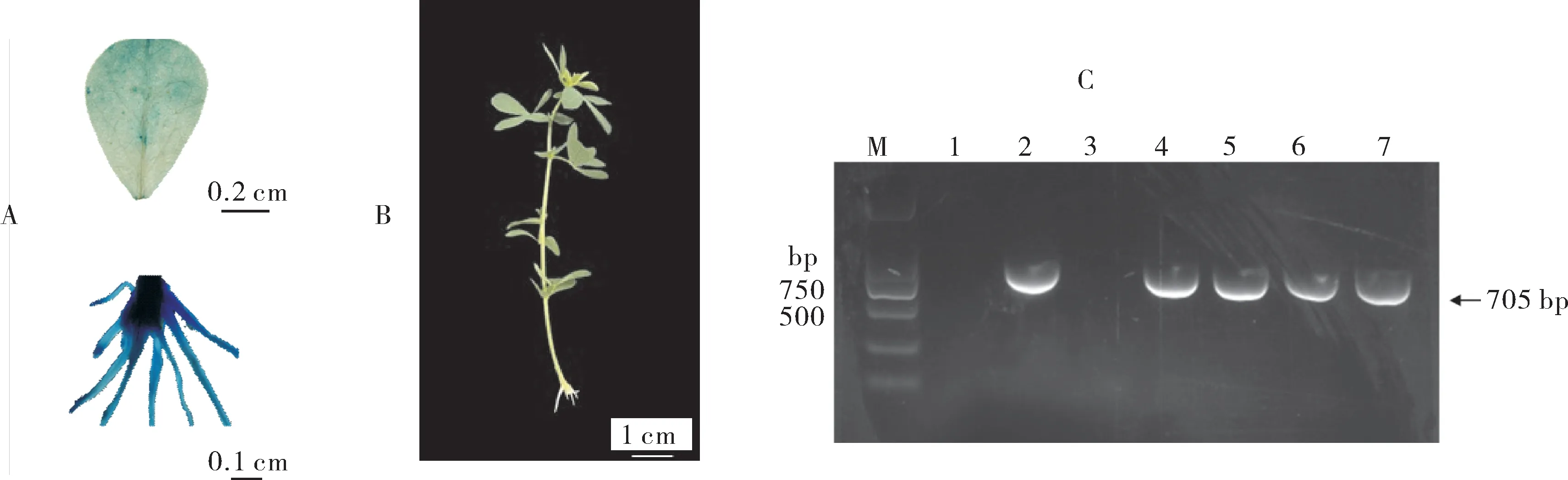
图5 不定根分化9天时的转基因植株观察与鉴定Fig. 5 Observation and identification of transgenic plants after adventitious root differentiation for 9 days
由图6可见,TP植株在第6天时观察到不定根开始分化,比野生型亲本(WT)提前1~2 d形成根系。在第12~15天TP植株根系总根长、根尖数、根体积均显著高于WT植株。12 d时TP植株根系总根 长为(4.28±0.22) cm,是WT的168%,15 d为(7.74±0.23) cm,是WT的155%(图6A);12 d时TP植株根体积为(0.016 7±0.001 2) cm3,是WT的249%,15 d时 为(0.040 3±0.003) cm3,是WT的161%(图6B);12 d时TP植株根尖数为(8.30±0.88) ,是WT的156%,15 d天时为(12.33±0.88),是WT的137%(图6C)。同一时期的TP与WT的根系总表面积(图6D)和根平均直径(图6E)差异不显著。TP百脉根在总根长(P<0.01)、根体积(P<0.05)和根尖数(P<0.05)上表现出一定的根系发育优势,LcC2DP1基因的表达可能与百脉根的不定根发育有关。
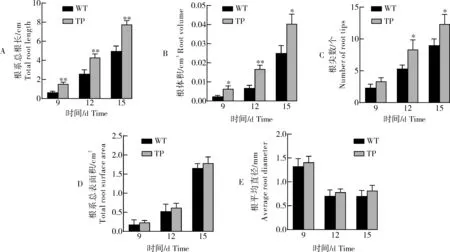
图6 百脉根不定根分化9~15 d期间的根系发育指标比较Fig.6 Comparison of root development indicators of the Lotus corniculatus during 9-15 days
3 讨论
C2结构域蛋白作为与钙离子结合的一类功能型蛋白,在调控植物生长发育、抗逆性以及信号转导方面起着重要的作用。本研究从Leo百脉根中克隆了LcC2DP1基因,序列分析发现该基因具有典型的C2结构域,属于C2域蛋白家族基因[22,27]。亚细胞定位预测结果显示,LcC2DP1蛋白定位于细胞膜和细胞核中,符合大多数C2结构域蛋白的亚细胞定位情况[10],这是由C2结构域蛋白的结构所决定的,当C2结构域蛋白的N端发生酰基化修饰时,其棕榈酰化位点可与细胞膜形成一种可逆的稳定结合,而其豆蔻酰化位点则形成一种不可逆的松散结合[28]。
系统进化分析发现LcC2DP1基因与狭叶羽扇豆、蒺藜苜蓿、刺毛黧豆等豆科植物具有较高的同源性,其中与蒺藜苜蓿的同源性最高为82%,说明LcC2DP1在豆科植物中具有较高的保守性。对该基因进行的组织特异性表达分析表明,LcC2DP1基因在百脉根牧草的根、茎和叶片组织中均有表达,但这种组织表达存在着明显的差异,以根和茎组织中的表达量较高,而叶片中的表达量较低。马佛明等[29]研究表明,巴西橡胶树的C2结构域蛋白编码基因HbC2在被检植物组织中均有表达;但辣椒C2结构域蛋白编码基因CaSRC2-1Kim却具有显著的组织特异性,仅在根组织中表达[30]。可以看出,C2结构域蛋白在植物生长发育中有着不同的表达模式,暗示C2结构域蛋白在植物生长发育过程中功能的多样性,包括可能参与根系发育调控过程。
张兰军等[21]研究发现,复苏植物旋蒴苣苔的C2CDPK蛋白基因BhC2DP1参与激素途径调控根系发育。本研究利用农杆菌介导的瞬时表达系统对LcC2DP1基因功能进行初步分析,结果显示,转LcC2DP1基因植株的不定根分化比野生型早1~2 d,且根系总根长(P<0.01)、根体积(P<0.05)、根尖数(P<0.05)均高于野生型,LcC2DP1基因表达使宿主植物产生一定的根系发育优势,这加深了人们对植物C2CDPK基因功能的认识。C2结构域蛋白可以通过生长素途径调控根系发育[10,31],本研究中的根系发育优势可能与激素途径有关。光是植物生长发育的重要环境因素之一,光通过调节基因的表达和酶的活性等方式影响了植物的生长发育和根系分化过程[32],LcC2DP1基因顺式作用元件中含有光响应元件Box-4、AT1-motif和GT1-motif,该基因也有可能是通过响应或改变光的敏感性调控植株生长发育,进而影响根系分化。
本研究通过对LcC2DP1基因的克隆、生物信息学分析、组织特异性表达、瞬时表达分析,发现LcC2DP1基因属于C2蛋白基因,可能参与百脉根不定根发育调控过程,在后续的研究中,将进一步验证LcC2DP1是否具有钙依赖蛋白激酶相应的生理功能,进行百脉根稳定遗传转化和创制突变体植株,明确LcC2DP1基因在不定根发育过程中的生物学功能。
