新一代基因编辑工具研究进展
2023-01-19周欣洁杜熙钦邹秉杰宋沁馨周国华
王 瑞,周欣洁,杜熙钦,郝 翟,王 琛,邹秉杰*,宋沁馨**,周国华
(1中国药科大学药物质量与安全预警教育部重点实验室,南京 210009;2南京大学生命分析化学国家重点实验室,南京 210093;3东部战区总医院临床药学科,南京 210002)
基因编辑(gene editing)是指在活体基因组中,通过基因编辑工具(一般是核酸酶),进行特定地基因序列的剪切删除、插入或者单个碱基的突变等。人类基因组由两组31.6 亿个碱基的DNA 组成,从胚胎开始,就有很多无法预知的基因组DNA突变发生,这常常会导致各种基因疾病的产生,例如镰刀型红血球疾病、杜氏肌营养不良、早衰症等[1]。目前已经发现了有多达7 000种单基因遗传病,但是其中95%以上都没有有效的治疗方法[2]。基于此,越来越多的基因编辑工具被开发并在人体内进行初步应用。
传统的基因编辑技术可以简单总结为3 个步骤:①基因编辑工具的定位,②通过核酸酶介导的DNA 损伤(一般会产生DNA 双链断裂DSB),③通过细胞内DNA 损伤修复机制(同源定向修复HDR、非同源末端连接NHEJ 等)介导的DNA 修复,达到基因组删除、插入、基因点突变的目的[3]。基因编辑工具的开发可以追溯到1996年,从第一代基因编辑工具锌指核酸酶(ZFN)的构建开始[4],2009年出现了第二代基因编辑工具转录激活子样效应子核酸酶(TALEN)[5],直到第三代基因编辑工具规律间隔成簇短回文重复序列(CRISPR)系统的出现[6],新兴基因编辑工具有了突飞猛进的发展,并成功应用于许多基因遗传病(例如先天性耳聋、杜氏肌营养不良等)的治疗。本文将以基因编辑工具的发展为脉络,主要对第三代基因编辑技术之后的新兴基因编辑工具的创新与优化进行总结评述,即对新一代基因编辑的发展和应用展开综述,并对下一代基因编辑工具的开发与临床应用进行展望。
1 传统基因编辑工具
传统的基因编辑工具,一般是指以产生DNA双链断裂(DSB)为基础的基因编辑工具,通常指:第一代锌指核酸酶(ZFNs)基因编辑系统、第二代转录激活子样效应子核酸酶(transcription activatorlike effector nucleases,TALENs)基因编辑系统和第三代CRISPR/Cas9基因编辑系统。
1.1 锌指核酸酶
ZFNs 是由核酸结合蛋白Cys2-His2 锌指蛋白(ZFP)和核酸内切酶FokⅠ建立的融合蛋白,通过锌指DNA 结合域的定位和FokⅠ核酸内切酶结构域的二聚形成靶向DNA 双链断裂。ZFNs 的工作原理见图1。Kim 等[7]构建出了第1 个锌指蛋白核酸酶,并在2005年,对人类细胞基因组进行编辑。

图1 锌指核酸酶(ZFNs)工作原理[8](每个锌指核酸酶识别3 个碱基,当ZFNs 与DNA 结合后,两个Fok Ⅰ切割结构域会在靶位点形成二聚体,使双链断裂,进行基因编辑)
1.2 转录激活子样效应子核酸酶
TALENs 技 术的核心 是TALE 蛋白。TALE 蛋白可以识别特定核苷酸序列。与ZFNs 结构类似,TALENs 也是通过TALE 蛋白的DNA 结合域与FokⅠ核酸内切酶结构域的二聚形成靶向DNA 双链断裂。TALENs的工作原理见图2。
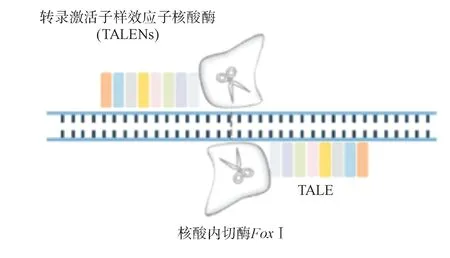
图2 转录激活子样效应子核酸酶(TALENs)工作原理[8](TALE 部分串联重复的结构可以特异性地识别对应碱基,两个Fok Ⅰ切割结构域会在靶位点形成二聚体,使双链断裂,进行基因编辑)
TALENs 于2009年由Becker 等[9]首次发现,并于2011年在人类细胞进行基因编辑。TALENs 相较于第一代基因编辑工具ZFNs,具有更高的基因编辑效率和更精准的靶向识别功能。目前,ZFNs与TALENs 已成功地应用于编辑体外T 细胞中CCR5 基因以抵御HIV 病毒[10]。然而,这两种基因编辑工具都需要对编辑的DNA 序列设计特定的核酸酶,还需要进行复杂的组装,成本高、编辑效率低等都限制了上述基因编辑工具的应用。
1.3 CRISPR/Cas系统
2012年,一种来源于细菌和古细菌免疫系统的规律间隔成簇短回文重复序列(CRISPR/Cas)系统被用于基因编辑工作,其工作原理见图3。Knott等[11]发 现Cas9 通 过 一 个 特 异 性 识 别DNA 的crRNA 和与Cas9 重复序列几乎互补的反式激活crRNA(tracrRNA)可以实现与相应的DNA 结合。而crRNA 和tracrRNA 可以融合为一个指导RNA(sgRNA),只需设计gRNA 就可以引导CRISPRCas9 核酸酶与目标DNA 结合来切割DNA。这种既具备靶向定位功能,又具备靶向结合切割功能的核酸酶很快就被开发用于基因编辑。
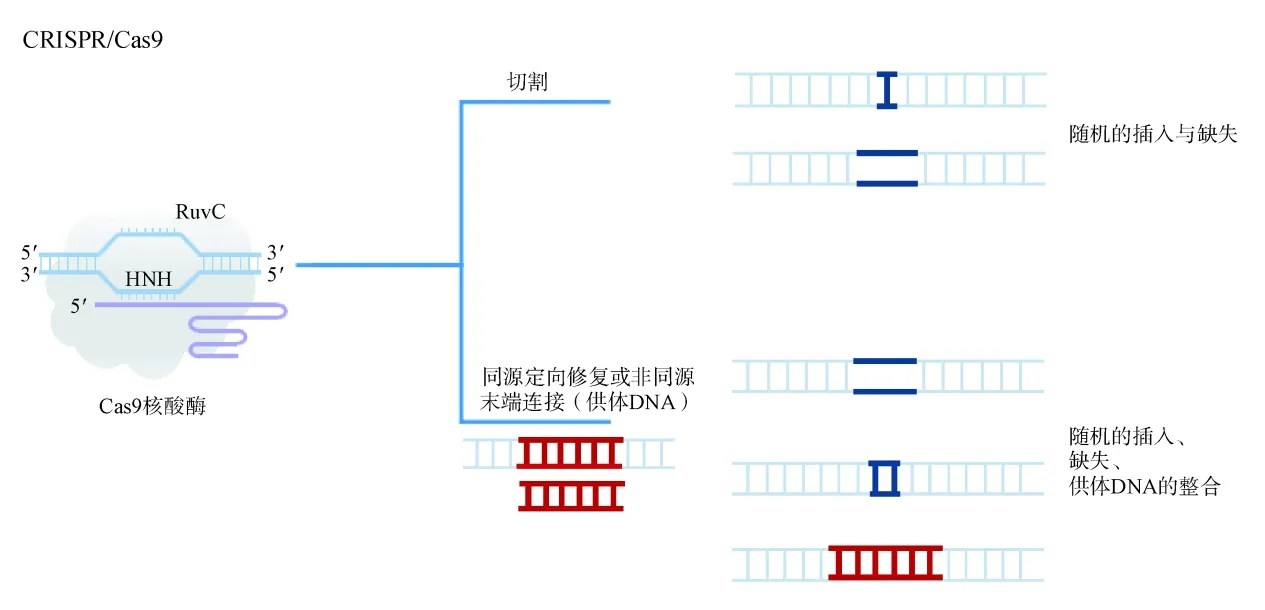
图3 CRISPR 编辑系统工作原理[Cas9靶向切割与sgRNA 互补结合的目标DNA,形成随机的插入或缺失(indels),通过同源定向修复或非同源末端连接等整合供体DNA,完成基因编辑]
2013年初,Cong 等[12]设计了两种不同来源的Cas9(分别来自嗜热链球菌和化脓性链球菌),首先成功地将CRISPR-Cas9 用于真核细胞的基因组编辑。随即,CRISPR-Cas9就被用于遗传疾病的治疗。Geurts等[13]利用CRISPR/Cas9对人干细胞中一种与囊肿性纤维化相关联的基因进行基因治疗。
然而,CRISPR/Cas9 系统已被许多研究者报道存在严重的脱靶效应,更严重的是,以上3 类基因编辑工具都基于DSB,DSB造成的隐患也在被编辑的生物体内不断被发现,DNA 双链断裂的速度超过细胞自身修复损伤的速度就会导致细胞死亡。有多项研究指出CRISPR 系统能激活p53 而引发DNA 损伤,最终干扰其基因编辑效率[14];研究还发现,CRISPR-Cas9还会导致包括大片段缺失在内的各种复杂的染色体结构异常乃至染色体整体缺失[15]。p53 因子在细胞的生长周期中发挥负调节的功能,基因组的损伤会被p53 基因识别。而用CRISPR-Cas9 基因编辑细胞后,往往会发现p53 基因突变,这常常与癌细胞的发生密切相关。此外,研究人员还发现,CRISPR 基因编辑可能会激活或抑制具有其他癌症的相关基因,比如激活KRAS致癌基因。CRISPR-Cas9 还会与DNA-PK 复合物结合,破坏DNA-PK依赖的修复通路导致严重的细胞损伤甚至死亡[16]。
基于DSB 带来不可逆的损伤和细胞死亡,研究人员开始着手于开发新一代不形成DSB 的基因编辑工具。
2 不依赖DNA双链断裂的新一代基因编辑工具
2.1 单碱基编辑(base editing,BE)
在CRISPR 编辑系统中,DSB 由Cas9 的双链切割活性导致。为了不产生DSB 达到更精准的基因编辑,2016年Komor 等[17]构建了胞嘧啶碱基编辑器(CBE),将失去切割活性的dead Cas9(dCas9)与胞嘧啶脱氨酶APOBEC 偶联,通过向导RNA 引导dCas9结合在DNA双链上,再通过脱氨酶将胞嘧啶(C)脱氨基突变为尿嘧啶(U)。CBE 的构建到完善也经历了许多波折,一开始CBE1 使用的是完全没有切割活性只有结合活性的dCas9,U 只存在于RNA 的转录过程,DNA 中的U 会激活尿嘧啶糖基化酶(uracil DNA glycosylase,UDG)来修复这一异常,导致编辑效率大打折扣。于是,通过融合抑制UDG 的尿嘧啶糖基化酶抑制子(UGI)来保护编辑后的U。进一步研究人员又对Cas9 进行突变。Cas9 有两个切割域:HNH 结构域和RuvC 结构域,分别切割DNA 的两条链。一开始的版本使用了完全没有切割活性的dCas9,为了让细胞不去修复被编辑的碱基,研究人员想到用dCas9(A840H)切割没有被编辑的那条链,“迷惑”细胞修复机制,细胞会误以为需要修复的是断裂的那条链,实现所需要的C to T的编辑,这就是目前的CBE4.0。
嘧啶之间的突变实现后,开始着手解决导致更多单基因遗传病的G to A点突变。然而,自然界中并没有作用于DNA 的腺嘌呤脱氨酶,Gaudelli等[18]通过细菌抗性筛选的原理开发出一种定向进化蛋白系统——噬菌体辅助进化技术,将大肠杆菌来源的tRNA 特异性腺苷脱氨酶(TadA),定向进化为对DNA 底物有腺苷脱氨基活性的酶,用于DNA单碱基编辑。这两种碱基编辑器实现了4种碱基的颠换,解决了60%的点突变遗传病。单碱基编辑(base editing,BE)系统的工作原理见图4。
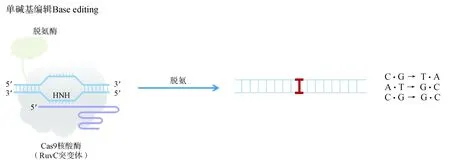
图4 单碱基编辑系统工作原理[由dCas9(A840H)融合脱氨酶,切割非编辑链,在编辑链上进行脱氨,完成4种碱基的颠换]
BE 的应用成果也令人欣喜,2021年初,基因编辑公司BEAM 宣布了首个进入临床的单碱基编辑器体内基因编辑项目VERVE-101,该项目选择关闭治疗杂合子家族性高胆固醇血症的靶点PCSK9。临床试验结果显示,经过BE 编辑的受试者血液中PCSK9 下降了89%,更重要的是并未观察到脱靶现象。其他难以攻克的隐性遗传病(例如先天性耳聋)的治疗,也得益于单碱基编辑器的出现,在耳聋小鼠中得到成功应用[19]。
但是,据统计单基因遗传病只占全部遗传病中的三分之二,单碱基编辑器只能实现其中两种碱基颠换。并且,单碱基编辑器会将编辑窗中的C或者A 都进行突变,胞嘧啶碱基编辑器中的胞嘧啶脱氨酶也被报道是导致严重脱靶效应[随机的插入与缺失(indels)]的因素之一。
2.2 先导编辑(prime editing,PE)
2019年,又一突破性的基因编辑工具出现。Anzalone 等[20]开发出一种“搜索与替换”的基因编辑工具——先导编辑,其工作原理见图5。PE 主要的结构是nCas9(H840A)蛋白融合逆转录酶(reverse transcriptase,RT),并 延 长Cas9 的 向 导RNA,在向导RNA 后半段增加一段逆转录模板,命名为pegRNA。当DNA 产生缺口后,逆转录酶会按照模板延伸替换掉原来的序列,这就是“搜索与替换”的含义。
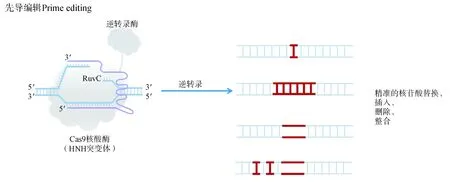
图5 先导编辑系统工作原理[由nCas9(H840A)融合逆转录酶,切割非互补链,暴露3'flap,逆转录酶沿着pegRNA 上的逆转录模板延伸出新的DNA,达到精准的替换、插入、删除与整合]
与上文介绍的BE 不同,PE 中的Cas9 切割的是需要被编辑的那条链。当PE 融合蛋白结合到DNA 双链上时,编辑链会暴露并被切割形成一个3'flap,沿着pegRNA 上的模板序列合成新的DNA 链。同时,5'flap 处的旧DNA 链会激活细胞的3'flap-5'flap equilibration 机制裂解5'flap。最后,编辑链和非编辑链通过错配修复(mismatch repair,MMR)机制完成整个修复过程。
研究人员进一步对几个组分都进行优化,从PE1.0 开发到PE5.0。优化过程可以概括为:改造pegRNA 为epegRNA 保护其不会在细胞中被裂解;突变逆转录酶,增加逆转录活性,间接提高编辑效率;抑制DNA 错配修复(MMR)通路,防止修复后编辑链被裂解,降低MMR 相关基因的表达或在编辑链修复后再在非编辑链上引入切口等。
通过一系列的改进与优化,目前PE5.0 可以在细胞中达到30%~60%的编辑效率,实现所有12 种单碱基的自由转换,小片段的插入与删除。据报道,PE有望治疗89%的遗传疾病,并陆续在动植物体推进应用。2021年,拉瓦尔大学的Tremblay等[21]通过PE在体外培养的人类细胞基因组中插入“冰岛突变”,旨在降低阿尔茨海默病基因携带者发病率。“冰岛突变”是报道过的一种保护性突变,发现冰岛人群中的A673T 突变会降低AD 的发生。研究人员选择PE 精确引入A673T 突变并不会破坏附近其他基因,有望防止遗传性AD。
然而,基于CRISPR 系统的基因编辑工具应用还存在许多限制。首先,这些基于CRISPR 系统的基因编辑工具要实现DNA 定位,主要依赖于前间区序列邻近基 序(protospacer adjacent motifs,PAM),人类基因组中只有9.9%的基因存在可以被识别的PAM 基序[22]。其次,PE 由于编辑效率等一系列限制,不能插入长基因组序列,长序列的插入还是需要借助重组酶和DNA 供体,这限制了对多个位点突变的基因编辑。最后,基因编辑工具应用到人体内还需要递送,FDA 已经批准腺病毒相关病毒作为基因编辑的临床技术方案。BE 和PE 的主要组分都是CRISPR 融合蛋白,其中PE就有11.4 kb,而腺病毒的基因组只能容纳编码4.7 kb 左右的遗传物质,CRISPR/Cas 系统融合其他酶所构建的编辑工具难以被递送。
2.3 多类型基因编辑工具
针对PE 需要被解决的问题,科学家们又开发了一系列新型基因编辑工具。
以BE 为基础,有3 种双碱基编辑工具同时发表,对胞嘧啶脱氨酶和腺嘌呤脱氨酶进行整合优化,开发了两种A&C-BEmax 和SPACE 双碱基编辑器[23-24]。这两种双碱基编辑器都成功实现了在一个靶位点C to T 和A to G 的突变。与单碱基编辑器相比,编辑窗口的精确度与编辑效率都得到提升,可以进行额外60个碱基的突变编辑,从而替换更多的氨基酸。接下来,为了满足建立突变饱和的要求,研究人员还融合ABE 与一种糖苷酶碱基编辑(CGBE)系统,构建了AGBE[25]。AGBE 可以同时诱变一个靶位点进行A to G、C to G 或T 或A这4种突变,是构建突变文库和基因单核苷酸突变功能研究的强有力工具。这些双碱基编辑系统的开发,为构建多种基因突变模型提供了可能。
以PE为基础,为解决原始PE对大片段基因编辑效率低下的问题,科学家们先后开发了几种双PE基因编辑工具。
以双pegRNA 为基础构建的大片段基因编辑工具PEDAR(PE-Cas9-based deletion and repair)[26]和PRIME-Del[27],通过两条pegRNA 扩大了基因组删除的规模。PEDAR 和PRIME-Del 都可以解决PE 对超过100 bp 的大片段基因组难以编辑的问题,表征了长达10 kb 的高效率缺失。不仅如此,还可以将大片段缺失与小片段插入相结合,实现基因组的重排编程,扩宽PE 的编辑类型与范围。Anzalone 等[28]开发出TwinPE。TwinPE 顾名思义,是通过两个PE编辑器来突破原始单个PE的限制,并成功纠正了亨特综合征基因突变,在致病基因组中结合Bxb1 重组酶完成了39 kb DNA 片段倒位。同样的,双pegRNA 策略开发的HOPE 也表征了长片段基因编辑的效率与精度[29]。此外,用两条带有逆转录模板的pegRNA 的GRAND 编辑器,实现了无供体DNA的大片段基因组插入[30]。
长片段基因组的重新编程使同时修正多个致病位点成为可能,并且,长片段序列的替换与纠正为罕见基因疾病的基因治疗增加了通用性与便捷性。但是,显而易见,多类型基因编辑工具的开发思路都是通过增加一个编辑器或增加向导RNA 的方法,过大过复杂的基因编辑工具更是难以被递送进入人体。
总而言之,通过以上工作,基因编辑工具可以实现的基因编辑类型已经涵盖了所有单碱基的自由转化、突变,DNA 片段的插入、删除、替换等,基本满足了基因治疗的应用需求。但是,基因编辑工具还有两个限制并未解决,PAM 的限制使其不能靶向全部人类基因组,基因编辑工具大小的限制也是临床应用的一大瓶颈。
3 其他新一代基因编辑工具
除了开发不产生DSB 的新型基因编辑工具,科学家们还在对传统基因编辑工具的序列限制和体型限制进行改进优化。
3.1 无PAM限制的基因编辑工具
为了打破PAM 序列的限制,研究者们开展了很多工作。Christie 等[31]尝试对野生型Cas9 突变,构建出了首个几乎可以识别整个基因组序列的变体SpRY,并于细胞系中验证SpRY 可以识别几乎所有位点,PAM 序列特征为NNN(N 是任意碱基),这一工作在基因编辑和分子克隆中都展现了巨大潜力。
但是SpRY 变体对嘧啶类位点的亲和力还有待提高,并且从Cas9 延伸的变体都存在体积太大难以递送的问题。Huang 等[32]继续通过前文提及的噬菌体辅助连续演化系统(PACE),对小型的Cas9 系统进行优化,改造后的变体突破了传统PAM限制,可以识别的位点拓展到N4YN(Y是C或T),且在多种细胞系中都表现出与传统Cas9 变体相当的编辑效率与更小的脱靶风险。
除了对野生型Cas9 进行蛋白改造,科学家们也在寻找其他的基因编辑酶。
武汉大学Shi 等[33]报道了AtCas9。AtCas9 来源于嗜热菌,是首个被报道的天然广谱PAM 的基因编辑器。
南京大学Xu 等[34]将目光聚焦到了一种可以特异性识别flap 结构的核酸内切酶FEN1,将之与ZFNs和TALENs编辑器中的FokⅠ内切酶融合,构建出了新一代无序列限制的,结构识别的基因编辑工具SGN。研究人员进一步改进,去除FokⅠ内切酶,仅通过FEN1 的三碱基重叠切割能力,优化到完全无PAM 限制,实现精准单核苷酸切割的基因编辑工具HpSGN[35],其工作原理见图6。更值得关注的是,FEN1酶的超小型结构(约300个氨基酸残基)是目前CRISPR/Cas 系统融合蛋白无法达到的。这也给基因编辑领域开拓了新思路,开发内源性的核酸酶作为基因编辑工具。
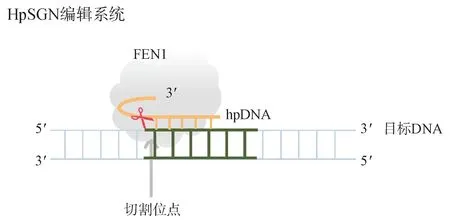
图6 HpSGN 编辑系统工作原理(hpDNA 通过发夹结构与向导DNA 组成,靶向编辑链,FEN1 会特异性识别hpDNA 与编辑链形成的三碱基重叠结构,进行切割,完成基因编辑)
3.2 小型基因编辑工具
如何实现精准有效的递送是基因编辑工具应用在人体的最后一公里。为了早日实现临床应用与提高递送效率,科学家们也在递送方面做出了很多努力。前文说到,CRISPR 相关融合蛋白构建的基因编辑系统很难被递送,所以开发更小型易于递送的工具是很必要的。目前的研究主要从缩小Cas蛋白和拆分融合蛋白两个方向推进。
从构建更小的基因编辑蛋白方向,除了上文提过的Huang 等[32]构建的无PAM 限制的小型基因编辑工具,和南京大学Xu 等[35]构建的只有300 个氨基酸残基的SGN 基因编辑工具,科学家们还构建了更小的CRISPR相关蛋白。
上海科技大学Wu等[36]表征了极小型的CRISPR 相关蛋白AsCas12f1,该蛋白仅有422 个氨基酸残基,是当时报道的最小的CRISPR 相关蛋白。无独有偶,同一天发表的另外一个研究,Kim 等[37]也开发出迷你版的CRISPR 系统Cas12f1,该蛋白只有529 个氨基酸残基。这两种迷你基因编辑工具给CRISPR 相关基因编辑工具的递送与应用提供了新的思路。不过目前Cas12f 还是无法达到精准基因编辑工具的水平,在人类细胞系中编辑效率最高为30%左右,进一步提高编辑效率、减少脱靶编辑,真正达到临床应用的基因编辑系统标准还有许多工作要做。
清华大学Tsuchida 等[38]开发了CasX,兼顾了小型与高效的基因编辑。CasX 大小为980 个氨基酸残基,但是在细胞中内源位点的编辑效率可以达到50%,媲美常用的Cas9 核酸酶,这是目前小型Cas9 基因编辑工具难兼顾的,有望替代Cas9 在人体内进行下一步的基因编辑。
康奈尔大学的Schuler等[39]开发了目前世界上最小的Cas9 蛋白——IscB。研究人员对Cas9 的远古祖先Isc 家族进行解析与蛋白突变,IscB 大小仅为传统Cas9 蛋白的三分之一,还保留了核酸酶活性,但是细胞中的编辑效率还有待验证。这种返璞归真的研究方向,不仅发现了更小体型的Cas9蛋白“祖先”,通过研究Isc 蛋白的电镜结构,还发现了减少Cas9基因编辑系统脱靶编辑的方法。
从拆分融合蛋白的方向,也有几个重要的发现。中山大学Zhi 等[40]通过内涵肽拆分策略,将PE 系统拆分为N 端和C 端两部分,并通过双腺相关病毒(AAV)系统递送,构建了Split-inteinPE2 系统,并在小鼠眼底进行了应用。随后美国哈佛大学麻省总医院与德国慕尼黑工业大学Grünewald等[41]也合作发表了拆分的PE 蛋白。研究人员在实验中发现,PE 系统的逆转录酶无论融合在Cas9蛋白的N 端、C 端还是中间,都不会影响PE 的编辑能力,这一发现为PE 系统的拆分提供了思路。于是,研究人员直接将Cas9 与逆转录酶拆开分别递送,构建了Split-PE2ΔRH 系统。这种直接拆分策略比内涵肽拆分策略的编辑效率更高,也不再需要优化融合蛋白和蛋白接头,仅需分别优化Cas9蛋白与逆转录蛋白就可以高效地构建PE 蛋白突变体,为后续的研究提高了效率。
除了拆分PE 融合蛋白,拆分过长的pegRNA也是优化思路。目前已经报道了将pegRNA 拆分后环化和增加MS2 适体,增加suntag 等策略[42]。这种思路可以防止过长的pegRNA 在体内被降解,还增加了pegRNA的多样性与通用性。
西北大学的Huang 等[43]还另辟蹊径,基于构建球形核酸SNA 的经验,构建了一种CRISPR 球形核酸,CRISPR 球形核酸具有与球型核酸同样不需要载体仅孵育即可递送的优点,这种开创性的想法为CRISPR 的优化与应用提供了一个全新的思路。
这些小型基因编辑工具的优化都是为了满足在人体内的应用,使其能够被腺病毒相关病毒所递送。但是,无论是缩小蛋白还是拆分基因编辑工具,都不可避免地牺牲基因编辑效率与可编辑类型。所以,构建出一个突破各方面限制的基因编辑工具,走好基因治疗应用的最后一公里,在递送方面还需不断优化和改进。
4 基因编辑工具的安全性
尽管基因编辑技术被誉为21世纪生命科学领域的突破性革命,但是其安全性和伦理问题仍备受争议。
4.1 基因编辑工具风险
基因编辑技术的开发致力于从人体胚胎进行应用,一次性解决致病基因。然而,目前并未开发出完全无脱靶风险的编辑工具。多篇文章报道对CRISPR/Cas9 相关编辑系统进行全基因组脱靶分析,被编辑的动物体内许多原癌基因、抑癌基因出现有害突变。
不仅是体内基因编辑难以应用,即使目前FDA 已经批准了一系列体外基因编辑项目的临床应用,但是体外基因编辑后的CAR-T 细胞也被多个研究报道了会对人体造成基因毒性。2021年,由于在输注了CAR-T 细胞的病人体内发现了由基因编辑导致的染色体易位,FDA 紧急叫停了临床研究。
2022年7月,首个获批临床试验的基因编辑药物VERVE-101 在新西兰完成了首例患者给药,利用碱基编辑器沉默PCSK9致病基因,这也是第1个直接在体内进行基因编辑的临床项目。但是FDA在2022年11月突然暂停临床实验,且双方都没有公布具体原因。后续FDA 要求公司提供更多数据,主要是包括编辑风险,脱靶分析和是否会遗传给后代的证明。并且一位接受CRISPR 基因编辑疗法的DMD 患者也不幸死亡,具体原因也并不清晰。
随着基因编辑药物相关脱靶致癌风险的不断发现以及临床试验的屡次叫停,基因编辑技术的开发与应用蒙上了阴影,但是这也为基因编辑领域的空白地带研究给出了新的方向与动力。即使基因编辑工具的风险因素不断被提出,但是针对检测与表征基因编辑工具的脱靶程序也相继在研发,不断有更安全更精准可控的基因编辑工具被提出,科学家们也在着手建立更全面的基因治疗安全标准,打破基因编辑工具在体内的应用壁垒,推动基因治疗能够早日安全应用。
4.2 基因编辑工具的伦理问题
基因编辑的伦理问题伴随着基因编辑技术的提出就一直备受争议,毫无疑问这是一把双刃剑。
从适用范围来说,伦理委员会与研究人员达成的共识是,基因编辑技术可以应用的是已经有证明是明确单独决定因素的致病位点,这种疾病已经带来了极大痛苦。但是,目前基因编辑的相关研究成果都证明了在一些相关基因编辑后的良好治疗结果(例如HIV),这就引发了伦理与科学的思考。
从自然进化来说,对于胚胎的基因编辑,宣称从根本上治疗遗传疾病,但是这无疑是违背自然规律的,打破了人与自然的平衡。并且,基因编辑工具的风险还并未研究透彻,无法预期的脱靶也会随着胚胎基因编辑整合到后代中,无论任何后果都难以想象。
因此,如何利用好这把双刃剑去攻克基因疾病,正是一代又一代基因编辑工具开发的初衷。掌握好这项技术也许能够给无数罕见病患者家庭带来生的希望,但是真正应用于临床依旧任重道远。
5 总结与展望
基于不同原理的基因编辑工具比较见表1。基因编辑技术的两位发明者在2020年获得诺贝尔化学奖,基因编辑技术被寄予厚望。面对95%没有有效治疗药物的罕见病,基因编辑工具的开发与验证为这些罕见病带来了曙光。从形成DNA 双链断裂的基因编辑工具,到能够精确突变一个位点的单碱基编辑器和引导编辑器等,对人类基因组的改变与操纵也渐渐成为现实。在科学家们的不断努力下,对基因编辑工具不断优化,在突破序列的限制上、编辑效率的优化上、编辑类型的拓展上以及递送工具的开发设计和临床试验的推进上,基因编辑技术的发展似乎已经势不可挡。

表1 基于不同原理的基因编辑工具比较
新一代基因编辑工具,即可以实现全部基因组编辑、实现任意类型插入删除突变的易于应用以及能够减少毒性的基因编辑工具。新工具的不断开发,可以看到正在向这个理想的方向接近。同时,构建能够高通量检测基因编辑工具脱靶水平和编辑效率的平台也在进一步研究中,有望对基因编辑毒性的空白领域进行探索。
积极研发能够安全递送的基因编辑工具与递送系统,完成基因治疗的最后一公里。完善相关伦理与法律监管问题,攻克罕见病,是未来科学家们共同努力的方向。
