丹皮酚纳米乳的制备及血管内皮细胞摄取的考察
2023-01-19汪巳卜沈祥春罗兴洪
汪巳卜,陈 英,丁 杨,2,肖 婷,刘 文,沈祥春,陶 玲*,罗兴洪,3**
(1贵州医科大学药学院,贵州省天然药物资源高效利用工程中心(天然药物资源优效利用重点实验室),贵阳 550025;2中国药科大学天然药物活性组分与药效国家重点实验室,南京 210009;3江苏先声药业有限公司,转化医学与创新药物国家重点实验室,南京 210042)
心血管疾病(cardiovascular diseases,CVDs)是心脏、血管等循环系统疾病的统称,包括动脉粥样硬化、冠心病、糖尿病、高血压等[1],发病率高、致残率和死亡率居高不下[2]。血管内皮细胞(vascularendothelial cell,VEC)是覆盖在血管内腔表面的连续单层扁平细胞[3],其功能障碍是多种心血管疾病的早期致病因素,并贯穿始终,在心血管疾病的临床早期预测及早期干预等方面具有重要的意义[4]。
丹皮酚(paeonol,Pae),也称牡丹酚,是从芍药、红景天等植物中提取的生物活性酚[5-6]。药理作用广泛,在心血管方面具有抑制氧化应激[7]、抗衰老、抑制凋亡[8]和减轻炎症[9]等药理作用。但由于Pae 具有水溶性差、稳定性差[10]等缺点,目前上市的剂型如软膏剂、片剂等存在生物利用度低、给药半衰期短,体内消除迅速,患者顺应性较差及靶向性能不显著等局限,严重限制了其临床应用。
纳米乳(nanoemulsion,NE)是一种平均粒径低于100 nm,外观透明或半透明的均一分散体系[11],可以改善脂溶性药物溶解度及稳定性,增加细胞摄取率和组织渗透性[12],并具有缓释和靶向作用,可提高药物疗效及患者顺应性。纳米乳属于热力学稳定系统,大多数耐热压灭菌和高速离心,不需特殊设备和制备工艺。本研究根据Pae脂溶性强,在油相中溶解度高的特点,进行了丹皮酚纳米乳(paeonol-nanoemulsion,Pae-NE)制备研究,并进行人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs)的毒性及摄取效率考察,为Pae 的剂型选择和血管内皮损伤部位的有效递送提供实验参考。
1 材 料
1.1 药品与试剂
丹皮酚(批号CHB201230,纯度≥ 98%,成都克洛玛生物科技有限公司);甲醇(色谱醇,美国天地公司);长链甘油三酯(LCT,浙江田雨山药用油有限公司);中链甘油三酯(MCT,西安天正药用辅料有限公司);15-羟基硬脂酸聚乙二醇酯(HS15,上海协泰化工有限公司);大豆磷脂(上海太伟药业有限公司);聚乙二醇400(PEG400,西陇科学股份有限公司);1,2-丙二醇(中国医药公司北京采购供应站经销);无水乙醇(国药集团化学试剂有限公司);超纯水(实验室自制)。
1.2 仪 器
U3000 型高效液相色谱仪(美国Thermo 公司);ME104/02 型分析电子天平[梅特勒-托利多仪器(上海)有限公司];85-2B 型恒温加热磁力搅拌器(金坛市科析仪器有限公司);HT7700 型透射电子显微镜(日本日立株式会社);Nano-ZA 型马尔文Zeta 电位计粒径测定仪(美国布鲁克海文仪器公司);荧光显微镜(成都锦世昌祥科技有限公司);SHZ-88 型NovoCyte 流式细胞仪(艾森生物杭州有限公司);XDS-2B 型倒置显微镜(日本尼康公司)。
1.3 细 胞
人脐静脉内皮细胞株(HUVECs,CRL-1730)来自于美国模式培养物集存库(American type culture collection,ATCC)。
2 方法与结果
2.1 含量测定方法的建立及考察
Ultimate LP-C18色 谱 柱(150 mm × 4.6 mm,5 µm);流动相为甲醇-水(59∶41);检测波长为275 nm;流速为1.0 mL/min;柱温为25 ℃;进样量10 µL。方法学考察结果表明,Pae-NE 供试品、Pae对照品约6 min 时出峰,阴性样品在相应时间处无干扰,专属性良好;以峰面积(Y)对质量浓度(X)绘制标准曲线,并进行线性方程拟合,得回归方程为Y= 0.787 5X- 0.322 3,R2= 0.999 9(n= 6),结果表明,Pae 在4 ~ 132 µg/mL 范围内线性关系良好;精密度试验结果RSD 为0.12%,表明仪器精密度良好;重复性试验结果RSD 分别为0.83%、0.33%和0.18%,表明该方法重复性良好;稳定性试验结果表明,12 h 取样检测结果RSD 为0.15%,表明Pae-NE供试品溶液在12 h内稳定性良好。
2.2 单因素法考察Pae-NE的处方
通过实验室的前期考察[13],采用相转变法制备Pae-NE。固定总质量为1 g,Pae 为20 mg,分别称取比例按1∶3 混合的LCT 和MCT 为油相、乳化剂和助乳化剂置于西林瓶中,室温下适当搅拌使完全溶解并混匀,缓慢滴加超纯水,直至形成澄清、透明或半透明、黏度小的无色或蓝色判定为形成纳米乳,记录所使用的水量。再分别以油相、水相、混合乳化剂为伪三元相图的3 个顶点,使用Origin 8.0软件进行伪三元相图绘制。以乳化区域面积大小为考察指标,单因素法筛选乳化剂、助乳化剂、乳化剂与助乳化剂的比值(Km)。
结果表明,固定助乳化剂为1,2-丙二醇,当乳化剂与助乳化剂比值(Km)为1∶1,乳化剂大豆磷脂与1,2-丙二醇加水之后凝固,不能成乳;HS15 与1,2-丙二醇加水之后能形成淡蓝色乳液,因此选择HS15 为乳化剂。助乳化剂分别为1,2-丙二醇、无水乙醇、PEG400 进行Pae-NE 制备时,相比于无水乙醇和PEG400,1,2-丙二醇的伪三元相图乳化面积最大,因此选择1,2丙二醇为助乳化剂。
当Km分别为1∶3、1∶2、1∶1、2∶1、3∶1 的考察结果表明,当Km为3∶1 时乳化面积最大,因此选择Km为3∶1。在确定上述处方参数后,进行油相与Km不同质量比考察,结果表明,当静置一段时间后,油相与Km比例为3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1 的乳液均出现分层;1∶9、2∶8 的未分层,且呈淡蓝色光。考虑到1∶9 中乳化剂用量过大会产生较大毒性,因此选择油相与Km为2∶8进行后续研究。
2.3 Pae-NE处方优化
2.3.1 CCD 星点效应试验设计 经预试验和单因素试验可知,处方中混合油相比例、Km以及油相加入量3个因素是影响纳米乳形成、粒径大小的主要因素。故选择处方中混合油相比例(A,%)、Km(B)、油相加入量(C,mg)为自变量,粒径大小(Y1,nm)、Y2(PDI)为评价指标量,用Design Expert 8.0软件按照CCD 设计原理设计3 因素5 水平试验,结果见表1。

Table 1 CCD-RSM experiment design and response values
2.3.2 模型拟合及方差分析 采用Design Expert 8.0 软件对实验数据进行处理,分别以Y1、Y2对A、B、C进行二次多项式回归方程拟合,得到的多元二次多项式的回归方程如下:
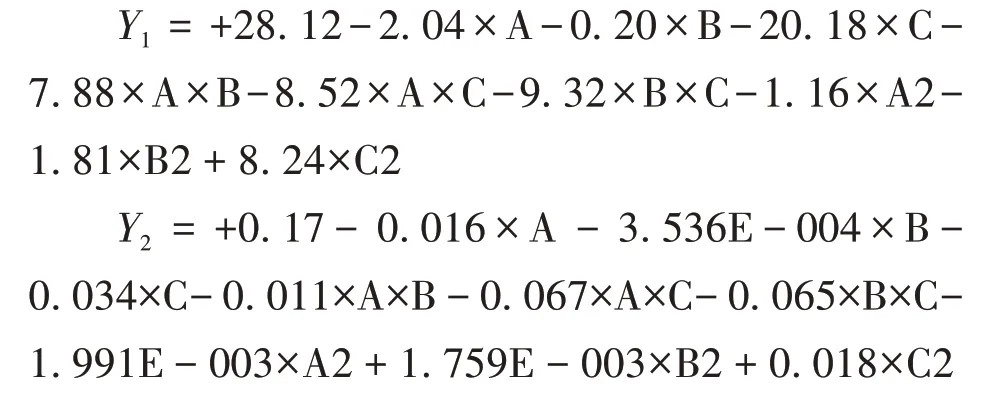
本次实验的拟合回归方程达到了显著性,粒径 与PDI 的P值 分别 为0.001、0.000 3,均 小 于0.05,表明对该模型显著;R2约接近于1,表示模型越接近真实值。结果表明,多元相关系数R2分别为0.991 5 和0.987 2,模型显著,能够由实验因素预测响应值变化。
响应面法条件优化得到最佳处方为:当固定Pae 为20 mg,LCT 为55.1 mg、MCT 为144.9 mg、HS15 为600 mg、1,2 丙 二 醇 为200 mg,粒 径 为28.12 nm,PDI为0.170。
2.3.3 最佳处方的验证 按照“2.3.2”项下所得最佳处方,同法制备了3 份Pae-NE 对模型进行验证,粒径实测值分别为26.64、27.28、27.55 nm,与预测值的偏差为0.96 nm,PDI 实测值分别为0.200、0.188、0.202,与预测值的偏差为0.027,得到粒径的实测值与预测值的偏差为0.96 nm,PDI实测值与预测值的偏差为0.027,实测值与预测值接近,表明其与最佳条件下的结果基本一致。
2.3.4 外观形态考察 取Pae-NE 适量置于铜网上,滤纸吸去多余的液体,再用2%的磷钨酸溶液负染1 min,自然晾干后置于透射电镜下观察其形态。结果表明,制备得到的Pae-NE外观澄清、透明呈淡蓝色状态,大小较均匀,形态呈类球形,结果见图1。
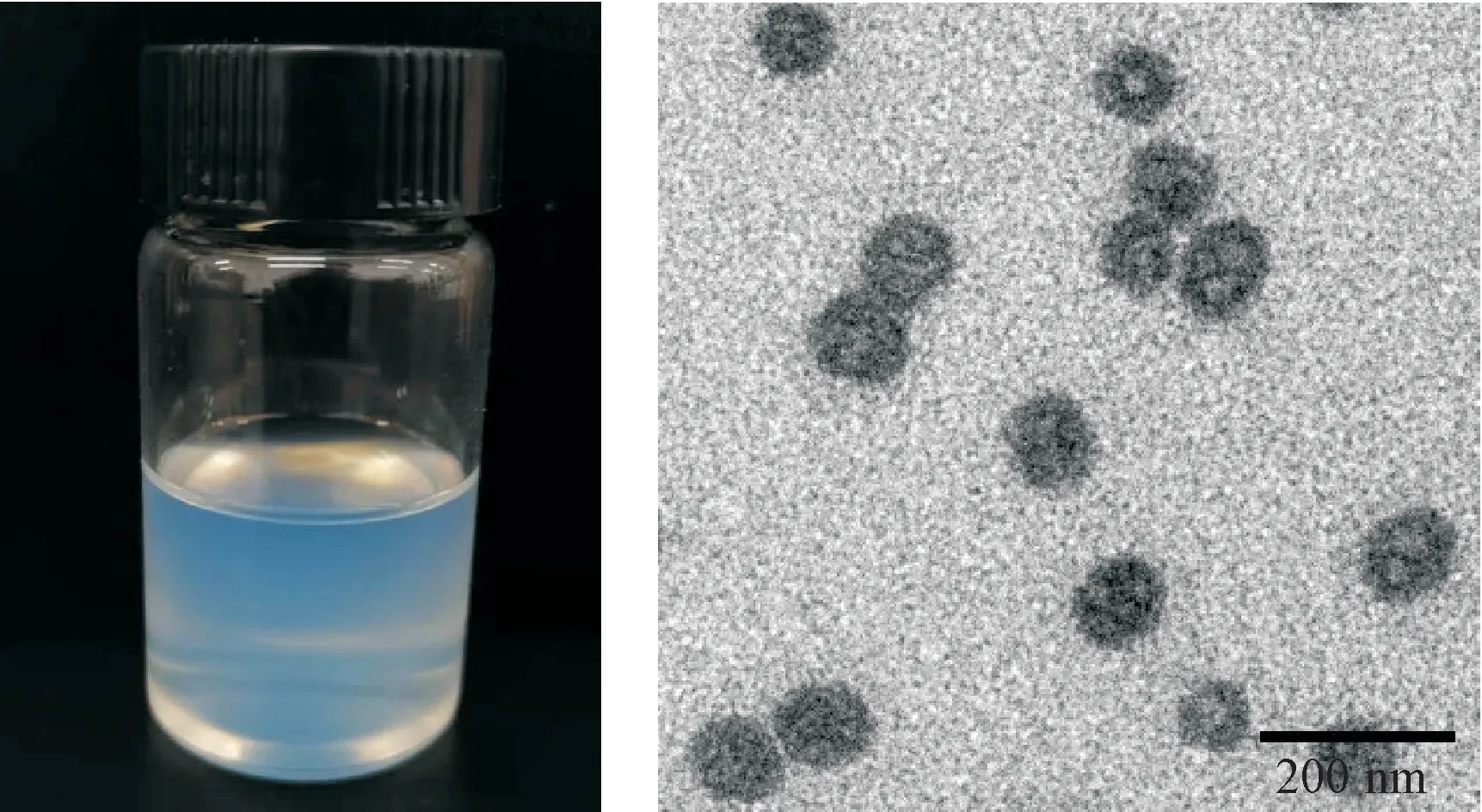
Figure 1 Appearance diagram and TEM of paeonol-nanoemulsion (Pae-NE)
2.3.5 粒径及Zeta 电位测定 取Pae-NE 适量,稀释至适宜浓度,均匀分散后,采用马尔文激光粒径分析仪测定纳米乳的粒径和Zeta 电位。结果表明,制备所得的Pea-NE 平均粒径大小为(25.69 ± 0.03) nm、PDI 为0.182 ± 0.09,Zeta 电位为-(4.01 ± 0.3) mV。
2.3.6 储存稳定性考察 将制备好的Pea-NE 置于(20 ± 5)℃室温放置,分别于第1、3、7、10、15、30天时观察纳米乳的颜色、分层等情况,同时测量其粒径和PDI。结果表明,在第1、3、5、7、10、15、30天的平均粒径分别为27.51、26.24、26.83、26.53、26.15、25.45、25.13 nm,PDI 分别为0.159、0.171、0.170、0.182、0.171、0.192、0.126。结果表明,Pae-NE的粒径、PDI及外观形态在30 d内几乎没有改变,说明Pae-NE在30 d内稳定性良好。
2.3.7 稀释稳定性的考察 于(20 ± 5)℃室温下,分别将Pae-NE 稀释5、20、50、100 倍,考察稀释倍数是否对粒径有影响。结果表明,稀释5、20、50、100 倍后,其粒径分别为23.96、23.54、22.75、23.32 nm。说明稀释100 倍以内对Pae-NE 的稳定性影响较小。
2.3.8 Pae-NE 载药量的测定 取Pae-NE 供试品溶液、Pae 对照品溶液适量,采用0.22 µm 微孔滤膜滤过,取续滤液,按“2.1”项下方法测定Pae 峰面积,根据公式计算得 Pae-NE 的含量。测得3 批次Pae-NE 的载药量分别为1.949、1.999、1.953 mg/mL,平 均 值 为(1.967 ± 0.28) mg/mL,RSD 为0.014%。
2.3.9 Pae-NE 包封率的测定 取Pae-NE 乳液0.25 mL 置10 mL 量瓶中,无水乙醇溶解并定容,按“2.1”项下方法测定,根据峰面积计算Pae 含量(Wtotal);另取Pae-NE 乳液2 mL 于截留分子量50 000 超滤管上 腔中,3 500 r/min 离心30 min,取超滤液0.25 mL 置于10 mL 量瓶中,无水乙醇稀释并定容,按“2.1”项下方法测定,记录峰面积,根据峰面积计算游离Pae 的含量(Wfree),计算得3 批次Pae-NE 包封率为分别为99.27%、99.34% 和99.46%,平均值为(99.36 ± 0.1) %。2.4 体外释放及释放机制的研究
采用动态透析法考察Pae-NE的释药性[14]。采用磷酸盐缓冲溶液(PBS,pH 7.4)为释放介质,在处理后的透析袋中分别加入Pae-NE 溶液1 mL 和相当量的Pae 原料药,两端用细绳密封,将袋子放入装有释放介质99 mL 的圆底烧瓶中,置(37 ± 0.5) ℃恒温水浴摇床上以100 r/min 的速度振荡。分别在0.25、0.5、1、2、4、8、12、24 h取出溶液1 mL,同时加入相同温度和体积的新鲜透析液,按“2.1”项下条件进样测定并记录峰面积。计算其累积释放率(%),以时间t为横坐标,累积释放率为纵坐标绘制曲线图,拟合释放曲线,结果见图2。为初步研究Pae-NE 的释药机制,根据体外累积释放量(Qn)进行各释放方程拟合及相关系数的比较,结果见表2。

Figure 2 Cummulative release profiles of Pae-NE in vitro(± s, n = 3)
结果表明,Pae-NE 在12 h前释放的速率较Pae更快,累积释放率达到了81.77%,而在12 ~ 24 h后释放速率变化不大。分别使用Weibull 模型、Ritger-pappas 模型、一级释放模型、零级释放模型、Higuchi 模型进行拟合,结果说明Pae-NE 释放模式可能符合Weibull 模型,表明体外释放的过程是连续和动态的。
2.5 细胞实验
2.5.1 细胞培养 用含10%血清、1%双抗的RPMI 1640 培养基将细胞培养在37 ℃、5% CO2、饱和湿度的培养箱中。当细胞融合达到80% ~ 90%时用于后续实验。
2.5.2 MTT 法检测安全浓度范围 以每孔5 000个细胞的密度接种于96 孔板中,每孔加入完全培养基200 µL,并设置3 个复孔,最外圈加入PBS 溶液200 µL,24 h 细胞贴壁后,吸出旧的培养基,在不同的96孔板中分别加入相应浓度的Pae、Pae-NE和纳米乳空白载体组(B-NE),以未处理的细胞作为正常对照组(Control)。24 h 后加入5 mg/mL 的MTT 20 µL,轻轻摇匀,避免液体流出,孵育4 h 后吸出上清液,加入DMSO 150 µL,振摇10 min,至蓝紫色结晶溶解,采用酶标仪在490 nm 波长下测吸收度(A),按公式(细胞存活率 =Atest/Acontrol× 100%)计算细胞存活率,结果见图3。结果表明,与正常组比较,当与Pae 质量浓度 10-1~ 10-3µg/mL 相当时,Pae-NE、B-NE 对HUVECs的生长无显著影响。

Table 2 Fitting results of the Pae-NE in vitro release model
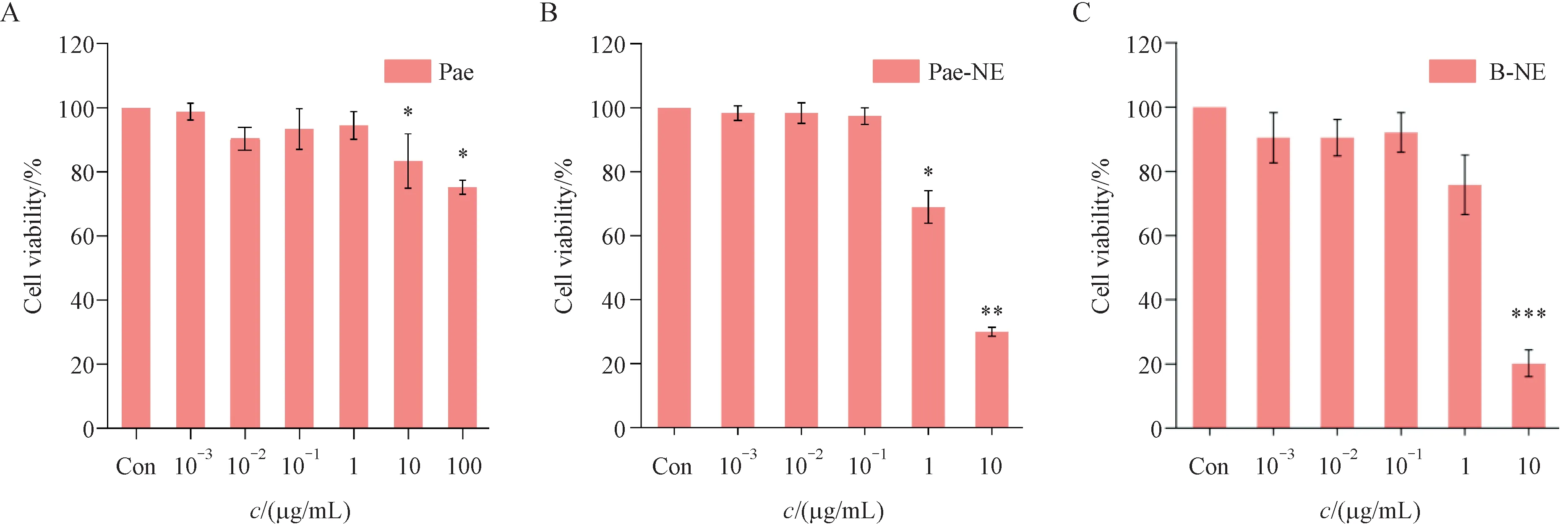
Figure 3 Cell viability of Pae (A), Pae-NE (B), and B-NE (C) (± s, n = 3)
2.5.3 荧光显微镜考察HUVECs 细胞定性摄取 将适量绿色荧光探针香豆素6(C6)加入油相,按“2.3.3”项下最佳处方制备Pae-NE,得含C6 的Pae-NE 样品;将C6 和Pae 一起加入到适量DMSO中充分溶解,得含C6 的Pae 样品;以C6 溶液为空白对照组。取对数生长期的HUVECs 细胞株以每孔1 mL,每孔50 000 个细胞的密度接种于12 孔板中,培养24 h,吸出培养基,分别加入含C6 质量浓度为100 ng/mL 的C6、Pae 以及Pae-NE 样品液,孵育4 h。用预冷的PBS 洗3 次,加入0.5%多聚甲醛固定液500 µL,避光10 min,弃固定液,PBS 洗2遍,每次洗3 min,弃去PBS,加入DAPI(10 µg/mL)染色液300 µL,染色8 min,去染色液,PBS 洗2 遍,每次3 min,倒置荧光显微镜观察并拍摄图像,结果见图4。结果表明,C6 和Pae 组中没有明显的绿色荧光,而Pae-NE组中绿色荧光较强,说明NE作为载体能够增强细胞对Pae的摄取。

Figure 4 Qualitative analysis of cell uptake of C6 (A), Pae (B) and Pae-NE (C)
2.5.4 流式细胞仪考察HUVECs 细胞定量摄取 将细胞密度调整为每孔80 000 个,接种于12 孔板中,培养24 h 贴壁后,吸出培养基,用PBS 洗两次,分别加入含C6 质量浓度为100 ng/mL 的Pae 以及Pae-NE样品液1 mL,以只加入相同浓度的C6 溶液组作为对照组孵育4 h,用PBS 清洗3 次,0.25%胰酶消化,1 000 r/min离心5 min,加入PBS 1 mL重悬细胞,流式细胞仪进行检测,结果见图5。流式定量实验结果与荧光显微镜结果一致,Pae-NE 组的荧光摄取均比C6、Pae组高(P< 0.001)。
3 结论与讨论
血流是药物递送系统从给药部位到预定作用部位的主要运输途径。血管内皮具有代表了血液可获得的一个巨大的表面积[15]。在许多情况下,血管系统的组成部分代表治疗靶点。内皮细胞排列在血管系统的管腔表面,扮演着血流中纳米药物的关键靶点[3]。在心血管疾病的进程中,血管内皮通透性增加,这为纳米药物输送系统提供一种将药物从管腔侧运输到内部的捷径[16]。
文献报道和实验室前期研究表明,采用单独的LCT 或MCT 均对人体产生不利影响,混合油相有利于降低单一油相脂质的风险,并提高稳定性[13-14]。故本课题以脂溶性药物Pae 为模型药物,以MCT 与LCT 比3∶1 为混合油相,采用低能乳化法中的相转变法进行Pae-NE制备考察。此法可以降低制备过程对药物的物理破坏,适合于Pae这类熔点低、不耐热的物质。同时因其制作方法简单、成本低、稳定性高等优点[17],是制备纳米乳常用的方法。
体外释放结果表明,Pae-NE 中存在的油相与乳化剂等可以提高Pae 的溶解度[18],Pae 可能以更好的分子状态分散于纳米乳中,改善释放度,使得纳米乳表面及其附近的区域所吸附或乳液中药物快速进入释放介质中,从而有利于难溶性药物的释放,并在早期以较为恒定的速度缓慢释放;吸附形式的Pae 释放完毕后以及亲脂性药物Pae 与NE内部的脂质基质之间的强亲和作用,更多的药物被包埋在纳米乳的油核中,后期释放较难。但整个体外释放的过程是连续和动态的。
Pae-NE 对HUVECs 的安全浓度范围考察结果表明,Pae-NE 中含Pae 为10-1时,对HUVECs 的生长无显著抑制作用,说明所制备的Pae-NE 可能具有较大的安全浓度范围,然而当质量浓度达到10 µg/mL 时,HUVECs 的损伤较大,可能是混合乳化剂用量过大,透过性增强或进入细胞的剂量过大或两者加和原因所致。另外,本研究得到的Pae-NE 显著提高了Pae 在HUVECs 中的摄取效率,可能是由于纳米乳具有粒径小、乳剂油相与细胞膜性质相似等特点,增强了HUVECs 对Pae 的摄取,为Pae和血管损伤相关递送系统研究提供了参考。

Figure 5 Quantitative analysis of cell uptake of C6, Pae and Pae-NE
