LRP6基因突变导致选择性先天缺牙的研究进展
2023-01-19蒋彩玲赵彬吴轶群
蒋彩玲, 赵彬, 吴轶群
1. 山西医科大学口腔医学院,山西 太原(030012); 2.上海交通大学医学院附属第九人民医院口腔第二门诊部,上海(200125)
选择性先天缺牙(selective tooth agenesis,STA)是常见的遗传性疾病之一,根据缺牙数目可分为少数牙缺失(1 ~5 颗牙缺失)、多数牙缺失(≥6 颗牙缺失)和全口无牙,其中少数牙缺失最为常见,发病率约为4.6%~9.6%;多数牙缺失较为罕见,发病率约为0.16%[1],研究表明缺牙率与性别无明显关联[2]。根据是否伴有外胚层发育异常如毛发稀疏、汗腺异常等全身其他症状分为综合征型先天缺牙(syndrome tooth agenesis,STA)和非综合征型先天缺牙(non-syndrome tooth agenesis,NSTA)[3]。导致选择性先天缺牙的主要原因是牙发育相关基因突变使牙胚发育提前终止[4]。目前导致选择性先天缺牙常见的突变基因包括WNT10A(26.0%)、PAX9(24.7%)、MSX1(14.5%)、AXIN2(6.1%)、EDA(5.9%)、低密度脂蛋白受体相关蛋白6(low-density lipoprotein receptor-related protein 6,LRP6)(4.1%)等[5-8]。目前关于LRP6 基因突变导致选择性先天缺牙的表型及基因突变特点仍需进一步研究。
因此,笔者通过PUBMED 检索LRP6 基因突变导致选择性先天缺牙(截至2021 年10 月末),共收集到突变位点24 个及有详细缺牙位置描述的患者38 例进行基因突变特点及表型分析,总结LRP6 基因突变导致选择性先天缺牙类型、数目、位置等特点,有助于加深对LRP6 基因突变导致选择性先天缺牙的认识,希望为后续研究和临床诊断及精准治疗提供一定参考。
1 LRP6 基因突变导致选择性先天缺牙的临床表型
LRP6 基因突变通常导致非综合征型先天缺牙(84.21%),也可导致综合征型先天缺牙(15.79%)(图1a)。根据收集到的38 例患者缺牙数目及缺牙位置统计,LRP6 基因突变导致选择性先天缺牙常表现为多数牙缺失(68.42%),少数患者表现为少数牙缺失(31.58%),未见全口无牙的报道(图1b)。LRP6 基因突变患者缺牙好发牙位为上颌侧切牙(80.25%),其次为下颌第二前磨牙(61.83%)、上颌第二前磨牙(59.21%),常呈对称性缺失,而上颌第一磨牙(3.94%)、下颌第一磨牙(1.31%)较少缺失,上颌中切牙未见缺失(图1c、1d)。患者平均缺牙数目及中位数都为9,缺失牙数最多可达18 颗(1 例),最少为1 颗(5 例)(表1)。LRP6 基因突变不仅导致牙齿数目缺失,还可导致牙齿形态异常,包括上颌侧切牙或上颌中切牙表现为过小牙、上颌第一磨牙表现为牛牙症等[6,8]。
部分LRP6 基因突变患者除缺牙表型外还存在全身其他症状,包括耳朵微小变异、拇指发育不全[6];唇腭裂、宽鼻底、鼻翼过大、鼻梁过宽及下颌后缩、面中部发育不良等颅颌面发育异常[7];还可表现为毛发稀疏、出汗减少等外胚层发育不良症状[8]。根据既往文献报道,LRP6 基因突变主要表现为非综合征先天缺牙,主要表现为多牙缺失(≥6 颗牙缺失),少数伴有牙齿形态、大小异常;极少数表现为综合征型先天缺牙,多为颅颌面发育异常。
2 LRP6 基因突变导致选择性先天缺牙的基因突变特点分析
LRP6 基因位于常染色体12p12.3,共编码1 613 个氨基酸,分为胞外段、跨膜段和胞内段,突变好发于胞外段(表1)[9-14]。LRP6 基因突变导致选择性先天缺牙的遗传方式为常染色体显性遗传,主要为杂合子突变[13]。LRP6 基因突变方式主要为由单个碱基的替换而导致的错义突变(missense,45.83%)或无义突变(nonsense,12.50%)、插入或缺失单个或数个碱基而导致的移码突变(frameshift,25.00%)及在内含子区引起剪切位点改变的关键位点突变(16.67%)(图2)。根据LRP6 晶体结构解析绘制LRP6 氨基酸结构域示意图,关键结构域为β-螺旋(beta propeller,BP)和表皮生长因子样结构域(EGF-like domain),为4 个重复亚结构域的组合,标注LRP6 外显子区突变导致的氨基酸序列改变位置,提示LRP6 胞外段关键结构域(E1、E2、E3、E4)更易发生突变(图3)[15]。
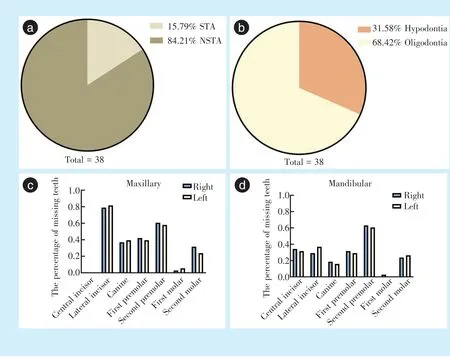
Figure 1 An analysis of the phonetypes of tooth agenesis caused by LRP6 gene mutation图1 LRP6 基因突变导致先天缺牙表型的分析
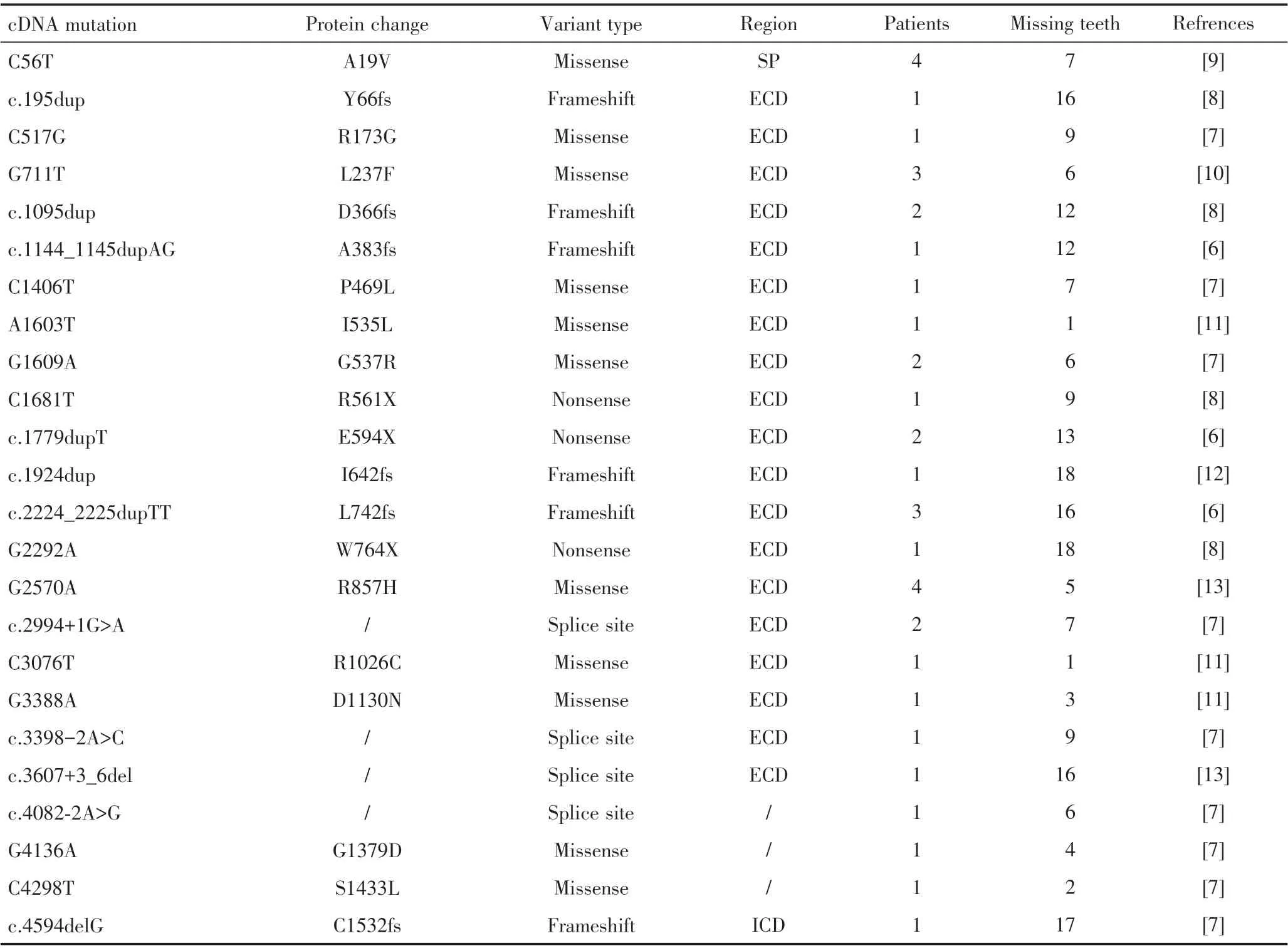
表1 导致先天缺牙的LRP6 基因突变位点总结Table 1 A summary of the LRP6 gene mutation sites leading to tooth agenesis
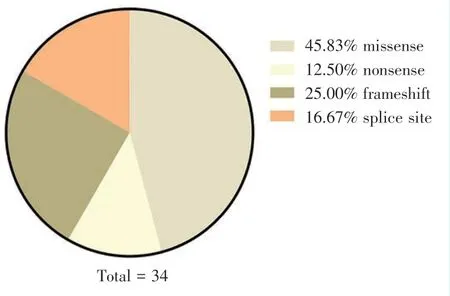
Figure 2 Summary of amino acid changes caused byLRP6 gene mutation图2 LRP6 基因突变导致氨基酸变化方式总结
3 LRP6 基因突变导致选择性先天缺牙的分子机制探讨
LRP6 基因突变导致蛋白质功能丧失或减弱是选择性先天缺牙的致病机制之一。c.C56T(A19V)、c.G711T(L237F)、c.A1603T(I535L)、c.G2570A(R857H)等错义突变可导致LRP6 蛋白质三级结构构象发生改变,如脂肪族类亮氨酸(leucine,L)突变为芳香族类苯丙氨酸(phenylalanine,F),蛋白质亚细胞定位异常,与WNT结合能力受损,丧失对下游信号通路的激活能力[6,10,16]。c.1779dupT(E594X)、c.G2292A(W764X)、c.C1681T(R561X)等无义突变导致LRP6蛋白截短,功能丧失甚至产生显性负效应[6,8]。c.1095dup(D366Rfs*13)、c.4594delG(C1532fs)等移码突变导致蛋白序列错乱、翻译提前终止而引起突变蛋白发挥显性负效应、末端磷酸化异常并丧失激活下游通路的能力[7-8]。c.3607+3_6del、c.3398-2A>C 等内含子区域的突变导致mRNA 稳定性下降,破坏原有的剪切位点或形成新的剪切位点而使蛋白结构和功能异常[7,13]。
4 LRP6 基因在牙发育中的作用
牙齿发育是由上百种基因参与调控的动态过程,根据时间发展可分为原始牙板期、蕾状期、帽状期、钟状期、牙根发育期和萌出期[17]。牙胚发育源于上皮与间充质的相互作用,参与调控细胞生长与分化的关键信号通路为WNT/β-catenin 通路、FGF-BMP 通路、TGF-β 通路和SHH(sonic hedgehog)通路[18]。在牙发育早期,上皮细胞中FGF8 驱动牙齿开始发育,此时去除β-catenin 可使牙齿发育停止,说明WNT/β-catenin 信号在牙胚早期开始发挥作用[19]。小鼠实验表明LRP6 基因在牙发育过程中全程表达,尤其是帽状期呈现高表达状态[8]。LRP6 蛋白为WNT/β-catenin 信号通路中的关键跨膜蛋白,作为共受体与WNT、Frizzled 形成三聚体发挥功能[20]。LRP6 基因敲除实验证实WNT 信号激活依赖于LRP6 共受体的特定功能,在WNT 通路中具有不可替代的作用[21]。近期有研究表明,LRP4 与LRP5/LRP6 相互作用参与WNT/β-catenin信号通路的调控促进牙齿发育[9]。细胞与小鼠实验均表明LRP6 基因在WNT/β-catenin 信号通路中不可替代,该基因异常可导致整个通路中断,而WNT 信号通路参与牙发育全程,因此LRP6 基因在牙发育中至关重要,功能异常可使牙形成障碍从而表现为先天缺牙。缺牙数目及严重程度可能与突变位点导致的失功能程度有关,但由于文献证据有限未能得出确切结论,仍需进一步研究。
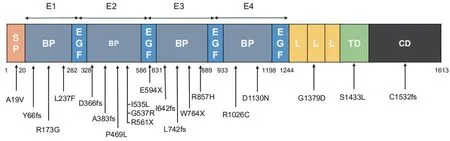
Figure 3 Summary of the substructure of LRP6 and mutation sites图3 LRP6 蛋白结构域及突变总结
5 选择性先天缺牙的临床诊疗
选择性先天缺牙是牙齿发育异常的疾病之一,主要累及恒牙列,少数累及乳牙列[22]。该疾病损害患者的咀嚼、面部美观和心理健康,对生活质量造成严重影响[23-24]。目前临床上诊断先天缺牙主要通过患者主诉、家系调查、口腔专科检查和全景片等,分子诊断学主要为采集患者外周静脉血进行全外显子测序检测突变基因和位点并进行Sanger 测序验证[25]。由于单基因突变导致的选择性先天缺牙的患者缺牙数目及缺失牙位存在极强的个体差异性,同一突变基因不同患者表型也不相同[26]。因此认为选择性先天缺牙的治疗需要个性化设计,因人制宜。对于少数牙缺失的患者,可通过正畸关闭间隙、种植修复等方式恢复牙列完整[27-28]。对于多颗牙缺失患者,则需要多学科联合诊疗,共同探讨进行合理方案设计,包括儿童口腔科早期发现早期维护、正畸恢复患者正常牙列关系、正颌手术矫正患者骨性错、种植修复恢复患者缺失牙位、牙周科长期维护等[29]。对于无牙颌患者,根据患者自身牙槽骨剩余骨量和经济条件可选择全口活动义齿修复、种植覆盖义齿修复、种植固定义齿修复或穿颧种植修复[30]。以上治疗手段均为对症治疗,尚缺乏基因层面的精准治疗,未来希望通过更多研究实现在胚胎时期通过采取对因治疗、剂量补足等方式促进牙胚继续发育,实现精准治疗,提高患者生活质量[31]。
6 总 结
综上,本文总结了既往报道的LRP6 基因导致选择性先天缺牙的临床表型及基因突变特点,共纳入24 个突变位点的38 例患者,分析得出LRP6基因突变常导致多牙缺失,可表现为非综合征型或综合征型,可伴有牙齿形态异常。上颌第二侧切牙为最常见的缺失牙位,其次为第二前磨牙。LRP6 基因突变多位于胞外结构域,突变导致蛋白功能减弱或丧失是选择性先天缺牙的致病原因。这些特征的总结有助于加深对LRP6 基因突变导致选择性先天缺牙的理解,为该方向的深层次研究提供一定研究基础。
【Authors contributions】 Jiang CL contributed to the research design, data recruitment and analysis, writing of the manuscript. Zhao B,Wu YQ contributed the research design, revision. All authors read and approved the final manuscript as submitted.
【Acknowledgement】 We acknowledge the Natural Science Foundation of Shanghai(No. 21ZR1437700).
