不同高强度电磁脉冲对大鼠髁突软骨的生物学效应研究
2023-01-19马原军王晋董青山何峰陈晓华苗辉于世宾
马原军, 王晋, 董青山, 何峰, 陈晓华, 苗辉, 于世宾
1. 军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔疾病国际联合研究中心,第四军医大学口腔医院解剖生理学教研室,陕西 西安(710032); 2.中国人民解放军中部战区总医院口腔科,湖北武汉(430070); 3.第四军医大学军事预防医学系辐射防护医学教研室,陕西 西安(710032)
与大多数科学技术一样,电磁脉冲(electromagnetic pulse,EMP)是一把“双刃剑”,不同强度的物理参数作用于生物体,会产生不同的生物学效应[1]。近年来国内外学者对EMP 的生物学效应研究主要集中在低频率(频率小于100 Hz)、低能量(磁场强度小于20 mT)领域,并发现适宜的EMP 可直接作用于软骨和骨,积极维护软骨和骨的内稳态[2-7],并且还能促进骨内血管生成[8]。而对于高能EMP 的生物学效应研究较少。颌面部属于人体的主要暴露部位,在现代战争中致伤机会较多,更易受到EMP 的影响。颞下颌关节(temporomandibular joint,TMJ)是颌面部唯一的关节,更是口颌系统功能(开闭口、咀嚼、言语等)发挥的关键结构,其主要组成部分髁突软骨更是下颌骨的重要生发中心,具有终身改建能力。因此,探究高强度EMP 对髁突软骨的生物学效应具有重要意义。本研究拟探索不同高强度(电场强度在100~1 000 kV/m)EMP 照射对大鼠髁突软骨的生物学效应。
1 材料和方法
1.1 动物、EMP 暴露和TMJ 组织制备
取8周龄雄性SD大鼠66只,体质量190 ~210 g,由第四军医大学动物中心提供(动物合格证号:SYXK(陕)2021-0036)。将大鼠随机分为假辐照组(Sham 组)、辐照组(EMP 组),并按照场强的不同,将EMP 组 分 为EMP1 组(500 kV/m)和EMP2 组(270 kV/m)。EMP 组大鼠均接受持续10 000 次的脉冲电磁辐射,频率10 Hz,脉宽40 ns,上升前沿20 ns,重复频率1 pps。根据辐照后1 h、3 h、12 h、24 h、3 d 不同取材时间点将EMP 组大鼠分为5 个亚组,每组均6 只大鼠。研究期间,所有的大鼠都在无菌环境下饲养,并喂食灭菌食物和蒸馏水,本研究经第四军医大学口腔医学院动物伦理委员会审核通过(审批号:2021 伦审字080 号)。
于辐照后1 h、3 h、12 h、24 h、3 d 用1%戊巴比妥钠(30 mg/kg)麻醉动物,解剖分离双侧TMJ 组织,其中每只大鼠的左侧TMJ 于4%多聚甲醛中固定24 h,脱钙后石蜡包埋,进行连续切片;右侧TMJ沿髁突头部将软骨组织剪下并放于-80 ℃冻存,用于Western blot 检测。
1.2 主要试剂和仪器
免疫组化:COL2A1 小鼠抗体(sc-52658,Santa Cruz,美国)、ADAMTS-5 兔抗体(DF13268,Affinity,美国)、MMP-13 兔抗体(DF6494,Affinity,美国)、cleaved-Caspase3 兔抗体(AF7022,Affinity,美国)。
Westerm blot:ADAMTS-5 兔抗体(DF13268,Affinity,美国)、MMP-13 兔抗体(DF6494,Affinity,美国)、cleaved-Caspase3 兔抗体(AF7022,Affinity,美国)。β-actin 兔抗体(4970S,CST,美国)。Tripure裂解液(Roche,德国),SDS-PAGE 配胶试剂盒(Bio-Rad,美国)。BCA 试剂盒(Thermo Fisher Scientific,美国)。Chemi-Doc XRS+WB 发光成像系统(1708265,Bio-Rad,美国)。
硬组织切片机(RM2255,徕卡,德国),光学显微镜(DM2000,徕卡,德国),荧光显微镜(CKX53,Olympus,日本),HE(碧云天,中国)和番红O固绿(Sigma-Aldrich,美国),TUNNEL 试剂盒(碧云天,中国)。
1.3 HE 染色和番红O 固绿染色
将石蜡切片常规脱蜡至水,分别进行HE 和番红O 固绿染色。在光学显微镜下观察髁突软骨中带的形态(图1 虚线所示)并拍照,在Photoshop 软件中测量软骨全层厚度(图1 直线所示)和番红O固绿阳性面积占比。
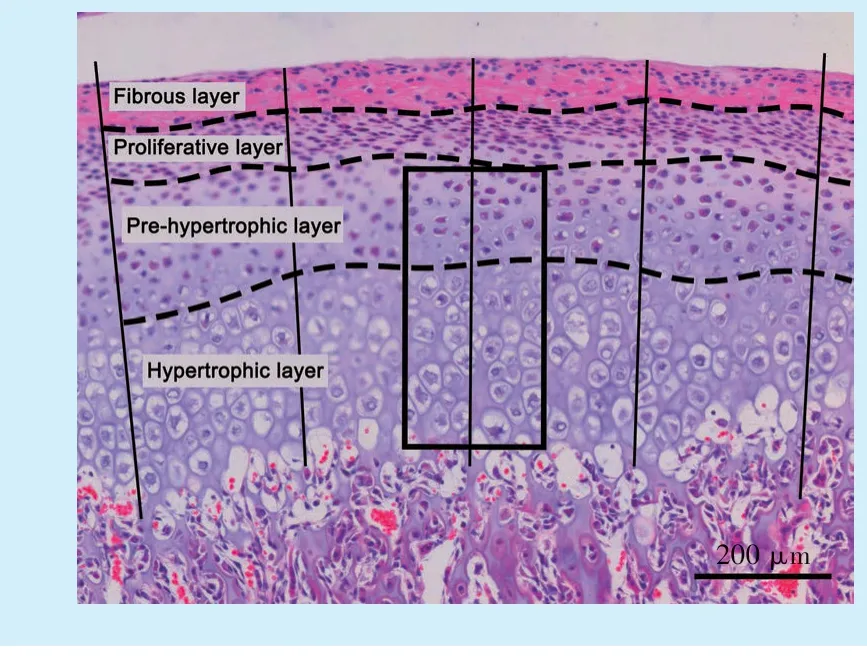
Figure 1 Schematic diagram of TMJ cartilage histomorphology in rats(×200)图1 大鼠TMJ 软骨组织形态学示意图(×200)
1.4 免疫组化染色
石蜡切片常规脱蜡至水,参照SABC 法进行免疫组化染色。使用COL2A1抗体(1∶50)、ADAMTS-5抗体(1∶200)、MMP-13 抗体(1∶200)、cleaved-Caspase3 抗体(1∶200)。采集图像后,在200 倍视野下的软骨中带随机选取3 个1 000 dpi × 2 000 dpi 且覆盖全部肥大层的区域(图1 方框所示),计算Ⅱ型胶原阳性面积比和阳性细胞率。
1.5 TUNEL 染色
石蜡切片常规脱蜡至水,参照说明书进行TUNEL 染色以检测软骨细胞凋亡情况。在荧光显微镜下进行分析,每组随机选取3 张图像进行计数并比较各组软骨中TUNEL 阳性细胞数量。
1.6 Western blot 检测
通过Tripure 裂解液溶解髁突软骨组织并提取总蛋白,BCA 法测定蛋白总量。SDS-PAGE 电泳分离蛋白,转膜,分别用ADAMTS-5(1∶1 000)、MMP-13(1∶2 000)、cleaved-Caspase3(1∶2 000)的一抗进行孵育。β-actin(1∶4 000)作为内参对照。二抗孵育后常规ECL 发光,然后在Chemi-Doc XRS+WB 发光成像系统下显影。图像采集后运用Image Lab 5.2.1 软件进行分析。
1.7 统计学分析
采用双盲法对所有图片进行采集、计数。所有数据以均数±标准差的形式表示,采用SPSS 23.0对数据进行统计分析,多组之间的差异采取oneway ANVOA 检验,组与组之间的两两比较采取Tukey 检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 高强度的EMP 照射引起了髁突软骨的退行性变
如图2 所示,在Sham 组中,HE 染色显示髁突软骨各层细胞排列规则,层次清晰,纤维层表面完整;番红O 固绿染色显示,染色阳性的蛋白聚糖分布均匀、规则,主要分布于软骨肥大层及前肥大层,少量分布于增殖层,且与固绿着色分界清晰;Ⅱ型胶原免疫组化染色显示,Ⅱ型胶原阳性区域与蛋白聚糖类似,主要分布于肥大层及前肥大层。
经EMP 暴露后,HE 染色显示EMP1 组辐照后1 h、3 h、12 h、24 h、3 d 和EMP2 组辐照后1、3 h 的髁突软骨表层完整性遭破坏,出现了纤维层少量剥脱(箭头所示),各组髁突软骨厚度对比Sham 组均未见明显差异(P>0.05);番红O 固绿染色显示EMP 两组辐照后12、24 h 出现了蛋白聚糖的分布不规则,阳性面积百分比显著下降(EMP1 12 h:q=4.882,P<0.01;EMP1 24 h:q= 5.808,P<0.01;EMP2 12 h:q= 3.001,P<0.05;EMP2 24 h:q=3.990,P<0.05);Ⅱ型胶原免疫组化染色显示对比Sham 组,EMP1 组辐照后3、12 h 出现了Ⅱ型胶原的染色不均,阳性面积百分比显著下降(3 h:q=3.546,P<0.05;12 h:q= 6.760,P<0.001),而EMP2 组未见明显异常(P>0.05)。
2.2 高强度的EMP 照射促进了髁突软骨基质降解因子的表达
如图3 所示,在Sham 组中,免疫组化染色结果显示软骨基质降解因子ADAMTS-5 和MMP-13 主要分布于髁突软骨前肥大层和肥大层浅层,阳性细胞少且染色浅。
对比Sham 组,EMP1 组中ADAMTS-5 在辐照后3、12、24 h(3 h:q= 3.394,P<0.05;12 h:q= 5.530,P<0.01;24 h:q= 4.923,P<0.01)和MMP-13 在辐照 后3、12 h(3 h:q= 3.758,P<0.05;12 h:q=5.312,P<0.01)的染色阳性细胞率显著增大,并逐渐扩大到肥大层全层。EMP2组中,ADAMTS-5在辐照 后3、12 h(3 h:q= 3.213,P<0.05;12 h:q=3.168,P<0.05)和MMP-13 在 辐 照 后12 h(q=3.030,P<0.05)的染色阳性细胞率对比Sham 组显著增大,而分布范围较EMP1 组小。
如 图4 所 示,经EMP 暴 露 后,对 比Sham 组,EMP1 组髁突软骨的ADAMTS-5 蛋白表达在辐照后1、3、12 h 明显上升(1 h:q=3.779,P<0.05;3 h:q=2.962,P<0.05;12 h:q= 3.098,P<0.05),MMP-13蛋白表达在辐照后1、3 h 明显上升(1 h:q= 3.509,P<0.05;3 h:q= 3.024,P<0.05);EMP2 组髁突软骨的ADAMTS-5 蛋白表达在辐照后1 h 明显上升(q= 4.189,P<0.05),而MMP-13 蛋白表达在各时间点未见明显差异。
2.3 高强度的EMP 照射促进了髁突软骨细胞的凋亡
如图5 所示,在Sham 组中,髁突软骨全层几乎没有TUNEL 染色阳性的凋亡细胞。对比Sham 组软骨,EMP1 组在辐照后1、3、12、24 h(1 h:q=3.063,P<0.05;3 h:q= 4.940,P<0.01;12 h:q=5.518,P<0.01;24 h:q= 4.048,P<0.01)和EMP2组软骨在辐照后1、3、12 h(1 h:q=3.155,P<0.05;3 h:q= 3.627,P<0.05;12 h:q= 3.651,P<0.05)时,TUNEL 阳性细胞数量明显增多,并且TUNEL 阳性细胞多位于髁突软骨的纤维层及增殖层。凋亡关键分子cleaved-Caspase3 的免疫组化染色结果显示,Sham 组中染色阳性细胞数量较少且染色浅。对比Sham 组软骨,EMP1 组在辐照后1、3、12 h(1 h:q= 3.420,P<0.05;3 h:q= 5.251,P<0.01;12 h:q= 4.273,P<0.01)和EMP2 组在辐照后3 h、12 h(3 h:q= 3.594,P<0.05;12 h:q= 3.455,P<0.05)时,cleaved-Caspase3 阳性细胞率明显上升,并且出现胞质深染,阳性范围扩大到增殖层。
如图4 所示,经EMP 暴露后,对比Sham 组,EMP1 组髁突软骨的cleaved-Caspase3 蛋白表达在辐照后3、12、24 h 明显上升(3 h:q= 3.964,P<0.01;12 h:q= 4.775,P<0.01;24 h:q= 3.043,P<0.05);EMP2 组髁突软骨的cleaved-Caspase3 蛋白表达在辐照后3 h 明显上升(q=3.798,P<0.05)。
3 讨 论
近年来随着无线电通讯设备和电磁能设备使用的迅速增长,EMP 对人类健康的影响越来越受到公众的关注。目前国内外文献中仅有少量研究尝试模拟高频、高场强的EMP 来探索其生物学效应。2015 年Liu 等[9]发现900 MHz 的高频辐射可以导致精子脂质过氧化增加。2019 年Li 等[10]发现1 800 MHz 的电磁辐射可引起NIH/3T3 细胞凋亡率增加、凋亡相关分子p53 表达上调和线粒体损伤。2019 年Li 等[11]将大鼠置于400 kV/m 的电磁场中给予200 次脉冲刺激1、6、24 h 后,发现大鼠大脑皮层细胞凋亡,出现明显的神经元损伤,其机制可能通过Toll 样受体(Toll-like receptors 4,TLRs)/核因子κB(nuclear factor kappa-B,NF-κB)信号激活了小胶质细胞并诱导了炎症反应。2020 年王文莹等[12]研究发现场强700 kV/m、频率1 Hz 的EMP 照射7、14 d 能够明显损伤大鼠的海马体神经元,并且损伤程度与暴露时间呈正相关。以上研究均提示一定强度EMP 可以造成机体损伤,但目前国内外尚未见到有关高强度EMP 对颌面部组织的生物效应研究。
作为TMJ 的重要组成部分和颌面部骨骼的重要生发中心之一,髁突软骨属纤维软骨。在复杂的下颌运动中,髁突软骨发挥着重要的应力缓冲、关节润滑等作用[13]。髁突软骨主要由软骨细胞和软骨细胞外基质构成,基质中含有丰富的蛋白聚糖和Ⅱ型胶原成分,这些成分对于维持软骨的抗剪切、抗拉伸、抗压缩性能至关重要[14]。然而,一旦TMJ 发生病变,软骨基质成分和细胞因子的改变可以直接或间接地参与关节退变过程[15]。髁突软骨退变早期主要表现为软骨基质降解、软骨细胞凋亡等[15-17],继而引起软骨下骨的异常骨改建[18]。本实验模拟了高强度电磁辐射环境对大鼠TMJ 软骨的生物学效应,发现在EMP 组中大鼠髁突软骨纤维表层出现了不同程度的剥脱、软骨细胞外基质蛋白聚糖和Ⅱ型胶原的染色异常、髁突软骨细胞基质降解和凋亡相关分子表达升高、TUNEL 阳性的凋亡细胞数量增多等早期关节退变症状,这提示髁突软骨是高强度EMP 的重要靶器官,高强度的EMP 可以诱发髁突软骨的退行性变,直接影响软骨稳态的维持。该结果与当前研究中报道的低频率、低能量EMP 可以显著逆转骨关节炎(osteoarthritis,OA)进程中的软骨退行性变进程[19-22]恰好相反,这也进一步印证了EMP 的“双刃剑”效应。
本研究中观察到实验组的大鼠髁突软骨在EMP 辐照后的24 h 内均出现了明显损伤,并且损伤持续时间随辐照参数不同而产生差异,但最终两组病损随时间逐渐恢复,并在3 d 时检测指标未见明显差异,这提示EMP 可以造成大鼠髁突软骨早期的一过性损伤。然而也有文献报道EMP 的生物学效应具有波动性,其能量在动物体内蓄积后可以在较长的时间内,在不同时间点导致不同程度的损伤效应[23-24]。因此,EMP 对大鼠髁突软骨的远期损伤效应有待进一步研究。
与此同时,本研究仍然存在几点不足:首先实验中EMP 组大鼠仅接受了10 Hz、10 000 次的脉冲电磁辐射,即暴露时间约为17 min。其次,本实验以8 周龄雄性SD 大鼠为研究对象,未涉及雌性大鼠或其他年龄段雄性大鼠的影响,并且在检测指标中未对辐照后大鼠的行为学变化进行观察。未来将针对以上问题开展进一步研究。
【Author contributions】 Ma YJ, Yu SB designed the main experiments, analyzed the data and wrote article. Wang J, Dong QS, He F,Chen XH, Miao H contributed to the acquisition and analysis of data.All authors read and approved the final manuscript as submitted.
