外源物质对水稻盐胁迫缓解效应研究进展
2023-01-18刘淑丽张瑞ShahidHUSSAIN王洋陈英龙韦还和侯红燕戴其根
刘淑丽 张瑞 Shahid HUSSAIN 王洋 陈英龙 韦还和 侯红燕 戴其根,*
(1扬州大学 江苏省作物遗传生理重点实验室/江苏省作物栽培生理重点实验室/农业农村部盐碱土改良与利用(滨海盐碱地)重点实验室/江苏省粮食作物现代产业技术协同创新中心,江苏 扬州 225009;2东营市一邦农业科技开发有限公司,山东 东营 257000;*通信联系人,email:qgdai@ yzu.edu.cn)
中国有超过3600万hm2的土地受到盐渍化的影响,占可利用土地的4.88%,其中受盐渍化影响的耕地面积约920万hm2,占全国耕地面积的6.62%[1-2]。作为主要的非生物胁迫因素之一,盐分会降低种子发芽率和种子活力,抑制作物正常的生长发育,最终降低作物产量和品质,严重时作物不能立苗生长。盐胁迫下植物会积累过量的Na+和Cl-,从而使植物受到渗透胁迫、离子胁迫、营养失衡等影响。渗透胁迫的产生是由盐胁迫早期根系周围盐浓度快速增加引起的,后期Na+积累导致营养失衡,进而产生离子毒性[3-4]。盐胁迫还会导致氧化胁迫以及赤霉素含量降低,脱落酸含量增加等激素变化,造成脂质过氧化、蛋白质氧化、膜损伤加剧,从而使植物的生长受到抑制[5-6]。活性氧(ROS)的过量产生还会导致各种细胞成分的氧化损伤并影响植物的重要细胞功能[7-8]。
水稻是我国第二大粮食作物,也是对盐中度敏感的禾本科植物,其对于盐胁迫的响应近年来在国内外备受关注。已有学者提出对当前基因型或品种耐盐性进行遗传改良作为解决盐胁迫问题的有效方法[9]。尽管已经开发出了许多技术,但还未发现这些方法在盐胁迫下完全有效。这是由于植物对盐胁迫的响应在细胞、组织或全株水平上存在差异,耐盐机制复杂,除盐胁迫外还涉及环境因素,缺乏有效的选择标准[9]。
通过对作物耐盐机理的研究,有学者提出利用化学调控手段来提高作物耐盐性[10]。已有研究表明从遗传角度提高植物抗性较为复杂且很难和高产、优质等农艺性状有机结合,而通过外源物质来缓解盐胁迫效应从技术层面上更简单、更容易操作,因此发展前景更有优势[11]。近年来许多研究发现,施用外源激素如赤霉素、褪黑素、水杨酸等[12-14]以及其他外源物质如硅、Ca2+、H2O2等[15]均能缓解盐胁迫对水稻的影响,有助于增强水稻的耐盐性。为此,本文结合大量研究报道,综述了生长素、赤霉素、细胞分裂素、脱落酸、乙烯五大类植物激素以及褪黑素、水杨酸、多胺、油菜素类固醇和茉莉酸类外源生长调节物质和钙、硅离子类外源物对水稻盐胁迫的缓解效应,以期为提高水稻的耐盐性奠定理论基础。
1 盐胁迫对水稻生长发育的影响
在盐胁迫下植物会积累Na+和Cl-,使植物生长初期主要受到渗透胁迫的影响,表现为根系对水分的吸收减少,导致代谢功能障碍、光合作用受抑等,并促进细胞渗透调节物质的积累[16]。随着Na+、Cl-的大量积累,植物体内Na+含量超过K+,导致Na+/K+比值升高,产生离子胁迫以及养分失衡,抑制酶促反应[17]。在盐胁迫后期,细胞内ROS过量产生造成脂质过氧化、蛋白质氧化、膜损伤增加等生理生化过程,最终导致植物生长受抑或死亡[18]。水稻对于盐胁迫的反应在各个时期的表现不同,其中在营养生长阶段早期及生殖阶段后期对盐较为敏感[19]。
种子萌发是植物生长发育的开始,也是决定幼苗生长质量的关键环节[20]。盐胁迫下水稻种子受到离子毒害作用,导致H2O2、O2·-和丙二醛(MDA)大量积累、内源性激素稳态失衡,如赤霉素含量降低,脱落酸含量增加等,并抑制α-淀粉酶活性,使淀粉水解速率降低,最终导致种子萌发受到抑制[21]。种子的发芽势、发芽率、发芽指数是表现种子萌发质量的重要指标,也是影响水稻能否立苗生长的关键因素[22]。在渗透胁迫及离子胁迫下,盐胁迫主要通过抑制种子的生理吸水及破坏膜结构来抑制种子萌发,降低种子各项发芽指标[23]。水稻苗期对盐胁迫最为敏感且最先受到影响的是根系[24]。研究表明,盐胁迫会抑制水稻根系的生长,影响根系的长度、数量、表面积以及生物量、根系活力等[25]。杜孝敬等[26]研究发现,不同香稻品种种子的各项发芽指标随盐浓度增加呈下降趋势,苗期根系生长及幼苗形态也显著受到抑制。
水稻是非盐生作物,盐胁迫会严重影响其个体形态及农艺性状,表现为株高变矮,分蘖数减少,叶面积较小,叶片枯萎等,其抑制作用随盐胁迫浓度提高而增强[27]。其中,孕穗期盐胁迫处理对水稻的株高、有效穗数、每穗实粒数、结实率、千粒重等经济性状及产量影响最大,其次是拔节期和抽穗期[28]。盐胁迫不仅会使植株表型发生变化,还会影响植株的生理适应机制。刘梦霜等[29]在研究不同品种水稻耐盐性时发现,随着NaCl浓度增大,各品种根系活力均不同程度下降,且盐胁迫会增强叶绿素酶活性,导致叶绿素含量减少。在轻度盐胁迫下,孕穗期水稻的蔗糖合成酶(SS)和磷酸蔗糖合成酶(SPS)活性会受到激发而增强,并促进了蔗糖、可溶性糖的积累,维持细胞渗透调节,从而提高植株抗逆性,而中度、重度盐胁迫会使SS和SPS活性降低,叶片中蔗糖合成与积累减少,表现为植株生长发育受到抑制[30]。此外,有研究发现水稻OsDSK2a可以调节赤霉素代谢和植物生长发育,而盐胁迫会降低OsDSK2a水平,导致赤霉素代谢负调控因子EUI蛋白积累,从而降低赤霉素活性,抑制植物生长[31]。
2 外源物质对水稻盐胁迫的影响
盐胁迫会诱发植株体内基因表达模式的改变,进而改变相关代谢途径,产生适应胁迫的生理变化[32]。而外源物质可以通过调控植物生理生化、活性氧、代谢酶、基因变化等细胞和分子水平缓解盐害,如调节离子平衡、增强光合作用及抗氧化酶活性、提高代谢物含量及渗透调节作用等[20],表现为种子萌发及幼苗生长得到改善、株高及分蘖数增加、产量提高等[35-40]。盐胁迫初期,外源物质能维持植物细胞的渗透调节,降低Na+/K+、维持K+和Ca2+吸收,缓解水分亏缺与离子毒害。随着盐胁迫时间的增加,植株遭受氧化胁迫,此时外源物质可以诱导抗氧化防御系统,增强抗氧化酶活性并增加抗坏血酸(ASA)和谷胱甘肽(GSH)含量,从而减少H2O2、O2·-和MDA的积累,维持ROS和激素稳态,降低脂膜过氧化,缓解植物细胞损伤[33]。维持植物内源激素的稳态被认为是外源物缓解盐胁迫的最初过程[33]。盐胁迫下IAA、CTK、GA与SA的减少及ABA与JA的增加导致植物生长受到抑制,外源物质的应用能通过调节植物激素合成及代谢基因的表达,维持细胞动态平衡并缓解盐害。
2.1 植物生长调节类物质对缓解水稻盐胁迫的影响
2.1.1 五大类植物激素
传统植物激素可分为促进型激素如生长素(indole acetic acid,IAA)、赤霉素(gibberellin,GA)、细胞分裂素(cytokinin,CTK)和抑制型激素如脱落酸(abscisic acid,ABA)、乙烯(ethylene,ETH)五大类[34]。近年来,关于外源激素处理提高植物抗逆性的研究较多。外源植物激素可缓解盐胁迫对水稻表型的影响,表现为种子胚根伸长,胚根数增加[35-36],秧苗个体形态得到缓解,存活率增加[37-38],水稻结实率、千粒重及产量增加[39]等。在盐胁迫下,植物激素可以通过信号整合来调控植物生长发育及环境适应的各个过程。有研究发现,在电导率为6±0.3 dS/m的盐胁迫下喷施50 μmol/L IAA使籽粒中IAA和细胞分裂素的水平升高,促进了细胞分裂、生长与分化及蔗糖、葡萄糖、淀粉含量的提高,从而影响籽粒灌浆过程,提高了水稻产量、千粒重和结实率[39-40]。此外,Saeed[40]外源应用IAA、CTK、ABA、GA四种植物生长调节剂,研究对IR29(盐敏感)和FL485(耐盐)两种籼稻品种的盐胁迫缓解效应时发现,IAA和CTK是提高盐胁迫下谷物产量的最有效方法。而采用叶面喷施CTK,有利于加快叶片光合速率,增加物质积累,从而促进小穗灌浆,最终使更多的可溶性蛋白质在籽粒中积累而增加产量。
赤霉素具有打破种子休眠、促进植株伸长生长及开花等作用[41]。张丽丽等[12]在水培试验中发现,50 mg/L外源赤霉素对盐胁迫下水稻种子萌发及幼苗生长的缓解效应最明显。盐胁迫下,外源GA3促进水稻叶绿体脂质的合成,维持水稻光合系统的稳定[42],并能缓解盐诱导的异黄酮还原酶(IRL)的减少及对淀粉合成的抑制,从而缓解盐胁迫对水稻生长的抑制作用[43]。GA和ABA是相互拮抗的激素,ABA会抑制种子萌发、植物开花和果实发育等[44]。DELLA蛋白作为GA的负调控因子具有提高植物抗逆性的作用[45],盐胁迫下植物可能会通过上调EUI1的表达来降低植株体内GA的含量,而积累DELLA蛋白并诱导ABA合成基因的表达[46-47],从而影响ABA信号途径,在抑制植物生长的同时提高其抗逆性[48]。有研究发现一种新的A20/AN1型锌指蛋白ZFP185,在GA和ABA的生物合成中起负作用,会导致生长抑制和抗逆性下降,而外源GA3的应用能缓解ZFP185过表达植株的生长,且ZFP185-Ox植株对非生物胁迫敏感性的提高可能与水稻中某些ABA和胁迫相关基因的表达减少有关[49]。
脱落酸和乙烯都是具有抑制作用的天然生长调节剂。在逆境胁迫下,植株体内脱落酸含量会显著升高,并且在应对环境胁迫的过程中呈现不同的反应,促进种子休眠和叶片脱落来维系植物体的生长,因此,脱落酸被称为胁迫激素[50]。此外,脱落酸还是一种高效的诱抗效应物质。刘晓龙等[38]在盐碱水田实验中发现,经过ABA浸根处理后的水稻秧苗存活率显著提高11%~17%。因为外源ABA激发了水稻内源的ABA信号通路,从而缓解盐胁迫对水稻秧苗的伤害。Zhu等[51]研究发现在逆境胁迫条件下,叶黄素循环和ABA生物合成可能会竞争类胡萝卜素,由于有限的类胡萝卜素分配到叶黄素循环,植物更容易受到强光损伤,而外源ABA的应用可能会减轻叶黄素循环对类胡萝卜素的竞争,从而缓解盐胁迫下光对植物的过度伤害。盐胁迫下,喷施100 μmol/L ABA通过上调OsP5CR基因以及钙调素基因OsCam1-1的表达,促进脯氨酸的积累,从而缓解盐胁迫下水稻幼苗的生长发育,使存活率提高20%[52]。此外,有研究通过基因和生化分析揭示了一个APETALA2型转录因子OsSAE1(SALT and ABA RESPONSE ERF1),其可作为水稻种子萌发和耐盐性的正调控因子,直接结合到OsABI5(ABSCISIC ACID-INSENSITIVE5)的启动子上,通过抑制OsABI5的表达使OsSAE1过表达株系种子萌发率和耐盐性提高[53]。乙烯具有促进生长和抑制生长的双重作用,具体取决于发育阶段、组织类型、植物激素平衡和环境条件[54]。在生殖阶段或孕穗成熟阶段较高的乙烯含量会对水稻生长和产量产生负面影响[55],但在萌发阶段却具有重要意义,可能有助于种子克服休眠[56]。研究发现盐胁迫下乙烯含量的增加显著抑制了水稻的生长、灌浆和小穗的发育[57],而将乙烯抑制剂1-MCP外源应用于水稻小穗可改善盐胁迫下的生理、农艺和生化特性,进一步表明在水稻孕穗成熟阶段乙烯对水稻耐盐性的负面作用[56]。盐胁迫下施加1.5 g/L乙烯利会诱导水稻幼苗体内的乙烯含量升高并上调乙烯信号基因OsACS1和OsEIN2的表达,但较高的乙烯水平可能有利于种子萌发而不利于水稻幼苗的生长和总干物质量的提高[56]。乙烯还通过负调控ABA信号促进种子打破休眠[58],主要通过SNL1(SIN3-like 1)和SNL2(SIN3-like 2)等关键元件来拮抗ABA对种子萌发的抑制作用。此外,乙烯利浸种能够促进盐胁迫下水稻幼苗根系的生长,并增加根系抗氧化活性,提高渗透调节物质的含量[59]。
2.1.2 褪黑素
褪黑素(melatonin, MT)是一种广泛存在于动植物体内的吲哚类化合物。MT的研究早期集中在哺乳动物,随后在植物中被发现。尽管MT在植株体内的含量微少,但在生理调节、缓解逆境胁迫等方面仍发挥着重要的作用[60]。例如,褪黑素可作为一种自由基清除剂,维持植株体内的活性氧动态平衡,并改善光合作用、离子稳态等[61]。宋雪飞等[13]研究发现叶面喷施MT能显著提高盐胁迫下水稻根部和地上部氮、磷、钾的含量,且MT调控的最适浓度为200 μmol/L。Wei等[62]对盐胁迫下的水稻幼苗叶面喷施褪黑素处理14 d后也得出相似结论,且发现外源褪黑素处理能改善水稻叶片中K+/Na+和Ca2+/Na+的离子稳态,促进养分积累或转运,从而缓解盐胁迫对水稻的损伤。在较高盐浓度下,MT会抑制ROS过量积累并调节水稻钾离子转运蛋白OsHAK基因的表达,减少水稻叶肉细胞中K+的流出并维持Na+/K+稳态从而缓解盐害[63]。同时,向警等[64]发现MT处理能有效缓解盐胁迫带来的氧化损伤,增强水稻幼苗抗氧化与渗透调节能力,提高水稻的耐盐性。
外源褪黑素对水稻盐胁迫的缓解效应除了通过清除活性氧的直接途径外,还可以通过增加抗氧化酶活性、光合效率和代谢物含量等间接途径提高植物对盐胁迫的耐受性[65],并激活一系列下游信号,如激素、一氧化氮(NO)和多胺代谢等[61]。Chen等[66]研究发现在盐胁迫下,与未处理的幼苗相比,外源褪黑素的应用显著增加了幼苗中超氧化物歧化酶、过氧化氢酶、过氧化物酶和抗坏血酸过氧化物酶等抗氧化酶的活性。此外,有研究发现褪黑素具有类似IAA的生理功能,如调节植物的光周期和保护叶绿素等[67],以此增强电子传递和气孔导度,从而缓解盐胁迫对水稻的危害。Huangfu等[68]对萌发的水稻种子进行代谢组学分析,发现外源褪黑素可以调节盐胁迫下碳水化合物和有机酸等初级代谢产物的积累,以此提高发芽种子的耐盐性。外源褪黑素还能调节基因表达对盐胁迫的反应[61]。Liang等[69]发现外源褪黑素处理显著减缓了叶绿素的降解,抑制衰老相关基因的表达,通过调节一些转录因子来延缓叶片衰老,包括与衰老相关的SGR和NAC转录因子。外源褪黑素还通过激活转录因子级联反应和植物激素信号,与多种抗氧化剂和独特的代谢途径协同作用,增强水稻的耐盐性[70]。盐胁迫下外源褪黑素的应用可以调节植物中内源激素水平,如增加IAA含量,降低ABA含量,从而调节参与褪黑素生物合成和代谢基因的表达[71]。研究发现,在盐胁迫下,外源褪黑素会降低ABA生物合成基因NCED1和NCED3的表达,增加ABA分解代谢基因LbCYP707A1和LbCYP707A2的表达,从而减少 ABA 的积累并减轻盐对种子萌发的抑制作用[72]。
2.1.3 水杨酸
水杨酸(salicylic acid, SA)是一种植物内源生长调节剂和重要的信号分子,在植物生长发育和抗逆性方面发挥着重要作用[73]。前人研究表明SA主要从诱导抗氧化防御系统、调控离子平衡、激素稳态和代谢物质等方面缓解盐胁迫[74]。王俊斌等[75]研究发现正常情况下施加SA会延缓水稻种子的萌发且具有浓度依赖效应,但在盐胁迫下外源应用0.5 mmol/L SA能显著提高种子的抗氧化酶活性,增强抗氧化能力,以此降低萌发种子中的MDA和H2O2含量来缓解盐胁迫带来的损伤,且低浓度SA对盐胁迫下水稻生长的缓解效应要优于高浓度,该结论与徐芬芬等[76]研究结果相似。Babu等[77]在用1.0 mmol/L SA预处理的水稻组织中检测到内源SA水平增加了3倍,且SA处理后的水稻防御反应增强。此外,SA作为信号分子可调节植物体内H2O2水平及其相关代谢酶的活性[78],诱导与盐胁迫相关蛋白的表达,减少脂质过氧化与质膜损伤,维持细胞膜的稳定,从而提高幼苗的耐盐性[79]。Jini等[80]发现盐胁迫下外源SA可能会诱导抗盐基因并缓解水稻幼苗的萌发,也可能通过刺激生理生化过程来改善植株的生长和产量。外源SA可有效增强GA生物合成基因OsGA20ox1和OsGA3ox2及抑制ABA生物合成基因OsNCED5的表达,从而增加赤霉素含量,减少脱落酸含量以维持植物内源激素稳态,并通过提高α-淀粉酶活性及增加可溶性糖含量等,促进淀粉水解,为种子萌发提供充足的能量,最终缓解盐胁迫对水稻种子的危害,促进种子萌发[81]。然而,Zheng[82]和Ma[83]等研究发现在154 mmol/L NaCl的重度盐胁迫下,外源施加0.5 mmol/L SA对植株的缓解效应及相关基因的表达均与盐处理无显著差异,但在103 mmol/L NaCl胁迫下,施加0.5mmol/L SA对盐胁迫下植株的生长具有明显缓解作用。说明SA的缓解效应还与盐胁迫的程度有关。此外,许多研究者发现使用其他外源物质与SA复合处理对盐胁迫下植株的缓解效应更佳。如王爱斌等[10]报道CaCl2浸种和外源SA浇灌复配处理较其单一处理更能改善水稻植株的生长,提高叶绿素及还原性糖含量,降低MDA含量并提高水稻耐盐性。
2.1.4 多胺类物质
多胺(polyamines, Pas)主要包括腐胺(Put)、亚精胺(Spd)和精胺(Spm),是植物中广泛存在的一类生长调节物质,它不仅参与调节植物形态建成、生长、衰老,还参与各种胁迫响应并调节植物内源激素水平,因此多胺也被称为植物激素的第二信使[84-87]。例如,腐胺的积累可以调控ABA合成途径中关键基因NCED的表达[88],但在adc1和adc2双突变体中,NCED3以及ABA调控相关基因的表达都受到了抑制[89]。此外,有研究表明,像CTK、IAA以及GA3等可以促进植物生长的激素,可以促进多胺的合成[90]。Cui等[91]研究发现多胺可能与IAA、CTK的感知和信号传递有关。黄雪梅等[92]研究发现,使用0.14 mol/L外源GA3促进水稻种子萌发前,先诱导了腐胺的大量合成,进而增强了α-淀粉酶活力。外源多胺还能通过减少对细胞膜和脂质氧化的损害来减轻盐或干旱胁迫对各种植物的影响[93]。如多胺通过自身的阳离子与根系质膜磷脂结合,稳定质膜结构并维持质膜结合的H+-ATPase活性,使Na+/H+逆向运输系统将Na+更多转运至液泡内或运出细胞外,从而缓解氧化胁迫和渗透胁迫,使根系正常吸水[94-95]。王燕等[96]研究表明外源亚精胺能提高耐盐性不同的水稻品种在盐胁迫下的抗氧化酶活性,增加根系脯氨酸含量,防止可溶性蛋白和根系活性下降。吴正东等[97]研究发现外源亚精胺对水稻根系盐胁迫具有缓解作用,且能提高植株光合色素含量,从而提高植株光合能力。外源多胺可以抑制光化学反应及叶绿体编码基因如psbA、psbB、psbE和rbcL的下调,从而减少盐胁迫下叶绿素的损失[98]。其中Spm和Spd通过加强活性氧(ROS)的代谢和光合作用来促进植物生长并缓解盐胁迫的伤害。
种子萌发是植物生长发育的开始,种子质量影响到植株能否正常生长发育,而盐胁迫会抑制种子的萌发及呼吸强度等。亚精胺能促进退化种子的萌发,且能减少盐胁迫下水稻幼苗的膜损伤,促进幼苗生长[99]。辛树权等[100]在非盐胁迫条件下用1.0 mmo/L Spd溶液处理水稻种子时发现其发芽势及活力指数等显著提高,而在200 mmol/L NaCl溶液胁迫下,外源施用1.0 mmo/L Spd溶液与清水对照无明显差异,说明亚精胺浸种不仅能促进水稻种子萌发,还能缓解盐胁迫对水稻种子的毒害作用。杨安中等[101]研究发现,0.1~1.5 mmol/L亚精胺浸种能提高水稻种子呼吸强度及发芽率,促进根系及幼苗生长,且以1.0 mmol/L处理效果最佳。盐胁迫下施用10 μmol/L腐胺能提高植物的花粉活力,使种子的结实率更高,从而提高水稻产量[102]。Chunthaburee等[103]研究发现,盐胁迫下使用1.0 mmol/L Spd浸种后能使水稻幼苗具有更高的花青素、酚含量和更强的抗氧化能力,而在孕穗早期叶面喷施Spd能显著提高盐敏感型水稻的产量。一般认为,盐胁迫下植株体内游离态Put向游离态Spd、Spm以及其他形式多胺的转变,有利于提高植株的抗盐性[104]。有学者将参与多胺生物合成的关键基因SAMDC引入水稻后证实了这一点,盐胁迫下转基因水稻幼苗生长有所改善,且植株体内Spd和Spm含量比非转基因水稻增加了3倍。
2.1.5 油菜素类固醇
油菜素类固醇(brassinosteroids, BRs)是植物体内重要的甾醇类生长促进激素,它在细胞信号传导中发挥重要的作用。作为植物中第六大激素,BR参与调控植物种子的萌发、植株形态建成、根茎叶的伸长生长、花粉管的伸长和种子发育[105-106],还能提高植物对逆境胁迫的抵抗能力,如调控水稻的耐盐性等[107]。有研究发现,BR缺陷突变体表现出对盐胁迫敏感性增强,表明BR在水稻对盐胁迫的响应中具有正调控作用[107]。此外,BR能促进盐胁迫下种子萌发,前人研究发现BR能够显著提高盐胁迫下水稻种子的发芽率、发芽势和发芽指数,增强种子保护酶的活性,且浓度为1.0 mg/L时缓解效果最好[108-109]。盐胁迫下BR对水稻种子萌发及幼苗生长的改善与植株体内核酸和可溶性蛋白水平的提高有关[110]。安辉等[111]研究发现,1.0 μmol/L表油菜素内酯(EBR)能有效缓解盐胁迫下水稻幼苗光合色素的降低并提高叶片SOD、CAT活性及根系CAT活性,还能有效降低MDA含量的积累,从而缓解盐胁迫对水稻的危害。叶面喷施2.0 μmol/L EBR可以减少水稻幼苗脂质过氧化和蛋白质氧化程度及维持叶绿素含量,这可能是因为EBR诱导了脯氨酸的积累来维持植物细胞的渗透平衡以及增加抗氧化酶活性从而降低了氧化应激[112]。BR还能通过增加Cu/Zn-SOD、APX、CAT、GR 的活性和OsBRI1基因的表达,减少Fe-SOD、Mn-SOD积累以及下调OsDWF4基因的表达来改善氧化应激[113]。
BR还与其他植物激素之间存在相互关联,如ABA会抑制BR合成基因的表达。尽管两者之间大部分情况下存在拮抗作用,但在盐胁迫下均能促进植物的抗盐性,说明在不同胁迫或不同组织器官发育的不同阶段,两种激素之间的关系可能不同[107]。李钱峰等[114]研究证实ABA与BR之间存在多种交叉调控, 并且针对不同的性状, 其交叉调控机制可能不同。例如,Shahzad等[115]经过主成分分析(PCA)发现,盐胁迫下水稻植株对EBR的响应与酚类化合物和黄酮类化合物的积累密切相关,EBR处理可以降低盐胁迫下植株的内源ABA水平且上调类胡萝卜素和类黄酮通路基因表达,从而揭示了EBR在盐胁迫下激活水稻植株次生代谢的功能。在种子萌发中,施加外源BR可以通过消除 ABA 对种子休眠的影响来促进种子萌发[116]。此外,BR还可调控如IAA、GA等植物激素水平来提高植物的耐盐性[117-118]。
2.1.6 茉莉酸类物质
茉莉酸类物质(jasmonates, Jas)中应用较多的是茉莉酸(jasmonic acid, JA)和茉莉酸甲酯(methyle jasmonate, MeJA)。JA作为一种新型植物生长调节剂,与脱落酸具有相似的作用,两者均能抑制植物的生长,促进叶片衰老与脱落,促进气孔关闭等[119]。近期研究发现,将从小麦中分离出的TaFBA-2A基因引入水稻,可提高水稻的耐盐性和JA对盐胁迫的响应,并且具有提高转基因水稻产量的潜力。TaFBA-2A能和参与JA生物合成的关键酶TaSKP1、TaOPR2相互作用,并可能通过泛素-26S蛋白酶体途径介导TaOPR2的降解,从而负调控JA的生物合成[120]。此外,水稻PP2C蛋白家族中OSPP65可以通过调节JA和ABA信号通路以及棉子糖代谢途径负调控水稻盐胁迫耐性[121]。前人研究发现,不同浓度的外源茉莉酸对种子萌发的影响表现出“双重效应”,即低浓度促进,高浓度抑制,且外源JAs作为信号分子在植物遭受逆境胁迫时具有重要的胁迫应答和调控作用[122-123]。例如叶面喷施MeJA 可以促进植物生长,维持叶绿素和K+含量以及增加抗氧化酶活性[124]。盐胁迫后施用30 μmol/L JA 能有效缓解水稻干物质量、叶片水势、叶片光合速率以及光系统Ⅱ(PSⅡ)活性的降低,且显著减少了盐敏感水稻对Na+的吸收,增加了对Ca2+、Mg2+和K+的吸收,缓解离子胁迫与渗透胁迫,从而增强了水稻的抗盐性[125]。近期研究发现,JA合成前体OPDA如果积累会触发单独信号并最终导致盐胁迫下的植株死亡[126],而茉莉酸生物合成基因OsOPR7通过过氧化物酶的过表达可以将茉莉酸途径从OPDA转移到与盐适应的相关激素JA-lle上,从而减轻盐分诱导的线粒体氧化应激[127]。此外,外源JA可以调控植株内源激素水平[128]。如水稻中与褪黑素相关的ASMT mRNA可以在甲基茉莉酸处理后被诱导,而褪黑素参与应对各种胁迫来促进水稻生长[129]。已有报道证实ABA与JA在植物对盐胁迫反应中存在联合关系,如ABA可以通过SAPK10-bZIP72-AOC调控途径促进JA的生物合成[130],Yang等[131]在光敏色素介导的耐盐胁迫中证实ABA与JA存在协同作用。同时,两者之间还存在拮抗作用,对于其协同又拮抗的复杂互作关系及耐盐作用机制,还有待进一步研究。
2.2 外源无机离子对缓解水稻盐胁迫的影响
2.2.1 钙
作为植物体内一种必需的营养元素,钙(Calcium, Ca)在植物生长发育过程中发挥着重要作用,包括稳定细胞壁和细胞膜、改善其他营养元素的代谢过程、调节酶促反应和激素过程等[132]。此外,Ca还充当第二信使介导细胞和植物发育的多个方面以及参与抗逆反应[133]。前人在养分和土壤培养试验中研究了Ca对水稻生长和产量的影响。研究发现,养分试验中,Ca2+浓度为1.0~1.5 mmol/L时对两个耐盐水稻品种的生长特性缓解效果较好;在土壤培养试验中,施用钙含量为25% 的石膏(CaSO4·2H2O)能提高耐盐和盐敏感水稻品种的产量。然而,两种培养试验中过量的Ca都会抑制植物的生长[134]。盐胁迫下外源施用Ca可以改善水稻幼苗的离子稳态、抗氧化防御及乙二醛酶系统等,增强水稻对盐胁迫的耐受性[135]。朱晓军等[136]研究发现外源Ca2+能够增大气孔对盐胁迫的反应灵敏性和调节能力,改善植物的光合活性,且 Ca2+浓度为10 mmol/L时,能够显著缓解盐胁迫下水稻叶片中叶绿素含量的下降,维持水稻的光合效率。
2.2.2 硅
硅(Silicon, Si)是动物和人类的必需元素,也是植物生长发育过程中重要的营养元素。硅可以缓解植物的多种非生物胁迫,如盐胁迫、重金属胁迫、干旱胁迫等[137]。在光合作用中,Si通过在植物组织中的沉积来增强机械作用,从而提高植物组织的机械强度和直立性,增大受光面积[138]。此外,Si还可以提高水稻叶片的气孔透性,增加光合活性,缓解盐胁迫对水稻光合系统的伤害[139]。盐胁迫下,植物会受到渗透胁迫、离子胁迫及氧化胁迫的影响。有研究表明,施加Si可以通过提高水稻根系的生长与水分利用效率来缓解渗透胁迫[140]。Si还能上调植物根中质膜水通道蛋白基因的表达,增加植株的吸水能力,以此来缓解渗透胁迫[141]。闫国超等[142-143]研究发现,水稻生长营养液中添加高浓度外源硅(1.5 mmol/L)对缓解水稻生长、光合系统及离子平衡的效果优于低浓度(0.5 mmol/L),且Si还能通过提高OsHAK家族钾吸收基因及水稻钠外排(OsSOS1)、钠区隔化(OsNHX1、OsNHX3与OsNHX5)基因的表达,调控钠钾平衡来缓解盐胁迫引起的离子毒害。外源Si还可以通过提高植物根系中抗氧化酶的活性,降低MDA含量,从而缓解氧化胁迫对植株的伤害[144]。
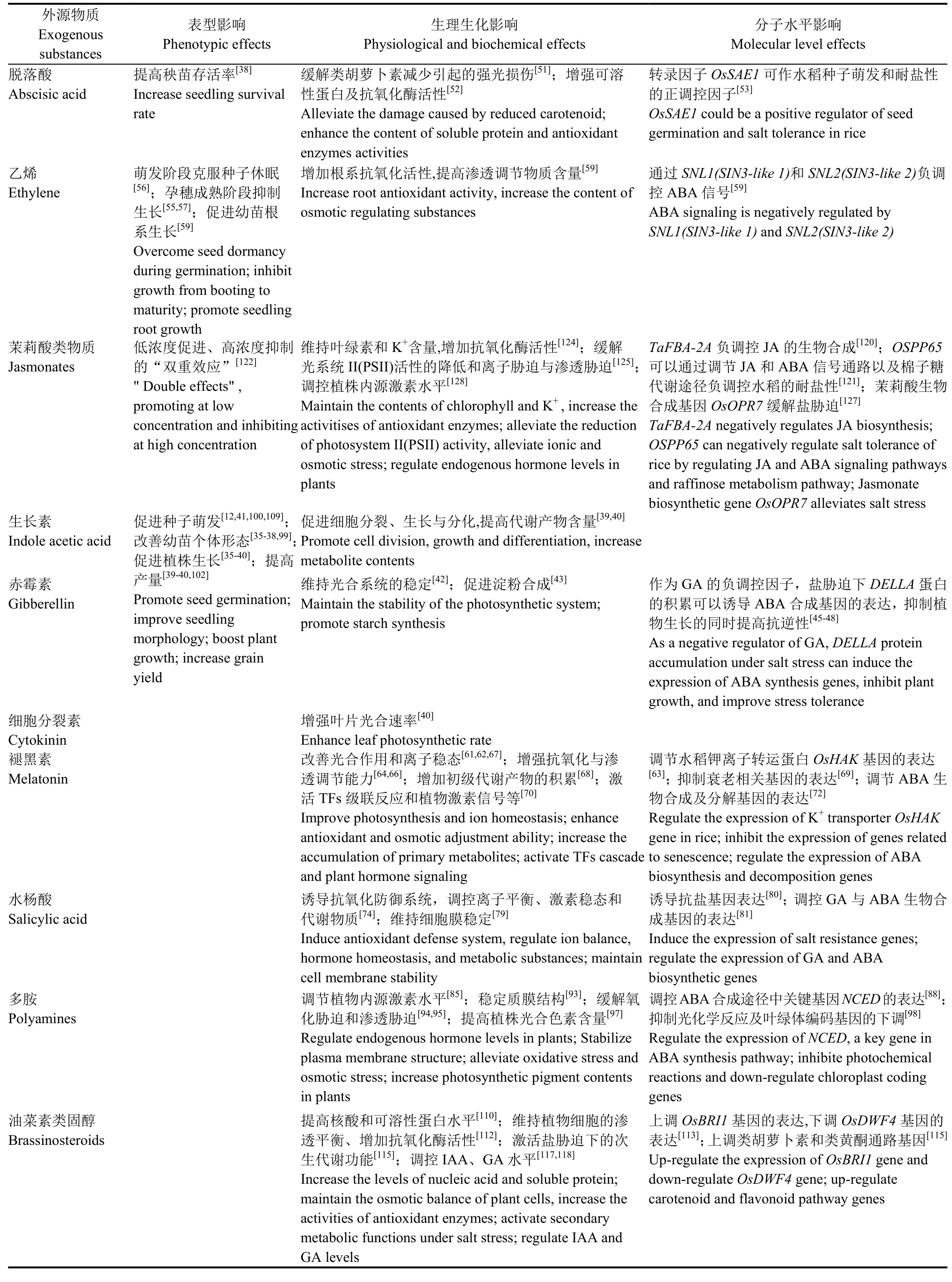
表1 外源物质缓解水稻盐胁迫的效应Table 1. Effects of exogenous substances on alleviating salt stress in rice

续表1
3 展望
综上所述,外源物质在缓解水稻盐胁迫中已得到一定的应用,生产上可通过施用外源物质来提高水稻抗盐性并改善生长发育状况。然而目前的研究主要集中在生理生化角度分析外源物对水稻盐胁迫的缓解效应,关于水稻如何感知外源物质信号以及下游信号的转导、代谢及分子水平调控方面的研究较少。植物对盐胁迫的适应是由耐盐相关基因的表达和盐胁迫诱导的各种信号通路的调控来决定的。随着CRISPR、CAS等新兴生物技术的出现,未来的研究应集中于探究蛋白水平及基因表达机理,提供有关植物分子水平相互作用的知识。因此,想要揭示外源物缓解水稻盐胁迫的机理,在分子水平上我们仍需要结合遗传学,综合利用基因组学、转录组学和蛋白质组学等研究方法,从基因表达、转录因子和蛋白水平等方面深入探究盐胁迫的反应机制。此外,多种外源物质之间还存在相互协同作用与拮抗作用,但其相互作用的信号传递模型还有待进一步探究。目前该方面的研究主要集中在黄瓜、西红柿、西葫芦等蔬果中,在水稻盐胁迫下各外源物质相互作用机理尚不清楚。对外源物相互作用的分析,将有助于阐明各个外源物的分子机制并明确它们联合施用的增减效益,以应用于农业生产当中,增加植物的耐盐性从而提高水稻产量。
