水稻光温敏雄性不育突变体tms3650的鉴定和基因定位
2023-01-18唐杰龙湍吴春瑜李新鹏曾翔吴永忠黄培劲
唐杰 龙湍 吴春瑜 李新鹏 曾翔 吴永忠 黄培劲
(1海南波莲水稻基因科技有限公司, 海口 510125; 2海南大学 热带作物学院, 海口 510125; *通信联系人, email: jesontom@126.com)
水稻(Oryza sativaL.)是雌雄同花自花授粉作物。雄性不育(male sterility,MS)是指雌性器官发育正常,而雄性器官由于发育退化或不能产生有功能的花粉或雄配子从而失去生殖功能导致不育的特性[1],它是水稻的一种生理现象,也是作物杂种优势利用的基础,在自然界中发生的概率仅为0.13%[2]。早在1876年,达尔文就提出作物杂交后代部分农艺性状有超越亲本的表现[3]。1926年,美国农学家Jones提出水稻也具有杂种优势[4]。1973年,石明松[5]在晚粳农垦58中发现了3株光温敏雄性不育株,随后育成了农垦58S[6],这一新成果为杂交水稻从“三系法”过渡到“两系法”开拓了新局面。粳稻品种农垦58S和籼稻品种安农S-1[7]、株1S[8]是研究和应用最广泛的光温敏雄性不育系,目前生产上应用的“两系不育系”大部分都是这三个品种的衍生系[9-10]。农业部统计资料显示,截至2012年,两系法杂交稻已累计种植3.2×107hm2(4.99亿亩)[11]。
“两系法”的核心是光温敏细胞核雄性不育系(photoperiod-/thermo-sensitive genic male sterile line),其育性受到温度和光照长度的影响,具体表现为短日照(或低温)条件下,雄性正常可育;而长日照(或高温)条件下,雄性败育[12]。光温敏不育系受细胞核基因调控,随着分子生物学与分子标记技术的发展,截至2021年底,查询到定位或克隆的光敏雄性不育基因(PGMS)有pms1[13]、pms2[13]、pms3(p/tms12-1)[14-16]、pms4[17]、RMS1[18]、OSWYOXIB[19]和CSA[20]。温敏雄性不育基因(TGMS)在不同品种中差异很大,遗传较为复杂,可能不是简单的遗传性状调控[21]。温敏雄性不育基因有tms1[22]、tms2(ORMDL)[23-24]、tms3[25]、tms4[26]、TGMS[27]、tms5(ptgms2-1(t))[28-29]、tms6[30]、tms6(t)-1[31]、tms6(t)-2[32]、tms8[33]、tms9[34]、tms9-1(PTC1)[35-36]、tms10[37]、tms18(osNP1)[38-39]、TMS[40]、Ms-h[41]、rtms-1[42]和OsUgp1[43],以及光温敏不育基因(PTGMS)pms1(t)[44]等。pms1和pms3(Os12g0545900)都是非编码lncRNAs,但pms1为不完全显性基因且在长日照条件下的PSMS株系中,phasiRNAs偏好性积累,从而造成光敏雄性不育[13];pms3[14-16]为隐性基因,在长日照下特异的RNA分子转录量降低,结果造成正处于发育的花药进入程序化死亡(PCD)从而造成雄性不育。RMS1(Os04g0461000)和CSA(Os01g0274800)都编码MYB转录因子,李莉等[18]通过CRISPR/Cas9敲除RMS1后得到了具有光敏型雄性不育表型的突变体;而CSA是一个反光敏雄性不育基因,在雄性生殖发育过程中调控糖分配并且是种子早期萌发过程中的一种保护机制[20]。OSWYOXIB(Os02g0816900)编码一个肌球蛋白,可能在花药细胞的营养运输中起着重要的作用[19]。tms2(Os07g0452500)是一种血清类黏蛋白(ORM),植物ORMDL蛋白影响了鞘脂平衡,敲除后因为花粉发育异常而影响育性[24]。tms5(Os02g0214300)编码一个保守的RNA酶,在tms5突变体中,由于RNA酶功能缺失导致UbL40mRNA水平上升,mRNA过度积累导致花粉形成缺陷和雄性不育[45]。tms9-1(Os09g0449000)编码一个PHD锌指蛋白,该基因在衡农S-1中存在一个T到C的置换,导致了一个氨基酸的变化从而造成雄性不育[35]。tms10(Os02g0283800)编码一个SERK家族类受体蛋白激酶,表明激酶活性对于高温下的绒毡层变性和雄性生育力至关重要[37]。tms18(Os10g0524500)是葡萄糖-甲醇-胆碱(GMC)氧化还原酶家族成员[38]。OsUgp1(Os09g0553200)编码尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGPase),该酶通过催化葡萄糖-1-磷酸和UTP形成UDP-葡萄糖和焦磷酸的可逆反应造成雄性不育和育性恢复[43]。此外,tms4[26]和tms9[34]定位于水稻第2染色体,pms2[13]和tms6(t)-1[31]定位于第3染色体,pms4[17]定位于第4染色体,tms6[30]定位于第5染色体,tms3[25]和TMS[40]定位于第6染色体,pms1(t)[44]定位于第7染色体,tms1[22]定位于第8染色体,TGMS[27]和Ms-h[41]定位于第9染色体,tms6(t)-2[32]和rtms-1[42]定位于第10染色体,tms8[33]定位于第11染色体。
本研究团队通过60Co-γ辐射籼稻品种93-11,分离出了包括株高、分蘖数、株型、穗型、小穗结构、育性、叶色、叶型、抽穗期、苯达松抗性等突变体[46],并克隆了普通核雄性不育基因RMS2[47]、MS26-2245[46]、PTC1-2[48]和MSP1-1972[49]等。在93-11辐射诱变突变体库后代3650号株系中筛选得到一个雄性不育突变体tms3650,对突变体进行表型鉴定和基因定位研究,以期为进一步研究该基因的功能和调控机理提供理论基础。
1 材料与方法
1.1 试验材料
籼稻93-11经60Co-γ辐射诱变得到M0代,辐射后的种子种植于海南省临高县试验田,成熟后分单株收种,共获得M1代材料约6500份。次年,种植M1代,每个家系种50个单株,在其中3650号株系中发现一种突变体表现为雄性不育,被命名为tms3650。所有水稻材料均按常规田间种植与管理,单株插,株行距16.3 cm×19.8 cm。93-11干种子由湖南省水稻研究所提供。
1.2 花粉育性鉴定
在海南临高早稻季(2月中旬播种)、晚稻季(7月上旬播种)和湖南望城基地中稻季(5月中旬播种)栽培条件下,抽穗期取突变体tms3650家系不同植株的成熟花粉用1%碘-碘化钾溶液(0.6%KI,0.3% I2,w/w)进行染色分析。此外,可育植株和不育植株套袋自交,每株3个重复,并考种统计结实率。将tms3650突变体的稻蔸在2015年、2016年、2017年冬季(11月移栽)种植于海南省陵水县提蒙镇水稻育种基地,稻蔸围膜隔离种植,安排稻蔸在1~2月短日照低温孕穗,对抽穗后的花粉粒进行碘染分析(10倍物镜,显微镜型号Leica DM2500)并统计收种后结实率。陵水转育后的种子于海南临高和湖南望城育种基地再次播种,抽穗期取花粉碘染分析。
1.3 突变体育性转换鉴定
对陵水收获的转育种子进行大田种植鉴定和实验室品种SSR真实性鉴定。在临高早稻季、晚稻季和湖南望城中稻季各取93-11作对照,转育的tms3650突变体做待测样品,编号并单本插秧,在苗期、拔节期、抽穗期、成熟期观察记录突变体与对照样品的差异。根据水稻品种鉴定DNA指纹方法标准(《中华人民共和国农业行业标准: 水稻品种鉴定技术规程》,SSR标记法,NY/T 1433-2014)合成24对SSR标记(附表1),以93-11和转育后tms3650突变体种子萌发的叶片DNA为模板,进行PCR真实性鉴定。
1.4 遗传分析及定位群体的构建
正常大田栽培条件下,以突变体tms3650为母本,分别以野生型籼稻93-11、明恢63和粳稻中花11为父本,配制杂交种,观察F1、F2和F3的表型,并统计野生型可育花粉植株和突变体雄性不育植株的分离比。
1.5 DNA提取及基因定位
在齐穗期观察群体表型,取穗子包颈、花药偏白的水稻小穗和对应分蘖的剑叶进行保存,小穗进行育性鉴定后,选不育株叶片采用传统CTAB法[50]提DNA。根据Michelmore等[51]的BSA极端性状混合池分析法(bulked segregant analysis)和RCA隐性群体分析法(recessive-class analysis)对tms3650进行基因定位。在Gramene在线网站(http://www.gramene.org/)合成SSR引物用于群体定位,引物交由深圳华大基因科技有限公司合成。PCR使用Biomiga的2×PCR预混合液5 μL,1 μL引物(含各0.5 μL正反向引物),1 μL模板DNA,ddH2O补足10 μL。PCR扩增程序为常规SSR程序。扩增产物使用6%的非变性聚丙烯酰氨凝胶电泳,0.1%AgNO3染色,甲醛和NaOH显色拍照统计基因型。
利用301对均匀分布于12条染色体上的SSR标记[52]筛选93-11与明恢63之间的多态性,得到64对具有多态性的SSR标记(附表2),多态性较低,表明明恢63与93-11在基因组序列上差异较小。收tms3650和明恢63杂交F1种子,F1使用筛选得到的多态性标记验证真实性。种植F1得到F2,F2分离得到的61个不育株用作初定位群体,构建F2分离群体的不育株的混合基因池,每个混合池随机选20株不育株DNA样本,利用64对多态性标记对所述混合基因池进行分析。用筛选得到紧密连锁的标记鉴定F2分离群体的可育株,选择杂合基因型株系收种F2,种植F2种子得到F3分离群体,F3分离得到的883个不育株用作精细定位群体。根据初定位结果继续发展紧密连锁标记的SSR标记(附表3),连锁标记对F3群体进行分子鉴定。
1.6 候选基因分析
从水稻基因组注释数据库(http://rice.plantbiology.msu.edu/index.shtml)和NCBI籼稻93-11基因组注释数据库(https://www.ncbi.nlm.nih.gov/nuccore/CM012055.1?report=graph)查询精细定位区间内的ORF并分析基因功能,水稻表达数据库(https://ricexpro.dna.affrc.go.jp/GGEP/index.php)分析区间内基因表达谱,预测候选基因。下载候选基因全长DNA序列,使用Primer Premier 5软件设计测序引物,合成的引物同时PCR扩增野生型93-11和突变体tms3650的DNA,扩增产物送深圳华大基因科技有限公司进行测序,测序结果使用DNAMAN软件进行拼接和比对分析。
2 结果与分析
2.1 突变体表型分析
在湖南和海南种植的野生型及突变体材料除生育期有5~10 d差异外其他农艺性状基本一致。野生型93-11和突变体tms3650在分蘖性状(图1-A)和穗型上(图1-B)没有明显差异,但突变体抽穗期稍迟(比对照93-11晚约5 d)且包颈,颖壳和小花(图1-C)没有明显差异,野生型93-11花药(图1-D)大且黄,但突变体tms3650的花药(图1-D)白绿且瘦小,花粉碘染结果显示野生型93-11成熟花粉粒能被碘液染成蓝黑色(图1-E),而tms3650花粉粒不能染色(图1-F),彻底败育。
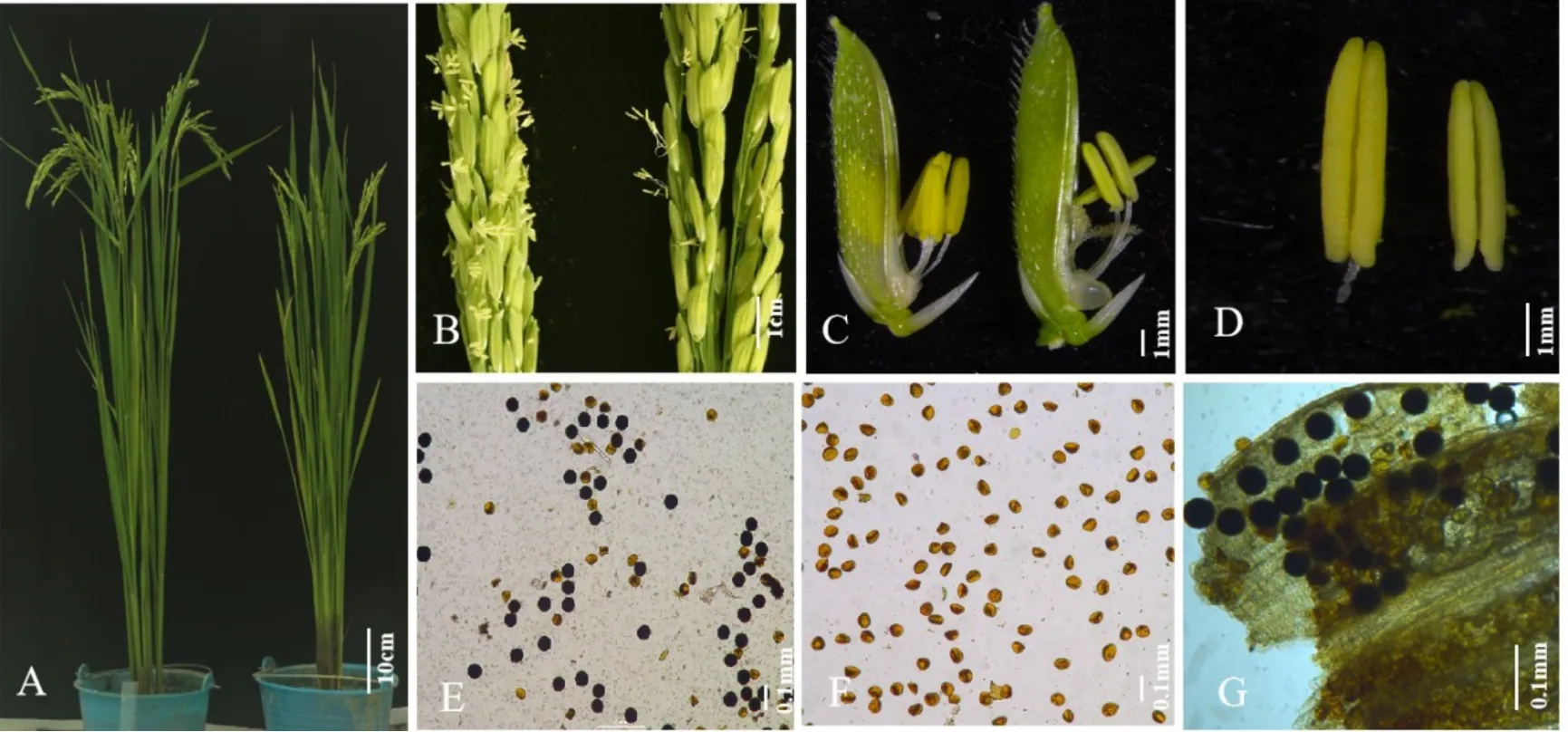
图1 野生型93-11和突变体tms3650表型鉴定Fig. 1. Phenotypic comparison of wild type 93-11 (WT)and tms3650.
冬季移栽陵水南繁后,突变体tms3650花粉粒部分花粉能被碘液染成蓝黑色,部分未被染色(图1-G),经查询陵水县2015、2016和2017年1~2 月平 均 温 度 为17~24℃(https://tianqi.2345.com/wea_history/59954.htm),符合光温敏雄性不育育性转育温度。选择9个突变体株系进行花粉育性恢复调查及结实率分析(表1),可育花粉和不育花粉数几乎一致,结实率在30%左右(突变体单株有效分蘖5~6个,穗粒数150粒左右)。上述结果表明突变体花粉的育性在短日照低温条件下得到恢复,但恢复率不高,还需要继续寻找合适的临界转育温度和光照条件。
2.2 突变体育性转换真实性鉴定
转育后的突变体tms3650种子在海南临高和湖南望城基地大田种植鉴定,除了穗子包颈和生育期延迟(比对照93-11晚5 d左右),其他农艺性状和野生型93-11一致,突变体生长整齐一致,无杂株。突变体花粉经镜检发现完全败育。随机取突变体tms3650不同单株的叶片混样构建4个DNA池,以野生型93-11的模板DNA为对照。根据24对国标引物PAGE胶检测结果(图2),野生型和突变体带型完全一致,表明所选位点没有引入外源基因。由此得出结论,在陵水点收获的突变体tms3650种子为真实转育自交种,而不是串粉导致。

图2 野生型93-11和突变体tms3650品种真实性鉴定Fig. 2. Authenticity identification of wild-type 93-11 and mutant tms3650.
2.3 突变体遗传分析
突变体tms3650作为母本,野生型93-11,粳稻中花11,籼稻明恢63作为父本杂交发现F1结实正常,说明突变体雌性育性正常且该基因是一个隐性基因。统计F2分离群体中的野生型和突变体株数,经卡方检验发现,野生型和突变体分离比符合3∶1(表2),表明tms3650的雄性不育性状受一对单基因控制。上述结果表明tms3650突变体受一对隐性单基因控制。

表2 突变体tms3650的遗传分析Table 2. Genetic analysis of mutant tms3650.
2.4 初定位和精细定位
BSA初定位结果表明第3染色体上的SSR标记RM055和RM293与tms3650的突变表型存在连锁关系(附图1)。进一步在SSR标记RM055和RM293 附近继续开发分子标记得到RM15900、RM15915、RM15935和RM15947。利用上述连锁标记逐个分析明恢63和tms3650的F2群体中的不育株的基因型,得到交换单株分别为18、2、1、0、0和5个。因此将目标基因初步定位于第3染色体长臂上SSR标记RM15900和RM15947之间(图3-A)。
在标记RM15900和RM15947之间继续筛选多态性标记,得到RM15919、RM15921、RM15927、RM15931、RM15934和RM15937。通过分析紧密连锁标记在F3群体883个不育单株的基因型。得到tms3650与上述RM15900到RM15947标记之间的交换单株分别为11、3、2、2、1、0、2、4、4、6个(图3-B),tms3650与标记RM15931共分离(交换单株基因型和表型列于附表4),最终定位在135.25 kb的RM15927-RM15934区间内(图3-C)。

图3 tms3650突变体的精细定位Fig. 3. Fine mapping of tms3650 mutants.
2.5 候选基因预测
根据水稻基因组注释数据库查询精细定位区间内的ORF,在标记RM15927到RM15934之间135.25 kb物理距离区间内共查询到24个预测基因(表3),与已克隆雄性不育基因进行比对发现该候选区间内没有克隆过的光温敏雄性不育基因(图4)。水 稻 表 达 数 据 库 发 现,该 区 间 内LOC_Os03g53650和LOC_Os03g53790在花药中特异表达,其他基因在花期也有表达。选择候选基因HTH DNA结合蛋白LOC_Os03g53600,PHD finger家族蛋白LOC_Os03g53630,半胱氨酸合酶LOC_Os03g53650,含有短链脱氢酶/还原酶家族结构域的蛋白质LOC_Os03g53690,PHD锌指家族蛋白LOC_Os03g53700,醛 糖1-差 向 异 构 酶LOC_Os03g53710,SRPK4蛋白LOC_Os03g53720,RNA识别基序LOC_Os03g53770,周质β-葡萄糖苷酶前体LOC_Os03g53790对这些基因编码区设计引物进行PCR扩增送测序,目前没有发现造成的突变位点,正在继续测序验证上述基因启动子区及区间内的其他候选基因。

图4 第3染色体已克隆或定位的雄性不育基因Fig. 4. Male sterility genes cloned or mapped on rice chromosome 3.

表3 目标区域预测基因Table 3. Predicted gene in target region.
2.6 紧密连锁标记在不同品种中的多态性验证
根据精细定位结果,我们得到了和光温敏雄性不育基因TMS3650紧密连锁的分子标记RM15931。为了验证标记在指示tms3650突变体光温敏雄性不育表型上的特异性,我们分析了在多个品种中该标记的多态性。这些品种包括两系不育系GD-7S、隆科638S,三系保持系野香B、特B、博II B、H28B,恢复系93-11、明恢63、R51084,常规品种中花11。由图可知(图5),RM15931扩增出了156 bp的条带,其他品种扩增出150 bp的多态性条带,通过鉴定发现该连锁标记可用于分子标记辅助选择育种。
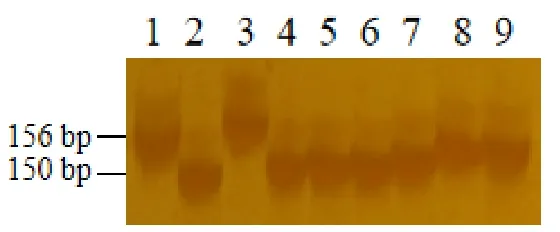
图5 连锁标记RM15931亲本多态性鉴定Fig. 5. Identification of parental polymorphism of linked markers RM15931.
3 讨论
虽然“两系法”杂交水稻一般由隐性核雄性单基因调控,但目前已克隆的光温敏雄性不育基因还是太少,很多遗传机理还不是很清楚。林艳等[53]通过TALEN编辑日本晴和明恢86的pms3基因,发现突变体并不产生光温敏雄性不育表型。王芳权等[54]发现pms3基因在培矮64S和粤光S中并不能独立起作用,还需要与其他基因共同调控,pms3基因还受到其上游转录本AK111270产生的siRNA介导的甲基化调控[55]。Qi等[35]发现tms9-1与明恢63在第3外显子上有一个T到C的差异导致氨基酸的改变导致光温敏雄性不育,但Li等[36]发现该位点编码一个PHD锌指蛋白基因PTC1,在第2个外显子T的插入使翻译提前终止导致其普通核雄性不育,推测突变的位置不同,造成育性影响不同。OsNP1[39]是一个无花粉型普通核雄性不育基因,但tms18与OsNP1在不同位点突变会引起不一致的性状表型[38]。由此可见,部分基因的不同突变甚至能造成不一样的表型。因此,挖掘、鉴定新的光温敏雄性不育基因对进一步阐明光温敏雄性不育的分子机制具有十分重要的意义。
本研究从93-11的辐射诱变体库中获得了一个雄性不育突变体tms3650。表型鉴定发现突变体花药瘦小且白绿,花粉碘染完全败育,抽穗期比93-11稍晚5 d左右,其他农艺性状正常。遗传分析发现突变体受一个单隐性核基因控制,通过多年次在海南陵水冬季南繁(11月至次年4月)种植tms3650突变体稻蔸,发现在短日照(日照时间小于12 h)低温(17~24℃)条件下部分花粉转育并结实,收种继续种植并通过大田鉴定和分子SSR真实性鉴定其为真实自交种,因此得出tms3650是一个光温敏雄性不育突变体。通过将突变体和明恢63杂交得到F1,自交后代F2和F3分离群体用来定位,最终将基因定位于第3染色体长臂SSR标记RM15927到RM15934之间物理距离135.25 kb区间范围内,且与标记RM15931共分离。
通过基因组注释数据库发现该区域内有24个预测基因,没有已克隆的育性相关基因,已定位在第3染色体的光/温敏雄性不育基因pms2[13]和tms6(t)-1[31],以及定位在第3染色体长臂的普通核雄性不育基因EPAD1[56]、TIP3[57]、OsDEX1[58]和MEL1[59]同tms3650定位区间不在一个位点,说明TMS3650是一个新基因。目前已克隆的光温敏雄性不育基因功能有非编码RNA、MYB转录因子、肌球蛋白、血清类黏蛋白、PHD锌指蛋白、葡萄糖-甲醇-胆碱氧化还原酶、尿苷二磷酸葡萄糖焦磷酸化酶基因、SERK家族类受体蛋白激酶。通过对该区间的基因编码区进行测序暂时没有找到候选基因,猜测该基因可能在候选基因的启动子区发生变异或者是其他预测不同代谢路线功能的基因,需要继续测序并构建不同的群体对定位区间及候选基因加以验证。
本研究进一步利用紧密连锁标记对育种中常用的保持系进行多态性验证,发现标记RM15931在部分常用的保持系、恢复系和常规稻之间都存在多态性,可以用于分子标记辅助选择育种。但由于突变体在陵水南繁转育后结实率较低,后续还需要继续鉴定基因的临界转育温度,并弄清楚该基因是光照敏感还是温度敏感型雄性不育。本研究为该光温敏雄性不育基因的分子标记辅助选择育种及进一步研究该基因的功能和调控机理奠定了理论基础。
在线辅助性信息:附表1~4和附图1请见《中国水稻科学》网站http://www.ricesci.cn。
