β-谷甾醇在辣椒疫霉菌生长发育中的作用研究
2023-01-18任颖鸽贺依琳车志平田月娥
李 岩 任颖鸽 贺依琳 车志平 田月娥
(河南科技大学园艺与植物保护学院,河南 洛阳 471000)
辣椒疫霉菌(Phytophthora capsici)是世界范围内农作物、花卉及林木植物上的一种重要的植物病原卵菌。该病菌变异性强,适应性广,爆发性强,能给寄主植物造成毁灭性的疫病病害[1-2]。在适宜的环境条件下,辣椒疫霉菌可以进行无性繁殖,在被侵染植物的表面产生大量孢子囊。孢子囊成熟后易脱落,脱落的孢子囊可以随雨水或灌溉水移动至新的寄主周围,也可以在水中释放出大量游动孢子[1]。游动孢子具有趋化性,能够定向游动到植物组织周围[3]。孢子囊也可以和游动孢子一样直接萌发形成芽管,芽管刺穿植物角质层,形成附着孢并定殖在寄主植物组织内部。成功侵染的辣椒疫霉菌在寄主体内大量定殖,形成菌丝、孢子囊,完成多次再侵染,最终造成病害的爆发流行[1]。辣椒疫霉菌属于异宗配合的植物病原卵菌,除了无性生殖产生的孢子囊或菌丝体能作为初侵染源外,辣椒疫霉菌还可以在适宜的条件下,通过有性生殖产生厚壁的卵孢子。卵孢子抗逆性强,可以在土壤中存活多年。在适宜的条件下,疫霉菌的卵孢子也可以作为初侵染源,萌发并侵染寄主植物,造成危害[1,4]。另外,疫霉菌在田间自然条件下,能够通过有性重组使疫霉菌在表型和基因水平上发生遗传变异,从而产生致病性更强和适应性更广的毒性菌株[5]。
植物甾醇是一类在植物中广泛存在的生物活性物质[6]。β-谷甾醇是一种常见的植物甾醇,广泛存在于各种植物种子、茎叶和植物油中[7-8]。研究发现,β-谷甾醇具有极高的营养价值与较强的生物活性,其在抗氧化、抗炎、抗高血脂、抗肿瘤、免疫调节等方面表现出良好的药理作用,已被广泛应用于医药、食品、保健品等领域[9-10]。苟亚峰等[11]研究发现,从圆滑番茄枝叶中提取到的β-谷甾醇对引起胡椒瘟病的辣椒疫霉菌(P. capsici)具有较好的抑制作用。当β-谷甾醇浓度为0.6 mg·mL-1时,其 对 胡 椒 瘟 病 菌 的 抑 菌 率 可 达61.78%。这为进一步开发β-谷甾醇在植物病害防控中的应用价值提供了依据。
β-谷甾醇属于四环三萜类化合物,是真核生物细胞膜的主要组成成分[12]。前人研究表明,疫霉属卵菌因其基因组缺乏甾醇合成必要的基因,从而自身不能合成甾醇[13]。Jiang等[14]对大豆疫霉、橡树疫霉和辣椒疫霉的代谢研究发现,由于缺乏甾醇合成所必需的细胞色素P450家族CYP51基因,疫霉属卵菌属于甾醇缺陷型,必须从寄主中获取甾醇来完成自身的发育过程。研究证实,疫霉属病菌可利用外源的甾醇类物质供其生长发育[15]。然而,外源甾醇对疫霉菌生长发育的作用仍不清楚[16]。因此,本研究以辣椒疫霉菌模式菌株LT263为供试菌株,以β-谷甾醇为外源甾醇,研究其在不同浓度下对辣椒疫霉菌菌丝生长、菌丝形态、细胞膜透性、孢子囊形成及卵孢子形成的影响,以期明确β-谷甾醇在辣椒疫霉菌各生长发育阶段中的作用,为开发由辣椒疫霉菌引致的植物疫病防控新途径提供理论依据。
1 材料与方法
1.1 材料与试剂
供试菌株:辣椒疫霉菌模式菌株LT263(A2交配型)由南京农业大学植物保护学院植物与疫霉互作实验室惠赠。辣椒疫霉菌A1和A2交配型标准菌株由中国农业大学植物保护学院惠赠。
培养基:10% V8固体培养基(10% V8汁,0.02% CaCO3,2%琼脂粉)用于培养辣椒疫霉菌;测试用培养基为不含任何甾醇的基础培养基,配方参照文献[15]。
试剂:β-谷甾醇为国产分析纯。
1.2 仪器与设备
SPX-250B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;DM2500显微镜,Leica Microsystems, 德国;DDS-307雷磁电导率仪,上海仪电科学仪器股份有限公司。
1.3 试验方法
1.3.1β-谷甾醇对辣椒疫霉菌菌丝生长速率作用的测定 采用菌丝生长速率法[17-18]测定β-谷甾醇对辣椒疫霉菌LT263菌丝生长的影响。称取0.01 gβ-谷甾醇,经丙酮溶解后,配制成浓度为1.0 mg·mL-1的母液。采用倍半稀释法用无菌蒸馏水再次稀释。将10% V8固体培养基熔化并冷却至50 ℃左右,向其中加入1 mL不同浓度的供试化合物,与V8培养基混匀,制成终浓度分别为0.2、1.0、5.0、25.0和125.0 µg·mL-1的含β-谷甾醇10%V8培养基。每个培养皿中加入15 mL 10% V8固体培养基。待其凝固后,在生长旺盛的辣椒疫霉菌LT263菌落边缘打取直径为5 mm的菌饼,将菌丝面贴于培养基,置于培养皿中央,以加入等体积溶剂的V8培养基作为对照,每个处理3个重复。将培养皿倒置于25 ℃恒温培养箱中黑暗培养。采用十字交叉法每24 h测量菌落直径并拍照。抑菌率的计算公式如下:

1.3.2β-谷甾醇对辣椒疫霉菌菌丝生长量累积作用的测定β-谷甾醇对辣椒疫霉菌菌丝生长量的影响通过称量菌丝的干重、鲜重进行测定。根据1.3.1中得到的β-谷甾醇有效抑制中浓度(effective concentration, EC50)值,配制含供试化合物终浓度为EC50的含β-谷甾醇V8液体培养基,从辣椒疫霉菌3 d龄菌株边缘取5个菌饼(直径5 mm)接入培养基中,以加等量溶剂作为空白对照。每个三角瓶中接5个菌饼,每个处理3个重复。将三角瓶置于振荡培养箱(25 ℃,150 r·min-1)中黑暗振荡培养3 d后,收集菌丝。将每个三角瓶中的菌丝团用150 mL无菌水冲洗3次后,去除菌饼,用布氏漏斗抽滤后,称量菌丝鲜重,计算鲜重抑制率。然后将菌丝团放入烘箱中,60 ℃烘干4 h,待冷却后称量其干重,计算干重抑制率。相关计算公式如下:

1.3.3β-谷甾醇对辣椒疫霉菌细胞膜透性作用的测定 采用电导率法测定β-谷甾醇处理辣椒疫霉菌后菌丝体细胞膜通透性的变化[17,19]。在生长3 d的辣椒疫霉菌LT263菌落边缘打取直径为5 mm的菌饼,接入10% V8液体培养基中,于恒温振荡培养箱中振荡培养3 d,收集菌丝。用灭菌蒸馏水冲洗3次后,用布氏漏斗抽干菌丝表面的培养基和水分。根据1.3.1中得到的β-谷甾醇EC50值,取浓度为10.0 µg·mL-1的β-谷甾醇水溶液20 mL,加入1 g菌丝。以蒸馏水作为对照。于室温下分别处理30、60、90、120和150 min后,用雷磁电导率仪测量处理后溶液的电导率。150 min后将菌丝体煮沸并冷却后再测定最终电导率。每个处理3个重复。按公式计算菌丝体的相对电导率(σr):

式中,σt为某时间的电导率,µS·cm-1;σ0为煮沸后的电导率,µS·cm-1。
1.3.4β-谷甾醇对辣椒疫霉菌孢子囊形成作用的测定 分别配制含0.2、1.0、5.0、25.0和125.0 µg·mL-1β-谷甾醇的10% V8固体培养基,每个培养皿中加入15 mL上述培养基。用直径5 mm的打孔器在培养3 d的辣椒疫霉菌LT263菌落边缘打取菌饼,置于上述培养基中央,以添加等量溶剂作为对照,每个处理3个重复。采用许亚池等[20]的方法,将上述培养皿置于恒温培养箱(25 ℃)中先黑暗培养5 d,然后转至28 ℃光照培养箱中全光照培养5 d,然后在显微镜下随机选取10个视野,统计孢子囊个数,每个处理3个重复,按照公式计算β-谷甾醇对孢子囊形成的抑制率:

1.3.5β-谷甾醇对辣椒疫霉菌卵孢子形成作用的测定 采用皿内对峙培养的方法进行测定。分别配制含0.2、1.0、5.0、25.0和125.0 µg·mL-1β-谷 甾 醇 的10%V8固体培养基,以加入等量溶剂作为对照,每个培养皿中加入15 mL上述培养基。在培养3 d的两株标准菌株[辣椒疫霉菌LT263(A2)和A1交配型菌株]菌落边缘分别打取菌饼。参考Tian等[21]测定交配型的方法,每个培养皿中央放置一个标准菌株LT263和一个标准菌株A1,两个菌丝块之间相距2 cm。每个处理3个重复。接好菌的培养皿置于25 ℃黑暗条件下倒置培养10~14 d。待对照培养皿内两个菌落交界处产生大量卵孢子时停止培养,在显微镜下重复随机选取12个视野,统计卵孢子个数,参照1.3.4计算卵孢子形成抑制率。
1.4 数据分析
采用SPSS 17.0软件对试验数据进行统计分析,应用Duncan氏新复极差法和Tukey法检验各处理间的差异显著性。
2 结果与分析
2.1 β-谷甾醇对辣椒疫霉菌菌丝生长的影响
由图1可知,不同浓度β-谷甾醇对辣椒疫霉菌菌丝生长的作用不同。当β-谷甾醇浓度为0.2和1.0 µg·mL-1时,处理后辣椒疫霉菌菌落直径大于对照菌落直径,β-谷甾醇对辣椒疫霉菌菌丝生长表现为促进作用;当β-谷甾醇浓度为5.0 µg·mL-1时,对辣椒疫霉菌菌丝生长表现为轻微的抑制作用;当β-谷甾醇浓度增加至25.0 µg·mL-1时,抑制作用显著增强;当β-谷甾醇浓度为125.0 µg·mL-1时,则完全抑制辣椒疫霉菌菌丝的生长,EC50为10.0 µg·mL-1。
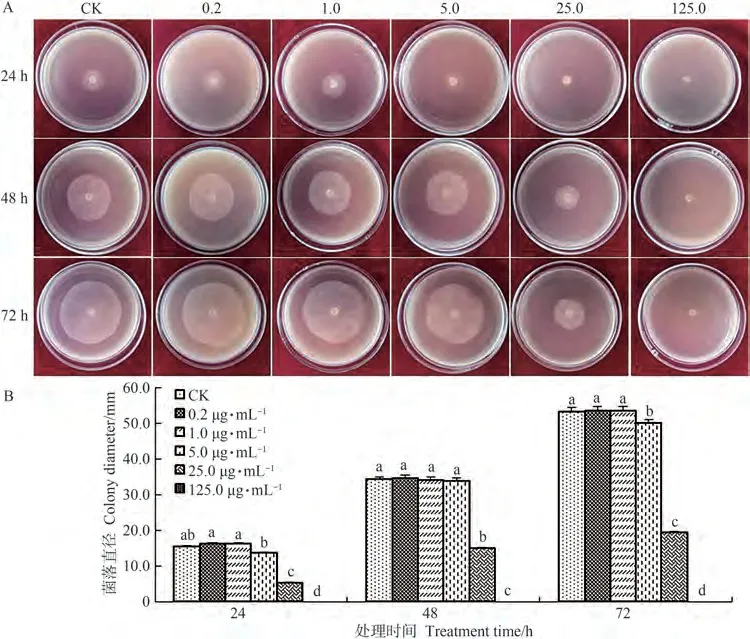
图1 β-谷甾醇对辣椒疫霉菌菌丝生长的影响Fig.1 Effects of β-sitosterol on mycelium growth of Phytophthora capsici
2.2 β-谷甾醇对辣椒疫霉菌菌丝形态的影响
显微观察发现,辣椒疫霉菌在不同浓度β-谷甾醇处理后的菌丝形态存在差异(图2)。β-谷甾醇浓度为0.2和1.0 µg·mL-1时,菌丝形态与对照形态相同,菌丝体粗细均匀,菌丝细而直,分枝间距较大且距离菌丝顶端较远。随着β-谷甾醇浓度的增加,辣椒疫霉菌菌丝形态出现明显异常。β-谷甾醇浓度为25.0 µg·mL-1处理后的菌丝顶端膨大、分枝增多,菌丝增粗,生长受到限制。表明低浓度β-谷甾醇对辣椒疫霉菌菌丝形态没有影响,高浓度β-谷甾醇对辣椒疫霉菌菌丝形态有致畸作用。
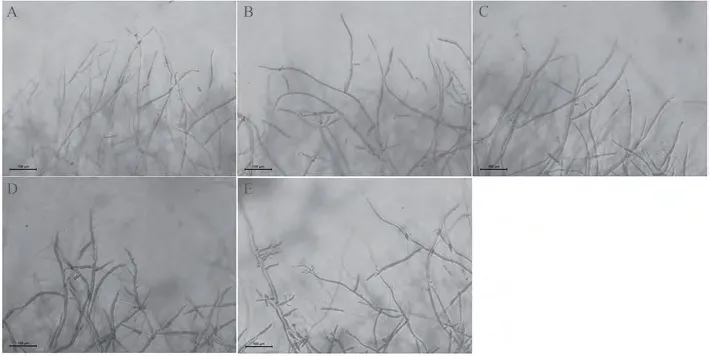
图2 β-谷甾醇处理对辣椒疫霉菌菌丝形态的影响Fig.2 Effect of β-sitosterol on mycelium morphology of Phytophthora capsici
2.3 β-谷甾醇对辣椒疫霉菌菌丝生物量累积的影响
用β-谷甾醇处理辣椒疫霉菌3 d后,发现菌体的菌丝生长受到不同程度的影响(表1)。β-谷甾醇浓度为1.0 µg·mL-1时,其对辣椒疫霉菌菌丝生长表现为促进作用,处理后菌丝的鲜、干重分别为2.100和0.102 g,高于对照的2.000和0.097 g,此时,β-谷甾醇对鲜、干重的抑制率分别为-5.00%和-5.20%。β-谷甾醇浓度为10.0 µg mL-1时,其对辣椒疫霉菌菌丝生长表现为明显的抑制作用,处理后菌丝的鲜、干重分别为1.151和0.042 g。此时,β-谷甾醇对鲜、干重的抑制率分别为42.50%和56.70%。

表1 β-谷甾醇对辣椒疫霉菌菌丝生物量累积的影响Table 1 Effect of β-sitosterol on accumulation of mycelium of Phytophthora capsici
2.4 β-谷甾醇对辣椒疫霉菌细胞膜透性的影响
为了进一步确定β-谷甾醇对辣椒疫霉菌菌丝体产生的影响,以β-谷甾醇对辣椒疫霉菌菌丝生长的抑制中浓度EC50值为浓度,测定β-谷甾醇处理后辣椒疫霉菌的电导率,计算相对电导率,以此反映处理后辣椒疫霉菌菌丝体细胞膜透性的变化,结果如图3所示。在测定的150 min内,β-谷甾醇处理后辣椒疫霉菌菌丝体相对电导率随时间的延长呈现增长趋势,逐渐趋于稳定,且在整个处理时间段内,所有处理组数据均高于空白对照组,说明10.0 µg·mL-1β-谷甾醇处理会增大细胞膜通透性,破坏菌体细胞,从而导致细胞内容物外泄,影响菌体生长,达到抑制菌丝生长的效果。
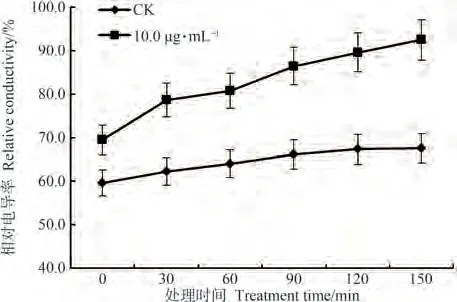
图3 β-谷甾醇对辣椒疫霉菌菌丝体细胞膜相对电导率的影响Fig.3 Effect of β-sitosterol on the membrane relative permeability of Phytophthora capsici mycelium
2.5 β-谷甾醇对辣椒疫霉菌孢子囊形成的影响
β-谷甾醇对辣椒疫霉菌孢子囊形成的作用与其对菌丝生长的作用一致。由图4可知,当β-谷甾醇浓度为0.2 µg·mL-1时,处理后辣椒疫霉菌产孢量显著高于对照;当β-谷甾醇浓度为1.0、5.0和25.0 µg·mL-1时,对辣椒疫霉菌孢子囊的形成表现为显著的抑制作用,且随着β-谷甾醇浓度的增大,辣椒疫霉菌孢子囊形成数量显著减少。表明β-谷甾醇对辣椒疫霉菌孢子囊形成的作用表现为低浓度促进,高浓度抑制。
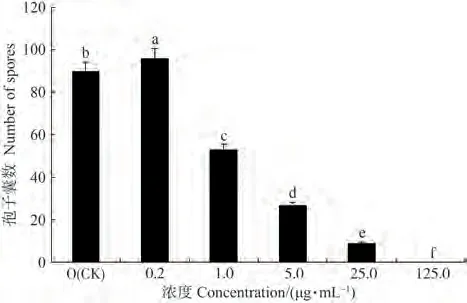
图4 β-谷甾醇对辣椒疫霉菌孢子囊形成的影响Fig.4 Effect of β-sitosterol on sporangium formation of Phytophthora capsici
2.6 β-谷甾醇对辣椒疫霉菌卵孢子形成的影响
在配制的5个β-谷甾醇浓度下,辣椒疫霉菌经0.2 µg·mL-1β-谷甾醇处理后,视野中观察到的辣椒疫霉菌卵孢子平均数量为56个,对照组为47个,处理组高于对照组;浓度为1.0、5.0和25.0 µg·mL-1的β-谷甾醇对辣椒疫霉菌卵孢子的形成有明显的抑制作用,且随着β-谷甾醇浓度的升高,辣椒疫霉菌产生的卵孢子数减少,平均数量依次为27、21和12个,较对照组明显减少(图5)。综上,低浓度β-谷甾醇对辣椒疫霉菌卵孢子形成有促进作用,高浓度β-谷甾醇对辣椒疫霉菌卵孢子形成有抑制作用。
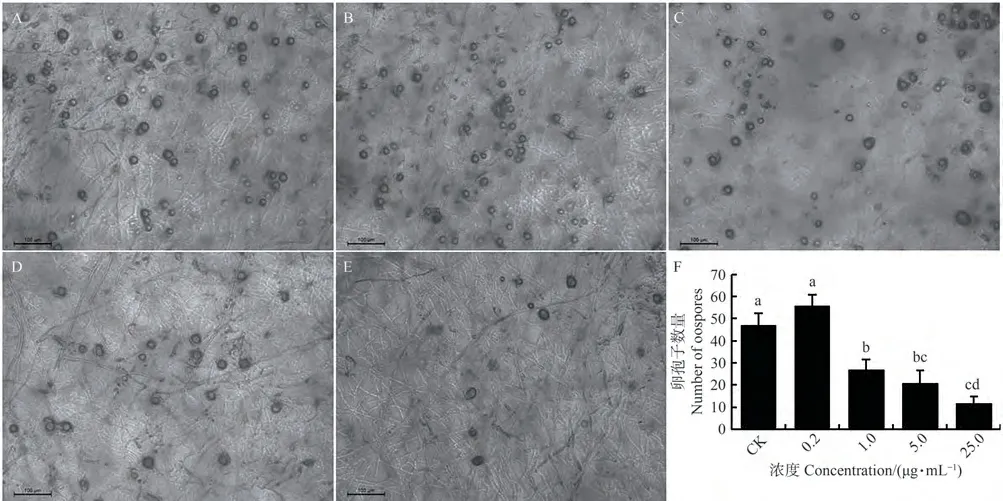
图5 β-谷甾醇对辣椒疫霉菌卵孢子形成的影响Fig.5 Effect of β-sitosterol on oospore formation of Phytophthora capsici
3 讨论
β-谷甾醇是最常见,也是大多数植物中含量最丰富的甾醇类物质。β-谷甾醇不仅在人体和动物中具有重要的生理功能,还是疫霉属和腐霉属植物病原卵菌进行正常生长发育所需的重要外源甾醇[13-14]。前人研究表明,腐霉属和疫霉属卵菌在甾醇缺乏的培养基上倾向于营养生长。然而,在培养基中添加甾醇类物质,不仅能够促进营养生长,还能促进雌器、雄器的发育及卵孢子的形成[21-22]。Elliott等[22]研究了几种甾醇及相关物质对恶疫霉(Phytophthora cactorum)有性繁殖的促进作用,发现供检测的物质中只有29-异岩藻甾苷和β-谷甾醇对促进恶疫霉产生卵孢子的效果最好。本研究测定不同浓度梯度β-谷甾醇对辣椒疫霉菌生长发育的结果表明,β-谷甾醇对辣椒疫霉菌生长发育具有重要影响,具体表现为低浓度促进,高浓度抑制。当β-谷甾醇浓度为0.2 µg·mL-1时,对辣椒疫霉菌菌丝生长促进的幅度达到4.5%;当β-谷甾醇浓度高于5.0 µg·mL-1时,其对辣椒疫霉菌的菌丝生长及孢子囊和卵孢子形成表现出抑制作用,且随着β-谷甾醇浓度的升高,其抑制作用随之增强。
本研究中,当β-谷甾醇浓度为0.2和1.0 µg·mL-1时,其对辣椒疫霉菌生长发育的促进作用与前人对致病疫霉(P. infestans)[22]、大豆疫霉(P. sojae)[23]和恶疫霉(P. cactorum)[24]的研究结果一致。Elliott等[22]研究发现,疫霉属病菌在添加了β-谷甾醇的V8培养基中产生的卵孢子数量比不添加甾醇的相同培养基更多。Medina等[23]比较了在不同培养基中添加或不添加β-谷甾醇对疫霉菌菌丝生长以及孢子囊和卵孢子产生的影响,发现含有β-谷甾醇的V8培养基不仅对致病疫霉的菌丝生长具有很好的促进作用,而且经β-谷甾醇处理后,致病疫霉菌株产生的孢子囊和卵孢子数量显著高于对照黑麦琼脂(rye-agar, RA)培养基。Marshall等[24]研究发现,谷甾醇能促进大豆疫霉菌的营养生长和有性繁殖,其促进作用类似于对恶疫霉菌的生理作用[13]。以上研究均证实了β-谷甾醇在疫霉属卵菌生长发育中的重要性,本研究结果进一步证实,β-谷甾醇对辣椒疫霉菌生长发育产生的影响与其浓度密切相关。
辣椒疫霉菌的繁殖方式包括无性繁殖和有性生殖。孢子囊和游动孢子是辣椒疫霉菌进行无性繁殖的主要形式,其数量和产生速度是影响辣椒疫病流行的关键[25]。本研究结果表明,当β-谷甾醇浓度高于5.0 µg·mL-1时,随着浓度的升高,辣椒疫霉菌孢子囊形成的数量呈下降趋势;当浓度增至10.0 µg·mL-1时,与对照相比,其对孢子囊形成的抑制率可达70.0%。卵孢子是辣椒疫霉菌有性生殖的产物,不仅可以作为初侵染源直接萌发侵染寄主,而且在有性生殖过程中的遗传重组加大了病菌的变异性和致病性[4]。本研究结果表明,β-谷甾醇对辣椒疫霉菌卵孢子形成的抑制作用同其对孢子囊形成的抑制作用趋势一致。当浓度为10.0 µg·mL-1时,与对照相比,其对辣椒疫霉菌卵孢子形成数量的抑制率可达55.3%。可见,在一定浓度下,β-谷甾醇是有效的辣椒疫霉菌生长发育抑制物质,在病菌生长发育的不同阶段均可产生很好的抑制效果,减缓病菌的再侵染及病害的发展蔓延。
微生物细胞膜是微生物的一种半透性保护屏障,也是多种杀菌剂的作用位点[27]。当受到外界环境或物质破坏时,会导致细胞膜流动性及半透性丧失,细胞内的电解质大量渗漏,胞内渗透压失衡,致使溶液中的电导率上升,最终使得细胞生理功能降低,细胞趋于死亡[26]。本研究发现,10.0 µg·mL-1β-谷甾醇对菌丝生长有较强的抑制作用。经该浓度的β-谷甾醇处理后,辣椒疫霉菌菌丝溶液的电导率升高,表明辣椒疫霉菌细胞膜通透性增加。这可能是因为该浓度的β-谷甾醇使得辣椒疫霉菌中的电解质大量泄漏,使得细胞内渗透压不平衡,最终导致辣椒疫霉菌细胞死亡。该结果与山苍子精油对辣椒疫霉菌细胞膜通透性作用的研究结果类似,均具有破坏作用[27]。这为β-谷甾醇应用于由辣椒疫霉菌引致的植物疫病提供了思路。
植物甾醇是稳定植物细胞膜磷脂双分子层的必需类固醇分子,也是疫霉属和腐霉属卵菌缺乏甾醇合成必要基因的真核生物生命周期中的必需物质[28]。天然来源的植物甾醇安全性非常高,其在有效剂量内就能够降低人和动物的胆固醇,且对人和动物均无毒副作用[29],但不同植物β-谷甾醇的含量不同[7,30]。因此,在植物疫霉病害防控中可以利用现代生物技术,提高植物甾醇,特别是β-谷甾醇的表达量,以此控制疫霉属植物病原卵菌引发的植物疫霉病害,为病害防控提供新途径。
4 结论
本研究通过外源添加的方式,研究了不同浓度下β-谷甾醇对辣椒疫霉菌菌丝形态及菌丝生长、菌丝生物量累积、细胞膜透性、孢子囊形成及卵孢子形成的影响,明确了β-谷甾醇在辣椒疫霉菌生长发育各阶段中的作用。结果表明,不同浓度β-谷甾醇对辣椒疫霉菌的生长发育作用不同,具体表现为低浓度促进,高浓度抑制。高浓度β-谷甾醇抑制辣椒疫霉菌菌丝的生长,对菌丝形态有致畸作用;同时,可增大辣椒疫霉菌细胞膜透性,破坏菌丝体;抑制辣椒疫霉菌孢子囊的形成和游动孢子的释放;影响辣椒疫霉菌有性生殖,导致卵孢子形成数量显著减少。
