非小细胞肺癌组织中TRIM59、p53表达与临床病理特征及预后的相关性分析
2023-01-18王现生于红艳郭小燕河北工程大学附属医院呼吸与危重症二科河北邯郸056000
王现生,于红艳,郭小燕 (河北工程大学附属医院呼吸与危重症二科,河北 邯郸 056000)
肺癌是严重威胁人类生命的恶性肿瘤之一,其发病率与病死率均居恶性肿瘤首位[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要组织学类型,占所有肺癌的80%~85%,随着医学技术的发展,NSCLC的早期诊断和治疗已取得进展,然而NSCLC患者5年生存率仍然较低[2]。研究与NSCLC临床病理特征及预后有关的因子有助于发现有效的生物标记物,以减少NSCLC患者预后不良的发生。三重基序蛋白(tripartite motif protein,TRIM)参与细胞增殖、转录调节、免疫、癌症发生等多种细胞生物学过程,其中TRIM59与NSCLC的发生发展及预后有关[3]。p53是一种抑癌基因,野生型p53能够通过诱导癌细胞凋亡发挥抑癌作用;在所有恶性肿瘤中,50%以上会出现p53基因的突变,p53基因突变后,其空间构象也发生改变,使其失去对细胞生长、凋亡和DNA修复的调控作用,在肿瘤的发生发展中具有重要作用[4-5]。另有研究显示,TRIM59、p53可共同影响顺铂在食管癌细胞中的敏感性[6]。但目前关于TRIM59与p53联合作用在NSCLC组织中的表达情况尚不明确,因此本研究通过分析NSCLC组织及癌旁组织中TRIM59、p53的表达,探讨二者与NSCLC临床病理特征及预后的关系。
1 资料和方法
1.1 临床资料
选取2014年5月至2016年5月在我院诊断为NSCLC的73例患者为研究对象,其中男41例,女32例;年龄30~81岁,平均(63.25±8.69)岁;有吸烟史47例,无吸烟史26例;鳞癌31例,腺癌38例,其他4例。纳入标准:①经组织病理学检查确诊为NSCLC;②在我院进行手术治疗,且癌组织及癌旁组织齐全;③术前未进行放化疗;④一般资料完整。排除标准:①合并心、肝、肾等严重疾病;②患有自身免疫性疾病;③合并其他恶性肿瘤。根据国际肺癌研究协会公布的第八版肺癌TNM分期标准[7]对NSCLC患者进行临床分期,其中Ⅰ期21例,Ⅱ期36例,Ⅲ期16例。根据WHO肺癌病理学分类对患者进行分级,其中低分化23例,中分化34例,高分化16例。
通过电话或门诊复查的方式对患者进行随访,记录患者生存状态。随访60个月,随访截止日期为2021年7月30日,患者死亡日期或随访截止日期作为终点事件时间。
1.2 主要试剂及仪器
兔抗人TRIM59蛋白(批号:ab69639)、p53蛋白(批号:ab32389)单抗及辣根过氧化物酶标记的山羊抗兔lgG(批号:ab150077)购自艾博抗(上海)贸易有限公司;DAB显色试剂盒(批号:ZLI-9017)购自北京中杉金桥生物技术有限公司;TRIzol试剂盒购自上海通蔚生物有限公司;逆转录试剂盒购自上海科敏生物科技有限公司。
1.3 免疫组织化学法检测TRIM59、p53蛋白表达
NSCLC组织及癌旁组织常规石蜡包埋保存。经脱蜡、抗原修复、封闭后加入兔抗人TRIM59、p53蛋白单抗,4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔lgG(稀释比1∶1 000),37 ℃孵育1 h,加入DAB显色试剂盒进行染色,苏木素复染,盐酸酒精短暂分化后脱水、透明、封片。PBS代替一抗作为阴性对照。结果判定:由2名具有5年以上工作经验的病理医师根据双盲法对染色结果进行半定量评分,以细胞质或细胞核内出现黄色或棕色颗粒为阳性。采用染色指数(stain index,SI)进行评分,SI=阳性细胞率评分×阳性细胞染色强度评分,其中SI≤3分为阴性,SI>3分为阳性。阳性细胞率评分:无阳性细胞记为0分,阳性细胞率<25%记为1分,阳性细胞率为25%~50%记为2分,阳性细胞率为51%~75%记为3分,阳性细胞率>75%记为4分。阳性细胞染色强度评分:无染色为0分,浅黄色为1分,黄褐色为2分,棕褐色为3分。
1.4 qRT-PCR检测TRIM59、p53 mRNA表达
按照TRIzol试剂盒及逆转录试剂盒说明书提取总RNA,并逆转录为cDNA。TRIM59 mRNA以GAPDH为内参进行PCR反应,p53 mRNA以β-actin为内参进行PCR反应,引物序列见表1。具体反应条件为:95 ℃、2 min,95 ℃、30 s,60 ℃、30 s,72 ℃、15 s,共40个循环。采用2-ΔΔCt法计算出TRIM59、p53 mRNA的相对表达量。
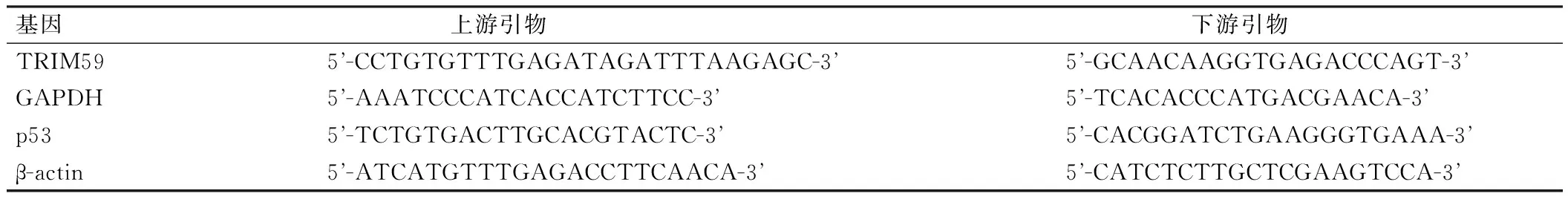
表1 引物序列
1.5 统计学方法

2 结果
2.1 NSCLC组织及癌旁组织中TRIM59、p53蛋白的表达
NSCLC组织中TRIM59蛋白阳性表达率为 74.0%(54/73),高于癌旁组织的9.6%(7/73),差异有统计学意义(χ2=62.201,P<0.001)。NSCLC组织中p53蛋白阳性表达率为65.8%(48/73),高于癌旁组织的5.5%(4/73),差异有统计学意义(χ2=55.859,P<0.001),见图1。

a:TRIM59蛋白在癌旁组织中的表达;b:TRIM59蛋白在NSCLC组织中的表达;c:p53蛋白在癌旁组织中的表达;d:p53蛋白在NSCLC组织中的表达图1 TRIM59、p53蛋白在癌旁组织及NSCLC组织中的表达(×200)
2.2 NSCLC组织及癌旁组织中TRIM59 mRNA、p53 mRNA的表达
与癌旁组织比较,NSCLC组织中TRIM59、p53 mRNA表达水平均显著升高(P<0.05),见表2。

表2 NSCLC组织及癌旁组织中TRIM59、p53 mRNA的表达
2.3 TRIM59及p53蛋白表达与NSCLC患者临床病理特征的关系
NSCLC组织中TRIM59蛋白阳性表达54例,阴性表达19例;p53蛋白阳性表达48例,阴性表达25例。NSCLC组织中TRIM59、p53蛋白阳性表达与患者的年龄、性别、吸烟史、淋巴结转移、组织学类型无关(P>0.05),与患者的TNM分期、组织分化有关(P<0.05),见表3。

表3 TRIM59、p53蛋白表达与NSCLC患者临床病理特征的关系(例)
2.4 NSCLC组织中TRIM59 mRNA与p53 mRNA表达的相关性
NSCLC组织中TRIM59 mRNA表达与p53 mRNA表达呈正相关(r=0.360,P=0.002),见图2。

图2 NSCLC组织中TRIM59 mRNA与p53 mRNA表达的相关性
2.5 TRIM59、p53蛋白表达与NSCLC患者预后的关系
采用TCGA数据库分析TRIM59、p53蛋白与NSCLC患者预后的关系,共纳入494例,其中TRIM59高表达125例,TRIM59低表达369例,p53高表达124例,p53低表达370例。结果显示,TRIM59高表达患者与低表达患者的预后比较差异无统计学意义(P>0.05),p53高表达患者与低表达患者的预后比较差异也无统计学意义(P>0.05),见图3。
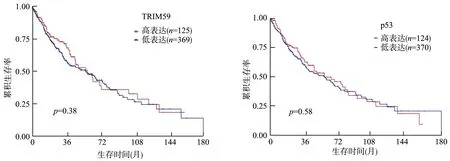
图3 TCGA数据库分析TRIM59、p53蛋白与NSCLC患者预后的关系
对NSCLC患者进行随访,5年内共有46例患者死亡,生存率为37.0%。TRIM59蛋白阳性表达患者5年生存率(31.5%)低于阴性表达患者(52.6%);p53蛋白阳性表达患者5年生存率(29.2%)低于阴性表达患者(52.0%),见图4。

图4 Kaplan-Meier法分析TRIM59蛋白、p53蛋白与NSCLC患者预后的关系
2.6 COX回归分析影响NSCLC患者预后的危险因素
单因素COX分析表明,年龄、吸烟史、淋巴结转移、TNM分期、组织分化、TRIM59蛋白表达、p53蛋白表达均是影响NSCLC患者预后的因素(P<0.05),见表4;多因素COX分析表明,TNM Ⅲ期、低分化、TRIM59蛋白阳性表达、p53蛋白阳性表达均是影响NSCLC患者预后的独立危险因素(P<0.001),见表5。
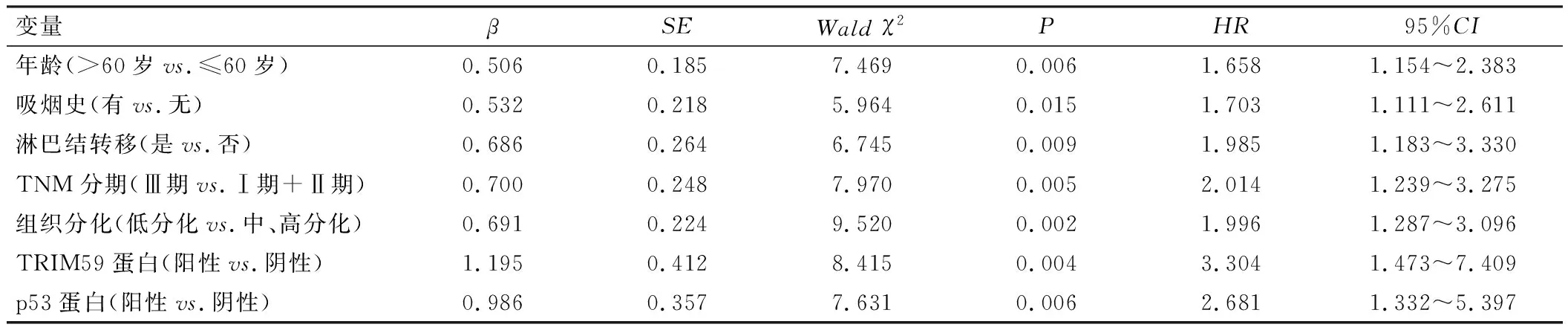
表4 影响NSCLC患者预后的单因素COX分析

表5 影响NSCLC患者预后的多因素COX分析
3 讨论
肺癌是原发于气管、支气管和肺部的恶性肿瘤,主要包括小细胞肺癌、肺鳞癌、肺腺癌和大细胞肺癌几种类型。随着人们生活方式及习惯的改变,肺癌的发生率逐渐升高,严重威胁人类健康。目前肺癌的发病机制尚不清楚,吸烟、饮食、遗传、空气污染、职业等因素均与肺癌的发生有关。临床主要根据患者肿瘤病理类型、临床分期、淋巴结转移等对患者进行针对性治疗。临床分期和组织分化是肺癌患者重要的临床病理特征,是影响肺癌患者预后的重要因素。进一步明确与NSCLC有关的临床病理特征,可能对改善NSCLC患者不良预后具有重要意义。
TRIM蛋白由一系列高度保守的基序蛋白组成,这些蛋白含有RING结构域、B-box基序及一个卷曲螺旋区域[8]。大多TRIM蛋白是E3泛素连接酶,能够促进各种底物的翻译后修饰,从而影响细胞的生长、发育、分化、凋亡、炎症等过程[9]。TRIM59蛋白表达不仅与肿瘤细胞的恶性行为有关,也与肿瘤患者的临床病理特征有一定关系。Han等[10]研究表明,TRIM59通过影响BECN1的转录和泛素化在NSCLC的自噬调节中起重要作用。Ying等[11]研究表明,在肝细胞癌组织中TRIM59表达上调,TRIM59可通过降解蛋白磷酸酶1B促进肝细胞癌的肿瘤生长并调节细胞周期。本研究结果表明,NSCLC组织中TRIM59蛋白阳性表达率、TRIM59 mRNA表达水平显著高于癌旁组织,且TRIM59蛋白阳性表达与NSCLC患者的TNM分期、组织分化有关,提示TRIM59蛋白与NSCLC的发生发展有关,原因可能是TRIM59可促进NSCLC细胞的增殖及迁移,进而影响NSCLC的发生发展。本研究还发现,TRIM59蛋白阳性表达NSCLC患者的5年生存率显著低于阴性表达患者,且COX回归分析表明TRIM59蛋白阳性表达是影响NSCLC患者预后的独立危险因素,提示TRIM59可能是NSCLC预后的预测因子和潜在的治疗靶标。
抑癌基因p53可通过调节细胞凋亡、衰老及细胞周期等生物学过程在预防肿瘤的发生中起关键作用[12]。韩璐等[13]研究表明,胃癌组织中p53阳性表达与患者淋巴结转移及分化程度有关。本研究结果显示,NSCLC组织中p53蛋白阳性表达率、p53 mRNA表达水平显著高于癌旁组织,且p53蛋白阳性表达与患者的TNM分期及组织分化有关,提示p53蛋白表达与NSCLC的发生及临床病理特征有关,这可能是由于突变型p53蛋白与野生型p53蛋白结合,导致野生型p53蛋白抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的能力减弱,半衰期增加,因此NSCLC组织中p53蛋白阳性率高于癌旁组织[14]。本研究对患者进行了5年随访,结果表明p53蛋白阳性表达患者5年生存率低于阴性表达患者;COX回归分析显示,p53蛋白阳性表达是影响NSCLC患者预后的独立危险因素,提示p53蛋白可能与NSCLC患者的预后有关,与以往研究结果一致[15-16]。但是本研究结果与TCGA数据库分析结果不一致,TCGA数据库分析显示,TRIM59、p53高表达患者与低表达患者的预后情况比较差异均无统计学意义,这可能是由于数据库分析样本较多,人群不同,而本研究样本量较小,且为单中心研究,故研究结果还有待深入分析。
Liu等[6]研究表明,阻断TRIM59可通过上调p53而增强食管癌细胞对顺铂的化疗敏感性。但是NSCLC患者组织中TRIM59与p53的关系目前尚不明确。有研究发现,NSCLC细胞系中TRIM59蛋白呈高表达趋势,而敲除TRIM59后p53蛋白表达水平无显著变化,因此该研究认为TRIM59可能通过DNA合成后期,逐渐进入分裂期,而不是通过影响p53信号通路促进癌细胞的生长和迁移[3]。本研究对NSCLC患者组织中TRIM59、p53 mRNA表达水平进行了相关性分析,结果表明二者表达呈正相关,说明TRIM59 mRNA与p53 mRNA可能共同参与NSCLC进展过程,但具体的内在机制还需深入分析。
综上所述,TRIM59、p53蛋白表达与NSCLC患者TNM分期、组织分化及预后有关,二者可能通过某一机制影响NSCLC患者的发展及预后。但本研究仅对NSCLC组织及癌旁组织TRIM59、p53蛋白和mRNA表达进行了分析,还需通过细胞实验或动物实验进一步验证二者在NSCLC发生发展中的作用。
