miR-298通过靶向结合CHN1抑制胃腺癌细胞增殖
2023-01-18江莉平刘伍星马梦云洪湖市人民医院肿瘤血液内科湖北洪湖400洪湖市人民医院康复科湖北洪湖400江汉大学附属湖北省第三人民医院药学部湖北武汉400
江莉平,刘伍星,马梦云,司 琳,夏 飞 (.洪湖市人民医院肿瘤血液内科,湖北 洪湖 400;.洪湖市人民医院康复科,湖北 洪湖 400;.江汉大学附属湖北省第三人民医院药学部,湖北 武汉 400)
胃癌是全球范围内较常见的消化道恶性肿瘤之一,由于其早期无典型症状,多数患者就诊时已处于中晚期,错过了最佳的治疗时机,导致生存率较低[1-2]。流行病学报告显示,随着胃癌相关基础及临床研究的不断深入,我国胃癌的发生率及病死率均有所下降,但仍处于较高的水平,且胃癌的转移率和复发率较高,患者预后较差[3-4]。近年来有学者发现,α-嵌合蛋白(α-chimaerin 1,CHN1)基因可能在肿瘤的形成等过程中发挥重要作用,但研究仍处于起步阶段[5]。微小RNA(microRNA,miRNA)是一种参与基因转录后调控的非编码单链RNA分子,通常在真核生物中检测到,可通过调控多种靶基因的表达水平参与肿瘤形成等过程,已被证实与肿瘤的发生发展过程密切相关[6]。有研究表明,miR-298可调控肝癌[7]、肺癌[8]、卵巢癌[9]等多种肿瘤细胞的增殖和侵袭,然而目前关于miR-298对胃腺癌细胞的影响尚不明确,且尚无miR-298与CHN1在胃腺癌中相互作用的研究。基于此,本研究初步探讨了miR-298靶向CHN1对胃腺癌细胞增殖、凋亡的影响及潜在作用机制,以期为阐明胃腺癌发展及转移的相关机制及寻找新药靶点提供理论基础。
1 材料与方法
1.1 主要材料与试剂
人胃腺癌细胞系SGC-7901、BGC-823购自中国科学院(上海)生物化学与细胞生物学研究所。DMEM培养液、10%FBS、PBS等购自美国Gibco公司;TRIzol试剂、LipofectamineTM2000试剂盒购自美国Invitrogen公司;乳酸脱氢酶(lactate dehydrogenase,LDH)释放检测试剂盒购自上海碧云天生物技术有限公司;β-actin、CHN1、Ki67、CDK2、CCNB1、BCL2、BAX一抗购自英国Abcam公司;PVDF膜、ECL化学发光显色液购自美国Millipore公司。
1.2 细胞培养
将人胃腺癌细胞系SGC-7901、BGC-823复苏后置于37 ℃、5% CO2的恒温培养箱中进行常规培养,取对数生长期细胞用于后续实验。
1.3 生物信息学分析
从TCGA数据库(http://www.cancergenome.nih.gov/)中下载胃腺癌的TCGA_STAD表达矩阵和临床信息,以中位数进行分组,将胃癌患者分为CHN1高表达组和CHN1低表达组,利用TCGA数据库分析CHN1在胃腺癌中的表达及其与临床表型的关系。从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中下载基因表达谱公共数据集GSE54397,分析miR-298在胃腺癌中的表达水平。运用RNAhybrid数据库(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid)预测miR-298与CHN1的靶向关系,评估miR-298与CHN1 3’-UTR的互补性。
1.4 细胞转染实验
1.4.1 CHN1低表达和干扰细胞的构建 取对数生长期细胞接种于6孔板,细胞密度达70%~80%时,根据LipofectamineTM2000试剂盒说明书以shCHN1 1#(shCHN1 1#组)、shCHN1 2#(shCHN1 2#组)及阴性对照慢病毒载体shNC(shNC组)转染细胞,空白对照组细胞不转染质粒。转染完成后采用嘌呤霉素筛选出稳定敲低CHN1的SGC-7901和BGC-823细胞系。
1.4.2 miR-298转染及CHN1共转染 根据LipofectamineTM2000试剂盒说明书分别转染miR-298模拟物(miR-298组)、阴性对照慢病毒载体miR-NC(miR-NC组)及miR-298模拟物+CHN1高表达质粒共转染体系(miR-298+CHN1组)。
1.5 CCK-8实验
调整各组细胞浓度为2×104/L,并接种于96孔板,无菌PBS填充边缘孔,在37 ℃、5% CO2培养箱中常规静置培养。于接种0 d、1 d、2 d、3 d、4 d、5 d向每孔滴加10 μL CCK-8工作液,继续培养4 h后采用DNM-9606型酶标分析仪(北京朗普新技术有限公司)检测450 nm波长处的吸光度(OD)值,绘制生长曲线。
1.6 克隆形成实验检测
将各组细胞制成单细胞悬液,以500个/皿的密度接种至含10 mL 37 ℃预温培养液的培养皿中,均匀分散细胞后常规静置培养。观察到肉眼可见的克隆时停止培养。弃去培养皿中的上清培养液后,用PBS清洗2次,以1∶3的比例加入醋酸/甲醇溶液固定15 min后,弃固定液,用Gimsa染色20 min,于流水下缓慢清洗染色液,计数克隆细胞。克隆形成率(%)=克隆数/接种细胞数×100%。
1.7 流式细胞术检测细胞周期
将各组细胞浓度调整为1×106/mL,并接种至6孔板,常规静置培养48 h,再置入离心管中,以1 000 r/min于4 ℃离心5 min后收集细胞,PBS洗涤,加入Annexin V-FITC细胞凋亡检测试剂盒(美国AAT Bioquest公司)中的缓冲液混匀,再加入PI、RNase A混合,4 ℃避光孵育30 min,采用FACSCalibur流式细胞仪(美国BD公司)进行检测分析。
1.8 LDH释放检测试剂盒检测细胞毒性
调整各组细胞浓度为2×104/L,并接种至96孔板中,无菌PBS填充边缘孔,在37 ℃、5%CO2培养箱中常规静置培养23 h后加入LDH释放试剂,反复吹打混匀,继续孵育1 h后常温下以1 000 r/min离心5 min,收集各组上清液,参照试剂盒说明书检测LDH释放量。
1.9 体内移植瘤实验
取对数生长期低表达CHN1稳定转染SGC-7901细胞株(shCHN1 1#组)及阴性对照SGC-7901细胞株(shNC组),制成单细胞悬液,于裸小鼠右腋下注射,每次注射1×106个活细胞,建立荷瘤小鼠模型,每组接种5只裸鼠。保持温度、光照节律不变,自由饮食、饮水。观察0 d、2 d、4 d、6 d、8 d、10 d、12 d、14 d固定时间下裸鼠移植瘤生长情况,在肉眼观察到瘤体形成后,每2 d用游标卡尺测量皮下移植瘤体积并绘制肿瘤生长曲线。14 d后处死小鼠,取出肿瘤,称重固定,然后用于免疫组化实验。
1.10 免疫组化实验
取各组小鼠瘤体组织,常规制成切片,脱蜡、水化后以枸橼酸钠抗原修复,3%H2O2去除内源性过氧化物酶,血清封闭,加入CHN1一抗(1∶250),4 ℃冰箱过夜,PBS清洗3次,滴加HRP标记的二抗(1∶250),室温孵育20 min,PBS清洗3次,滴加DAB显色,显微镜下控制显色,苏木素复染,1%盐酸酒精分化,自来水冲洗返蓝,梯度乙醇脱水后吹干,中性树胶封片。显微镜下随机选择5个高倍(×400)视野,统计阳性着色细胞占比,以细胞核呈棕黄色为CHN1阳性表达。
1.11 双荧光素酶报告实验
运用双荧光素酶报告分析CHN1与miR-298的靶向关系。根据靶基因预测软件预测的可能结合位点,设计合成该位点的DNA片段(CHN1 WT)及该位点突变体的DNA片段(CHN1 MUT),退火后克隆至双荧光素酶启动子载体中。将合成的包含有CHN1 WT及CHN1 MUT的质粒与miR-298共转染至SGC-7901细胞,孵育48 h后弃去培养基,采用荧光素酶检测试剂盒检测细胞荧光素酶活性。
1.12 qRT-PCR实验
采用qRT-PCR法检测人胃腺癌细胞SGC-7901、BGC-823中CHN1 mRNA的表达水平。TRIzol法提取总RNA,按照反转录试剂盒说明书反转录得到cDNA,采用ABI7500型荧光定量PCR仪(美国Thermofisher)完成PCR扩增, PCR反应条件:95 ℃、5 min,95 ℃、30 s,65 ℃、30 s,72 ℃、30 s,共35个循环,最后72 ℃延伸1 min。以GAPDH作为标准内参,采用2-ΔΔCt法对CHN1的相对表达进行定量。引物序列如下:CHN1-F,5’-GGAGCTACCTCATCCGGGAG-3’;CHN1-R,5’-TGTGTC-TCTTTCAGGACTGGCA-3’;GAPDH-F,5’-CAGCCAGGAGA-AATCAAACAG-3’;GAPDH-R,5’-GACTGAGTACCTGAAC-CGGC-3’。
1.13 Western blot实验
将各组细胞培养48 h后,提取总蛋白,Bradford调节蛋白浓度。经SDS-PAGE凝胶电泳、电转膜至PVDF膜,密封2 h,添加β-actin、CHN1、Ki67、CDK2、CCNB1、BCL2、BAX一抗4 ℃孵育过夜,用TBST漂洗40 min,加入HRP标记的二抗孵育1 h,TBST漂洗40 min,ECL发光液显色,暗室曝光。各组蛋白条带灰度值采用Imaging System软件分析,标准内参为β-actin,计算各蛋白的相对灰度值。
1.14 统计学方法

2 结果
2.1 CHN1在胃腺癌中的表达情况及其与临床表型的关系
采用TCGA数据库分析CHN1在胃腺癌中的表达情况及其与临床表型的关系,结果显示,CHN1在胃腺癌组织中高表达(P<0.05),其表达水平与美国癌症联合会(American Joint Committee on Cancer,AJCC)临床分期、AJCC T分期、分化程度、AJCC N分期、AJCC M分期、预后有关(P<0.05),且CHN1高表达者的总生存率、无病生存率均低于CHN1低表达者(P<0.05),见图1。

a:CHN1在胃腺癌及癌旁组织中的表达;b:CHN1在不同临床分期患者中的表达c:CHN1在不同AJCC T分期患者中的表达;d:CHN1在不同分化程度患者中的表达;e:CHN1在不同预后患者中的表达;f:CHN1在不同AJCC N分期患者中的表达;g:CHN1在不同AJCC M分期患者中的表达;h:CHN1高、低表达患者的总生存率;i:CHN1高、低表达患者的无病生存率 *:P<0.05图1 CHN1在胃腺癌中的表达及其与临床表型的关系
2.2 CHN1低表达对胃腺癌细胞增殖及细胞周期的影响
与shNC组相比,shCHN1 1#组和shCHN1 2#组SGC-7901和BGC-823细胞CHN1蛋白表达、OD值、克隆形成率、处于G0/G1期的细胞比例均明显下降(P<0.05),处于S期的细胞比例明显上升(P<0.05),处于G2/M期的细胞比例无显著变化(P>0.05),Ki67、CDK2、CCNB1蛋白表达水平明显下降(P<0.05),见图2。以上结果提示CHN1低表达能抑制胃腺癌细胞增殖,并影响细胞周期。

a:Western blot检测CHN1蛋白表达;b、c:CCK-8检测细胞活力;d:克隆形成实验检测细胞增殖能力;e、f:流式细胞术检测细胞周期;g:Western blot检测细胞周期相关蛋白的表达水平 *:与shNC组相比,P<0.05图2 CHN1低表达对胃腺癌细胞增殖及细胞周期的影响
2.3 CHN1低表达对胃腺癌细胞凋亡的影响
与shNC组相比,shCHN1 1#组和shCHN1 2#组SGC-7901和BGC-823细胞的LDH释放、细胞凋亡率均明显升高(P<0.05),BCL2蛋白表达水平明显下降(P<0.05),BAX蛋白表达水平明显上升(P<0.05),见图3。以上结果提示CHN1低表达能促进胃腺癌细胞凋亡。

a:细胞毒性检测;b:细胞凋亡检测;c:凋亡相关蛋白表达水平检测 *:与shNC组相比,P<0.05
2.4 CHN1低表达对裸鼠成瘤能力的影响
与shNC组相比,shCHN1 1#组小鼠的瘤体体积、质量明显下降(P<0.05),小鼠瘤体组织中的CHN1蛋白表达水平明显下降(P<0.05),见图4。提示CHN1低表达在体内抑制胃腺癌细胞增殖。
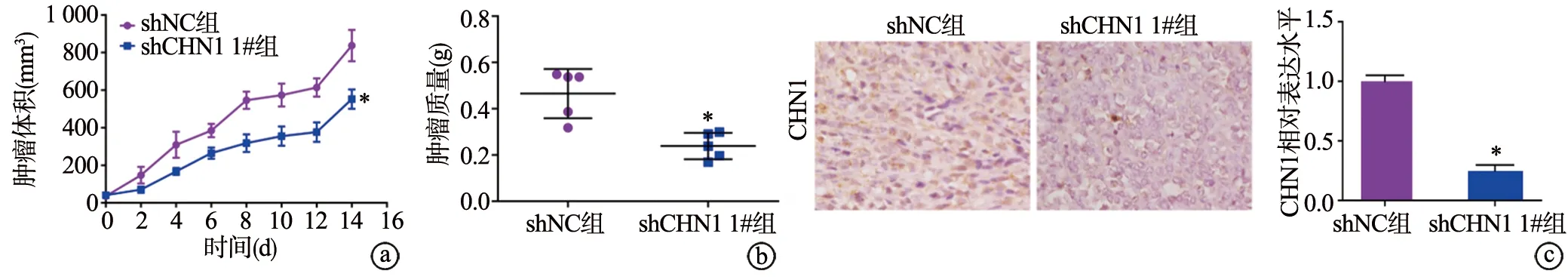
a~b:CHN1低表达对裸鼠瘤体体积、质量的影响;c:免疫组化法检测瘤体中CHN1蛋白表达(×400) *:与shNC组相比,P<0.05
2.5 miR-298靶向负调控CHN1的表达
与癌旁组织相比,miR-298在胃腺癌中低表达(P<0.05)。运用RNAhybrid数据库分析发现,miR-298与CHN1存在靶向结合位点;荧光素酶报告结果显示,CHN1-MUT组的荧光素酶活性无显著变化,而CHN1-WT组的荧光素酶活性显著降低,表明结合位点的突变使得miR-298与CHN1的靶向调控作用消失。与miR-NC组相比,miR-298组SGC-7901和BGC-823细胞CHN1 mRNA及蛋白表达水平明显下降(P<0.05),见图5。提示miR-298在胃腺癌中低表达,且其能靶向负调控CHN1的表达。

a、b:生物信息学分析miR-298在胃腺癌中的表达水平及miR-298与CHN1的靶向关系;c:双荧光素酶报告实验验证miR-298与CHN1的靶向关系;d:qRT-PCR检测CHN1 mRNA相对表达水平;e:Western blot检测CHN1蛋白表达水平 *:P<0.05图5 miR-298靶向负调控CHN1的表达
2.6 miR-298靶向负调控CHN1的表达抑制胃腺癌细胞增殖
与miR-NC组相比,miR-298组SGC-7901和BGC-823细胞CHN1蛋白表达、OD值、克隆形成率均明显下降(P<0.05),处于G0/G1期的细胞比例明显下降(P<0.05),处于S期的细胞比例明显上升(P<0.05),处于G2/M期的细胞比例无显著变化(P>0.05),Ki67蛋白表达水平明显下降(P<0.05);而与miR-NC组相比,miR-298+CHN1组上述指标无明显变化(P<0.05),见图6。提示miR-298可通过靶向负调控CHN1的表达抑制胃腺癌细胞增殖。
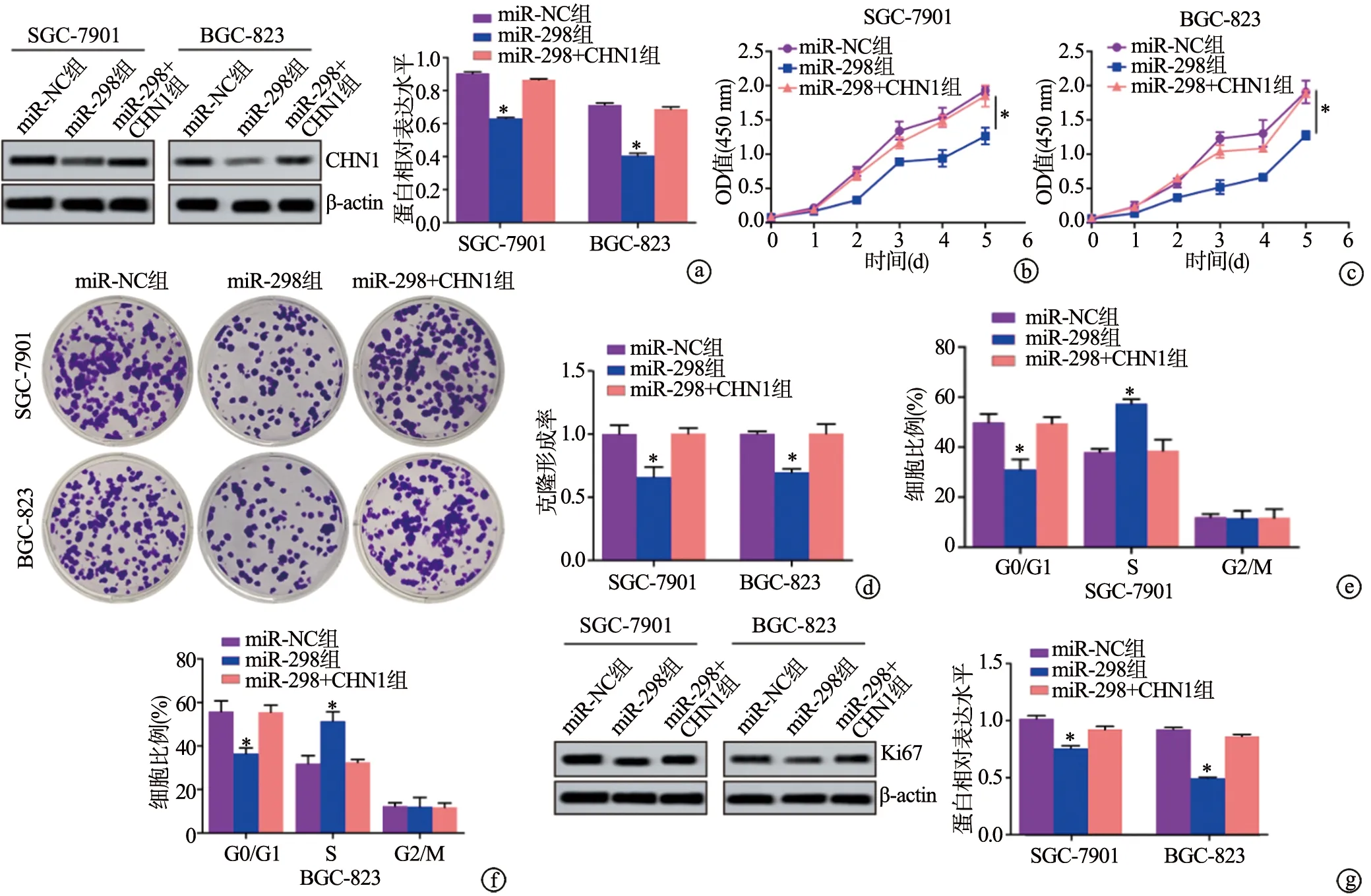
a:Western blot检测CHN1蛋白表达水平;b、c:CCK-8检测细胞活力;d:克隆形成实验检测细胞增殖能力;e、f:流式细胞术检测SGC-7901和BGC-823细胞周期;g:Western blot检测细胞周期相关蛋白表达水平 *:与miR-NC组相比,P<0.05图6 miR-298靶向负调控CHN1的表达抑制胃腺癌细胞增殖
3 讨论
CHN1位于人类2号染色体的q31-32.1区域,其可编码一种GTP酶激活蛋白,该蛋白能够与GDP或GTP结合[10]。目前,已有学者对CHN1开展系列研究,但多集中在神经生物学领域,如对脑部发育、神经信号传导、突触的发生机制等的影响,而CHN1对肿瘤发生发展过程的影响鲜有报道[11]。Zhao等[12]研究显示,CHN1在宫颈癌组织中高表达,且与宫颈癌患者的淋巴结转移状态及不良预后密切相关。Li等[13]运用生物信息学技术分析发现,在胃癌患者中CHN1表达明显上调,且其高表达与患者的不良预后显著相关。本研究利用TCGA数据库分析CHN1在胃腺癌中的表达情况及其与临床表型的关系,结果显示,CHN1在胃腺癌中高表达,其表达水平与AJCC临床分期、AJCC T分期、分化程度、AJCC N分期、AJCC M分期、预后有关,且CHN1高表达者的总生存率、无病生存率均低于CHN1低表达者,同时,本研究在胃腺癌细胞系SGC-7901、BGC-823中证实,CHN1低表达可导致细胞的增殖活力及克隆形成率明显下降,LDH释放更加明显,且细胞周期阻滞于S期,提示CHN1在胃腺癌的发生发展过程具有重要作用。
Ki67是一种与有丝分裂密切相关的核抗原,在细胞增殖中不可或缺,可作为检测细胞增殖能力的重要指标[14]。CDK2、CCNB1则是机体内研究发现调控细胞周期的两类蛋白,CDK2主要参与细胞G1期向S期转变的过程;CCNB1主要通过和CDKs结合后,促进细胞的G2/M期转变[15-16]。BCL2在细胞凋亡过程中起关键作用,能抑制细胞凋亡;BAX则主要发挥促凋亡作用,两者在细胞内表达比例的失衡与细胞凋亡密切相关[17]。本研究结果显示,CHN1表达下调后,Ki67、CDK2、CCNB1、BCL2蛋白表达水平明显下降,BAX蛋白表达水平明显上升,进一步证实了CHN1低表达对胃腺癌细胞系SGC-7901、BGC-823的增殖活性具有抑制作用。本研究裸鼠体内成瘤实验结果显示,抑制CHN1表达后,移植瘤的生长受到抑制,且CHN1蛋白表达明显下降,提示CHN1在胃腺癌的发生发展过程中具有重要作用,CHN1低表达在体内也能抑制胃腺癌细胞生长。
miR-298位于人类20号染色体的q13-32区域,近年来国内外相关研究均发现其与恶性肿瘤的发生发展密切相关[18-19]。Arabsorkhi等[20]研究显示,结肠癌患者肿瘤组织及血浆中的miR-298表达水平异常,且与患者的TNM分期、肿瘤分化程度及淋巴结转移密切相关,miR-298的异常表达是导致患者预后不良的重要因素之一,故认为miR-298可能是结肠癌的治疗靶点。Li等[21]研究显示,miR-298在甲状腺癌组织中表达下调,且miR-298过表达可显著增加BAX和caspase-3蛋白表达水平,降低BCL2蛋白表达水平,还能抑制细胞增殖,促进细胞凋亡。本研究也发现,miR-298在胃腺癌中呈低表达。miR-298靶基因的鉴定具有重要意义,能帮助理解miR-298在胃腺癌发生发展过程中的作用,确定新的治疗靶点。本研究利用生物信息学技术分析发现,CHN1是miR-298的下游靶基因,双荧光素酶实验结果亦证实了miR-298可直接靶向作用于CHN1,二者存在负调控关系。为进一步分析miR-298靶向调控CHN1表达对胃腺癌细胞增殖的影响,本研究进行相关实验发现,与miR-NC组相比,miR-298组细胞增殖能力明显受到抑制,而miR-298+CHN1组则无明显变化,证实了miR-298可通过靶向负调控CHN1的表达抑制胃腺癌细胞增殖。
综上所述,miR-298在胃腺癌中低表达,其可能通过靶向结合CHN1影响胃腺癌细胞周期,抑制细胞增殖,并促进其凋亡。
