右美托咪定减轻缺氧诱导的人神经母细胞瘤细胞系SH-SY5Y损伤
2023-01-18阎晨,刘涛,宣斐
阎 晨,刘 涛,宣 斐
新疆医科大学附属肿瘤医院 麻醉与围手术期医学中心, 新疆维吾尔自治区 乌鲁木齐 830000
卒中和脑缺血疾病往往会引起神经元缺氧,神经元缺氧会进一步加剧该类疾病的进展[1]。由缺氧导致的神经元退化和细胞损伤常会引起血管性痴呆、阿尔茨海默病、帕金森病、 癫痫等一些神经退行性疾病[1-2]。因此,防治神经元缺氧损伤对缺血性脑病的治疗至关重要。
右美托咪定(dexmedetomidine,DEX)是一种麻醉辅助用药,其可在神经系统遭受创伤时抑制机体的炎性反应和氧化应激反应并调节细胞自噬和凋亡[3]。另外,DEX可降低由缺氧/复氧导致的大鼠心肌细胞系H9c2损伤[4]。而DEX在缺氧条件下对神经元的作用以及机制并不完全清楚。本研究通过在培养液中添加 氯化钴(CoCl2)模拟人神经母细胞瘤细胞系SH-SY5Y缺氧环境,观察在体外缺氧条件下DEX对SH-SY5Y细胞活性和细胞凋亡的影响,并探讨其中潜在的机制。
1 材料与方法
1.1 材料
1.1.1 细胞:人神经母细胞瘤细胞系(human neuroblastoma cell line)SH-SY5Y(武汉普诺赛生命科技有限公司)。
1.1.2 试剂(盒):胎牛血清(fetal bovine serum,FBS)和高糖杜氏改良培养液(dulbecco’s modified eagle medium,DMEM)(Hyclone公司);Annexin V-FITC/PI试剂盒(BD Pharmingen公司);TUNEL试剂盒(上海碧云天生物技术有限公司);GAPDH、p75神经营养素受体(p75 neurotrophin receptor,p75NTR)、半胱氨酸天冬氨酸蛋白酶9(cysteine aspartic protease-9,caspase-9)、cleaved caspase-9、核因子κB(nuclear factor-kappa B,NF-κB)和p-NF-κB抗体(Genetex公司);Caspase-3和cleaved caspase-3抗体(南京巴傲得生物科技有限公司);p75NTR慢病毒载体(Lenti-p75NTR)和慢病毒对照载体(Lenti-Con)(上海吉凯基因公司);MTT试剂、CoCl2试剂和实验中其他试剂(Sigma-Aldrich公司)。
1.2 方法
1.2.1 细胞的分组及处理:取指数增殖期的SH-SY5Y细胞,按参考文献[5]的方法,分别用终浓度为0.3、0.6、0.9和1.2 mmol/L CoCl2处理24 h,筛选缺氧条件的最适CoCl2浓度。将SH-SY5Y细胞分为对照组、缺氧组(anoxia,终浓度为1.2 mmol/L CoCl2处理24 h)、DEX干预组(DEX+anoxia,终浓度为1.2 mmol/L CoCl2和10 μmol/L DEX处理 24 h)、单独DEX组(终浓度为10 μmol/L DEX处理 24 h)、Lenti-Con组(感染Lenti-Con)、Lenti-Con+anoxia组(感染Lenti-Con后,终浓度为1.2 mmol/L CoCl2处理24 h)、Lenti-Con+anoxia+DEX组(感染Lenti-Con后,终浓度为1.2 mmol/L CoCl2和10 μmol/L DEX处理24 h)、Lenti-p75NTR+anoxia+DEX组(感染Lenti-p75NTR后,终浓度为1.2 mmol/L CoCl2和10 μmol/L DEX处理24 h)。
1.2.2 MTT法检测细胞活性:将各组细胞重悬浮后接种在96孔板,每孔接种5 000个细胞,培养24 h后,每孔加入10 μL MTT试剂(0.5 g/L),37 ℃孵育4 h。加入150 μL DMSO溶解结晶后,用酶标仪在570 nm波长处测各孔吸光度值。
1.2.3 镜下观察细胞形态表现:将各组细胞重悬浮后接种在6孔板,培养24 h后,用倒置显微镜观察细胞形态学变化并拍照,用Image J软件对每组样品的5个随机视野行细胞计数与细胞表面积测量。
1.2.4 Annexin V-FITC/PI染色检测细胞凋亡:按照说明书步骤,对各组细胞进行annexin Ⅴ和PI标记,在LSRII流式细胞仪中上机检测,用FlowJo软件统计凋亡细胞数。
1.2.5 TUNEL染色检测TUNEL阳性细胞比例:4%多聚甲醛固定各组细胞并用0.3%Triton X-100处理20 min。按照说明书步骤,加入100 μL TUNEL检测液室温避光孵育1.5 h,加入DAPI避光5 min,荧光显微镜下观察并采用随机视野拍照。
1.2.6 Western blot检测cleaved caspase 9、cleaved caspase 3、p-NF-κB和p75NTR蛋白表达:提取各组细胞的蛋白,行常规Western blot转印。按抗体说明书,4 ℃分别孵育一抗(GAPDH、caspase-9、cleaved caspase-9、caspase-3、cleaved caspase-3、NF-κB、p75NTR和p-NF-κB)过夜。第2天,TBST洗膜后室温孵育HRP标记的二抗1 h,TBST洗膜后,ECL化学发光显像,并用Quantity One软件分析条带的灰度值。
1.3 统计学分析
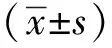
2 结果
2.1 DEX在缺氧条件下对SH-SY5Y细胞的保护作用
CoCl2浓度依赖性降低SH-SY5Y细胞活性(P<0.05或P<0.01)(图1A)。选用1.2 mmol/L CoCl2浓度构建细胞缺氧模型,与对照组相比,anoxia组细胞活性下降(P<0.01),与anoxia组比较,anoxia+DEX组SH-SY5Y细胞活性明显回升(P<0.01)(图1B)。
2.2 DEX在缺氧条件下对SH-SY5Y细胞形态的影响
与对照组比较,anoxia组细胞形态和密度发生改变,主要表现为退化细胞增多(P<0.01)、胞体变小(P<0.01)以及细胞密度降低(P<0.01),DEX可明显缓解缺氧条件下的这些改变(P<0.01)(图2)。

A.effects of different concentrations of CoCl2 on the cell viability of SH-SY5Y cells; B.effect of DEX treatment on the cell viability of SH-SY5Y cells under anoxia condition; *P<0.05,**P<0.01 compared with control group; # P<0.01 compared with anoxia group

A.representative images of cellular morphology (scale bar=30 μm); B.statistical results of degenerated cell count; C.cell area; D.total cell count; *P<0.01 compared with control group; # P<0.01 compared with anoxia group
2.3 DEX在缺氧条件下对SH-SY5Y细胞凋亡的影响
与对照组比较,anoxia组TUNEL阳性染色细胞数和细胞凋亡率均明显增加(P<0.01);与anoxia组比较,anoxia+DEX组TUNEL阳性染色细胞数和细胞凋亡率均明显降低(P<0.01)(图3)。
2.4 DEX在缺氧条件下对p75NTR、p-NF-κB以及caspase-3和-9表达的影响
与对照组比较,anoxia组cleaved caspase-9、cleaved caspase-3、p75NTR和p-NF-κB蛋白表达水平均明显增加(P<0.01);与anoxia组比较,anoxia+DEX组上述蛋白表达水平均明显降低(P<0.01)(图4)。

A.representative fluorescence images of TUNEL staining (scale bar, 100 μm); B.representative apoptotic flow cytometry images of annexin V-FITC/PI staining; C, D.statistical results of TUNEL-positive cells (C) and apoptotic rate (D); *P<0.01 compared with control group; # P<0.01 compared with anoxia group

A.representative Western blot images of cleaved caspase-3, cleaved caspase-9, p75NTR and p-NF-κB expressions; B-E.statistical results of cleaved caspase-3/caspase-3 (B), cleaved caspase-9/caspase-9 (C), p75NTR/GAPDH (D) and p-NF-κB/NF-κB (E) expression levels; *P<0.01 compared with control group; # P<0.01 compared with anoxia group
2.5 外源性恢复p75NTR表达可抑制DEX对缺氧条件下SH-SY5Y细胞的保护作用
与Lenti-Con+anoxia+DEX组比较,Lenti-p75NTR+anoxia+DEX组细胞中p75NTR和p-NF-κB表达水平均明显增加(P<0.01),细胞活性明显降低(P<0.01),细胞凋亡率明显增加(P<0.01)(图5)。
3 讨论
SH-SY5Y细胞在功能上与神经元相似,常被用于模拟神经元体外功能方面的研究。本实验选择SH-SY5Y细胞作为研究对象,并通过CoCl2刺激法模拟神经元缺氧的细胞模型,并在此模型中观察DEX对SH-SY5Y细胞损伤的影响,结果显示,在缺氧条件下,DEX能增加SH-SY5Y细胞活性,降低其凋亡并改善细胞胞体变小等形态学退化,提示,DEX能缓解缺氧导致的SH-SY5Y细胞损伤。
在中枢神经系统,NF-κB/Rel广泛存在于皮质和海马区的神经细胞中[6]。NF-κB是脑缺血损伤中调节神经炎症与神经细胞凋亡的关键分子[7]。在脑缺血发生时脑组织神经细胞中NF-κB被激活,且神经细胞中NF-κB活化能进一步促进炎性分子的转录表达、活性氧的生成以及神经元的凋亡,最终加重神经损伤[7-8]。脑缺血必然导致脑缺氧。在体外各种神经细胞缺氧模型中均发现NF-κB活化,而抑制NF-κB激活可以减轻缺氧对神经细胞造成的细胞损伤[9-10]。在本研究中,CoCl2可造成SH-SY5Y细胞形态学退化以及凋亡并伴随着p-NF-κB表达增加,而DEX可明显减轻以上变化。这一结果提示,DEX在缺氧条件下对SH-SY5Y细胞的保护作用,此保护作用在一定程度上与DEX抑制NF-κB活化相关。p75NTR是神经营养因子的低亲和力受体,主要在神经细胞中表达,可通过不同的信号传导通路调节以神经细胞为主的细胞增殖、迁移、分化、生存、凋亡、突触和神经形成[15]。缺氧可促进神经元中p75NTR表达;且外源性p75NTR导入可造成神经元中NF-κB活化,最终导致神经元凋亡[11-12]。DEX可通过抑制p75NTR抑制高糖诱导的视网膜色素上皮细胞凋亡[13]。本研究通过Western blot实验证明了在缺氧条件下SH-SY5Y细胞p75NTR表达升高,而DEX可明显降低此蛋白表达。这些结果说明p75NTR以及下游NF-κB信号通路可能参与DEX对缺氧条件下SH-SY5Y细胞的抗凋亡作用。为进一步证明DEX是通过p75NTR抑制SH-SY5Y细胞凋亡,本研究通过病毒感染法在SH-SY5Y细胞中导入外源性p75NTR,实验结果显示,恢复p75NTR表达能消除DEX对SH-SY5Y细胞的保护作用。DEX可通过抑制Notch/NF-κB信号通路保护PC12免受糖氧剥夺损伤[14],本研究结果进一步证明了NF-κB和其上游调节因子p75NTR在DEX保护神经元缺氧损伤中的作用。
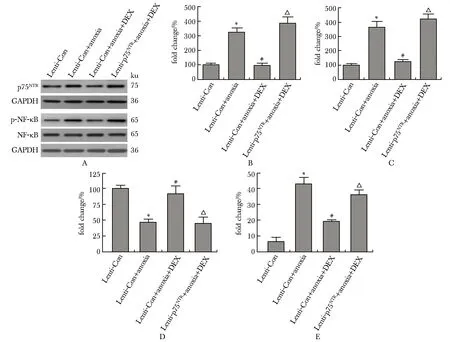
A.representative Western blot images of p75NTR and p-NF-κB expressions; B, C.statistical results of p75NTR and p-NF-κB expression levels; D.statistical results of cell viability; E.statistical results of apoptotic rate; *P<0.01 compared with Lenti-Con group; # P<0.01 compared with Lenti-Con+anoxia group; △ P<0.01 compared with Lenti-Con+anoxia+DEX group

综上,在缺氧条件下DEX通过抑制p75NTR以及下游NF-κB信号通路从而增强神经细胞活性并降低凋亡水平,对神经细胞发挥保护作用。
