鲍曼不动杆菌外膜囊泡诱发人单核-巨噬细胞THP-1的炎性反应
2023-01-18付士祥丁龙坤焦玉东
付士祥,席 月,丁龙坤,闫 曼,赵 俊,焦玉东,吴 亮*
1.扬州市第三人民医院,江苏 扬州 225000; 2. 江苏大学 医学院, 江苏 镇江 212013
鲍曼不动杆菌(Acinetobacterbaumannii,A.baumannii)是目前临床常见病原菌,近年来各类抗生素的长期大量使用,鲍曼不动杆菌耐药性迅速增强,多重/泛耐药菌株在临床中的分离率迅速上升,由此诱发的呼吸机相关性肺炎给重症患者的救治带来了巨大挑战[1]。目前对于鲍曼不动杆菌耐药性研究较多,但对其毒力机制的研究却滞后,严重阻碍了临床鲍曼不动杆菌感染的治疗[2]。鲍曼不动杆菌侵入宿主细胞后可以诱发宿主强烈免疫反应并造成炎性损伤,进而诱发急性肺损伤和急性呼吸窘迫综合征[3]。鲍曼不动杆菌的各种毒力因子不仅诱发宿主组织和细胞炎性损伤,还可以帮助细菌逃避宿主免疫清除。已知的鲍曼不动杆菌毒力因子包括:外膜囊泡、外膜蛋白质和生物被膜等[4]。
外膜囊泡(outer membrane vesicles, OMVs)是近年来新发现的革兰阴性菌的一种全新分泌模式,OMVs内含高浓度且结构完整的细菌毒力蛋白质并可以进行长距离转运,将毒力蛋白质转运至远处器官发挥致病作用[5]。OMVs通常来源于细菌外膜系统,故称细菌外膜囊泡,是由外膜、周质蛋白质、磷脂和LPS构成。OMVs直径约为20~250 nm,内含各种外膜蛋白质、miRNA、lncRNA等毒力成分,在细菌致病过程中发挥重要作用。鲍曼不动杆菌可以分泌OMVs,但对其OMVs的致病作用仍缺乏充分研究。本研究通过超速离心法纯化制备鲍曼不动杆菌OMVs,并探讨OMVs诱导巨噬细胞THP-1炎性反应能力。
1 材料与方法
1.1 细胞与试剂
人单核白血病细胞系THP-1(中科院细胞库)由本实验室自行保种和培养;鲍曼不动杆菌标准菌株(ATCC 19606)(南京鼓楼医院检验科周万青博士惠赠);RPMI 1640细胞培养液和胎牛血清(BI公司);反转录试剂盒、实时定量PCR试剂盒(SYBR Green染料法)、总RNA提取试剂盒(南京诺唯赞生物科技公司);引物(苏州金唯智生物科技公司合成);RIPA裂解液、蛋白酶抑制剂(PMSF)、细胞核蛋白质和细胞质蛋白质抽提试剂盒、活性氧检测试剂盒(碧云天生物技术公司);IL-1β检测试剂盒(ELISA)(江苏酶免实业有限公司);兔抗NLRP3、caspase-1、Beclin-1、LC3-Ⅱ、鼠抗β-肌动蛋白抗体和HRP标记的山羊抗兔或鼠抗体(武汉ABclonal生物科技公司);细胞caspase-3酶活性测定试剂盒(北京Solarbio生物技术公司);ECL显色液(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 鲍曼不动杆菌OMVs的提纯: 常规方法增菌培养鲍曼不动杆菌标准株,参考文献[6]方法提纯细菌OMVs,所提纯OMVs重溶于适量无菌PBS缓冲液并保存于4℃中,BCA法试剂盒检测蛋白浓度,经2.5%戊二醛固定后送扬州大学测试中心进行透射电镜分析。
1.2.2 THP-1细胞-OMVs共孵育: 按常规方法培养THP-1细胞,取对数增殖期细胞接种于6孔板(1×106个/孔),12 h后加入100 μg/mL佛波酯(phorbol-12-myristate-13-acetate,PMA)诱导12 h转化为巨噬态(PMA-stimtilated THP-1 cell)(即细胞绝大部分贴壁),再分别加入5和50 μg/mL的OMVs,同时设正常对照组,继续培养1、3 和6 h后终止实验,收集细胞用于后续实验。
1.2.3 RT-qPCR检测mRNA: 使用Trizol法抽提THP-1细胞总RNA,参照文献[7]报道方法检测NLRP3炎性复合体mRNA表达水平。以GAPDH作为内参,通过公式2-△△Ct计算基因相对表达量。引物序列(表1)。

表1 引物序列Table 1 Primer sequence
1.2.4 ELISA检测IL-1β:收集各组细胞培养上清液采用ELISA试剂盒检测上清液中IL-1β浓度,使用酶标仪在450 nm处测吸光度值,绘制标准曲线并计算各组细胞上清液中IL-1β浓度。
1.2.5 酶促动力学法检测caspase-3活性:严格按照试剂盒说明书,收集1×106个细胞并以无菌PBS缓冲液充分洗涤去除残留培养液。细胞中加入100 μL裂解液于冰上裂解15 min,以4 ℃、14 000 r/min离心15 min后吸取上清转移至新离心管中并立即用于caspase-3酶活性检测。在离心管中逐次加入检测缓冲液80 μL、待测样本10 μL和反应底物Ac-DEVD-pNA(2 mmol/L) 10 μL后充分混匀并于37 ℃中避光反应90 min,分光光度计检测A405吸光度值。同时设置空白对照组以蒸馏水代替待测样本,并检测其吸光度值。实验组△A405=测定管A405-空白对照管A405(样本中caspase-3催化产生的pNA产生的吸光度),通过标准曲线计算样本的caspase-3酶活性。
1.2.6 蛋白质印迹法检测目的蛋白:采用文献[7]报道方法检测NLRP3、caspase-1、LC3-Ⅱ和Beclin-1蛋白表达量,以鼠抗β-肌动蛋白抗体为内参。经两轮抗体孵育后采用ECL显色液曝光显色,通过灰度扫描分析各个目的蛋白相对表达量。
1.2.7 流式细胞测量术检测活性氧:按照试剂盒说明书采用2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针法检测THP-1细胞活性氧水平。将细胞与DCFH-DA探针孵育后用于流式细胞仪检测。
1.3 统计学分析
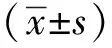
2 结果
2.1 OMVs的超微结构
OMVs为典型的圆形囊泡状,由脂质双分子层包裹,呈现经典“盘杯状”特征。大小约160 nm,其内可见低电子密度物质(图1)。
2.2 OMVs诱导NLRP3炎性复合体活化
不同浓度OMVs作用THP-1细胞时,NLRP3和caspase-1的mRNA表达量较对照组显著升高(P<0.05)。作用3 h时,50 μg/mL组NLRP3的mRNA表达量显著高于5 μg/mL组(P<0.05)(图2)。
2.3 细胞培养上清中IL-1β含量
不同浓度OMVs作用THP-1细胞,THP-1细胞培养液上清中IL-1β含量较对照组均显著升高(P<0.05)。1和3 h时,50 μg/mL组细胞培养液上清IL-1β含量显著高于5 μg/mL组(P<0.05)(图3)。

*P<0.05 compared with the control group; # P<0.05 compared with the 5 μg/mL group图3 THP-1细胞培养液上清中IL-1β含量Fig 3 Content of IL-1β in supernatant of THP-1 cells
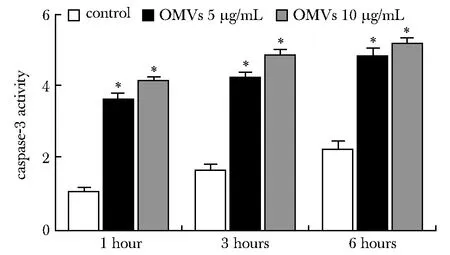
2.4 细胞caspase-3活性
以不同浓度OMVs处理THP-1细胞后,细胞caspase-3酶活性较对照组均显著升高(P<0.05)(图4)。
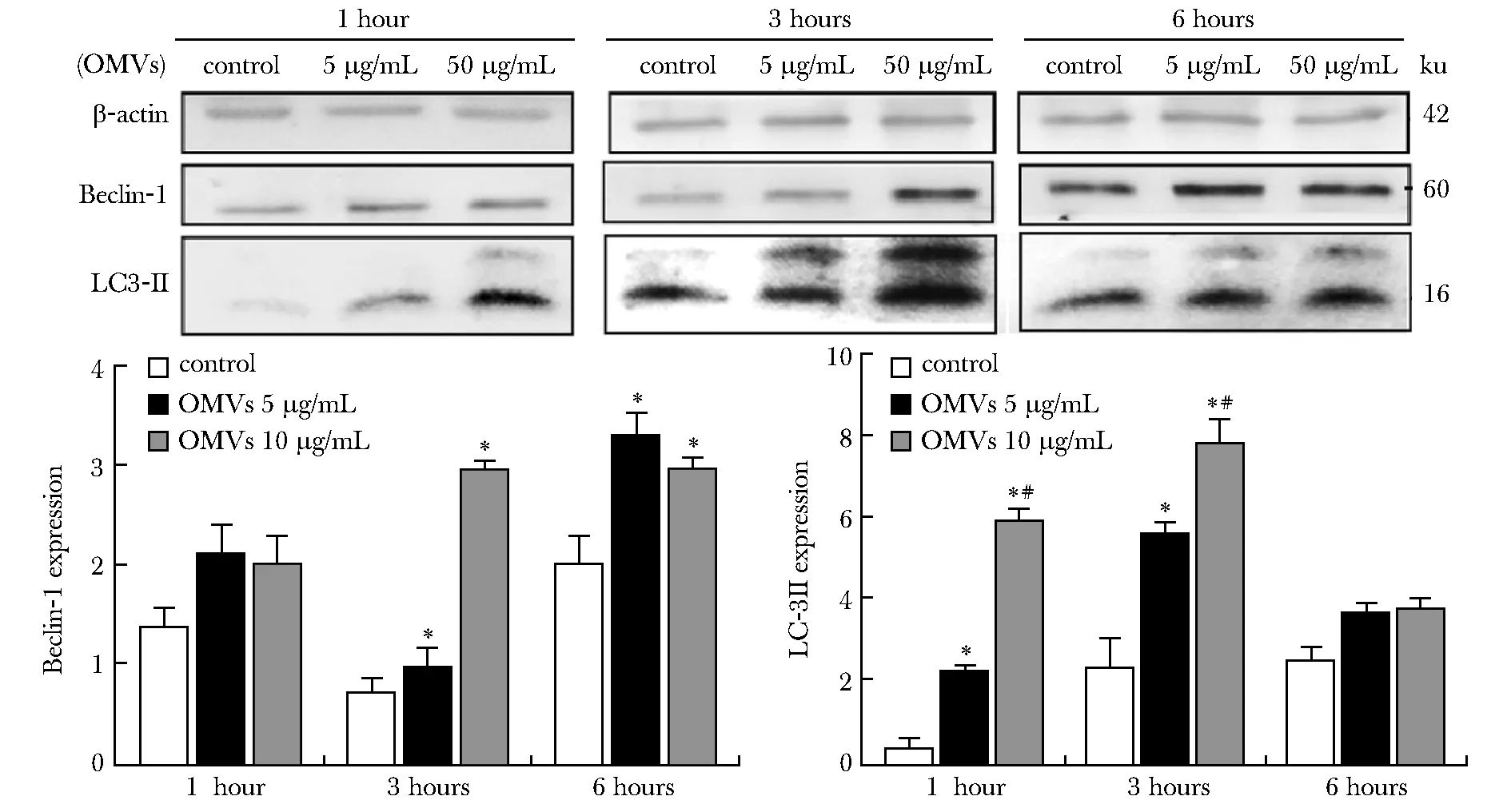
2.5 THP-1细胞自噬相关蛋白的表达
以不同浓度OMVs处理THP-1细胞后, THP-1细胞LC3-Ⅱ和Beclin-1表达量较对照组显著升高(P<0.05)。3 h时,50 μg/mL组细胞Beclin-1表达量显著高于5 μg/mL组(P<0.05)。与对照组比,5 μg/mL组Beclin-1蛋白表达仅在6 h相对升高(P<0.05)。随着OMVs作用浓度和时间的增加,在1和3 h 时THP-1细胞LC3-Ⅱ蛋白表达量逐渐升高,50 μg/mL组LC3-Ⅱ表达量显著高于5 μg/mL组(P<0.05)(图5)。
*P<0.05 compared with the control group图4 THP-1细胞caspase-3活性Fig 4 Caspase-3 activity in THP-1
2.6 OMVs诱导THP-1细胞生成活性氧
不同浓度OMVs作用THP-1细胞1 h时,5和50 μg/mL组细胞活性氧(reactive oxygen species,ROS)表达量均明显高于对照组(P<0.05);3 h时,仅5 μg/mL组细胞活性氧表达量显著高于对照组(P<0.05)(图6)。
*P<0.05 compared with the control group; # P<0.05 compared with the 5 μg/mL group图5 THP-1细胞自噬相关蛋白LC3-Ⅱ和Beclin-1表达量Fig 5 Expression of autophagy related proteins LC3-Ⅱ and Beclin-1 in THP-1

*P<0.05 compared with the control group图6 THP-1细胞活性氧(ROS)表达Fig 6 ROS exprssion in THP-1
3 讨论
细菌毒力因子在其侵入宿主细胞及逃避宿主免疫系统清除中发挥重要作用。外膜囊泡(OMVs)是细菌毒力蛋白质的一种新型转运载体,可以携带细菌的各种毒力蛋白质从病灶处向远方器官转运。OMVs中所携带的毒力蛋白质较胞浆中的纯度更高且结构完整,其致病作用更强[8],但鲍曼不动杆菌OMVs致病能力仍缺乏深入研究。
本研究结果表明,鲍曼不动杆菌OMVs可以诱导THP-1细胞(monocyte-derrved macrophages/PMA-stimulated THP-1 cells)NLRP3炎性复合体活化和IL-1β大量表达,且上述炎性因子表达量与OMVs浓度和作用时间呈正相关。适度炎性反应可以清除侵入病原体并介导组织修复[9],但严重感染时(如急性肺损伤和急性呼吸窘迫综合征)的过度炎性反应会进一步诱发“细胞因子风暴”及组织器官损伤[10]。其他革兰阴性杆菌OMVs也有类似功能,如肺炎克雷伯菌OMVs可以诱导HEp-2细胞和U937细胞产生大量炎性因子,并且诱导小鼠肺部出现与肺炎克雷伯菌直接感染相似的组织损伤[11]。有研究表明不同耐药性鲍曼不动杆菌OMVs的毒力并不相同,似乎随着耐药性增加而下降,上述情况值得进一步研究[12]。
凋亡和自噬是真核细胞的特殊死亡现象,具有维持生命体内环境稳态的重要作用。本研究发现两种浓度的鲍曼不动杆菌OMVs均可以显著诱导THP-1细胞自噬和凋亡。适度自噬和凋亡可以下调炎性反应水平,其机制可能是通过诱导巨噬细胞的自噬和凋亡以清除受损线粒体,减少活性氧和线粒体DNA释放,同时降解caspase-1前体以抑制NLRP3炎性小体活化,继而抑制IL-1β成熟[13]。但大量巨噬细胞的自噬和凋亡会减少人体内免疫细胞数量,降低固有免疫力,反而有利于细菌增殖。本研究结果显示在OMVs作用下,THP-1细胞感染1 和3 h时自噬和凋亡水平较高,感染6 h 时细胞NLRP3表达量降低,这可能与细胞大量死亡有关。
综上所述,鲍曼不动杆菌OMVs可以诱发宿主巨噬细胞的自噬和凋亡,并激活NLRP3炎性复合体和增加活性氧的生成。但大量巨噬细胞死亡反而有利于细菌大量增殖并加重炎性反应。因此,对于鲍曼不动杆菌感染者,仍应该尽早主动采用抗生素清除细菌,降低患者体内细菌和OMVs数量,预防严重感染诱发“细胞因子风暴”。
