核酸适配体W3介导靶向乳腺癌的量子点成像
2023-01-18李婉明
王 群,李 鑫,马 俊,李婉明
中国医科大学 卫生部细胞生物学重点实验室 医学细胞生物学教育部重点实验室 分子细胞生物学教研室, 辽宁 沈阳 110122
乳腺癌是女性常见的恶性肿瘤之一,其发病率呈逐年上升的趋势[1]。目前乳腺癌的诊断主要依赖影像检查技术,常用的乳腺癌影像检查方法包括B超、乳腺X线摄影、核磁共振成像(magnetic reson-ance imaging,MRI)、电子计算机断层扫描(computed tomography,CT)、正电子发射计算机断层显像(positron emission computed tomography,PET-CT)等[2]。然而,这些检查方法都有一定的局限性,例如灵敏度低、空间分辨率较低、诊断时间较长。因此,发展能够灵敏准确进行肿瘤早期诊断的新技术,特别是能够实现细胞水平的原位实时成像,对实现肿瘤的及时有效检测、提高治疗效果具有十分重要的意义。
核酸适配体(aptamer)是一段短的单链寡核苷酸片段,经过指数富集的配基系统进化技术筛选(system evolution of ligands by exponential enrich-ment,SELEX)得到,通过折叠成多种特定的三维空间立体结构与靶分子特异性结合,靶分子范围十分广泛,包括金属离子、生长因子、抗体、蛋白质、氨基酸、核苷酸,甚至细菌、细胞等[3]。量子点(quantum dots,QDs)是一种物理形状近似球形的新型荧光纳米晶体,直径一般小于10 nm,具有优越的物理化学性质,例如体积小、荧光寿命较长、抗光漂白能力强、宽的激发谱和窄的发射谱、较好的光源稳定性[4]。这些特性使得量子点成为体内癌细胞诊断、生物成像、肿瘤细胞靶分子标记以及基因表达过程示踪的强有力工具[5-6]。
前期研究显示核酸适配体W3能够特异性识别多种转移性肿瘤细胞,并且具有高亲和能力[7]。基于W3的靶向功能与量子点优越的特性,本研究将W3与量子点偶联制备量子点探针,用于乳腺癌细胞的靶向成像,并通过对临床患者组织标本的成像分析探讨其在临床应用上的可能性。
1 材料与方法
1.1 材料
1.1.1 标本来源:60例乳腺癌组织芯片(上海芯超科技有限公司)(表1)。
1.1.2 细胞及试剂:人乳腺癌细胞系MDA-MB-231、MDA-MB-468、MCF-7和人胚肾细胞系HEK293(上海中科院细胞库);链霉亲和素标记的量子点QD605(quantum dots-streptavidin,QD-SA)(武汉珈源量子点技术有限公司);胰蛋白酶、RPMI1640培养基、DMEM培养基和胎牛血清(fatal bovine serum,FBS)(HyClone公司);牛血清蛋白(bovine serum albumin,BSA)(Biosharp公司);4’,6-二脒基-2-苯基吲哚 (4,6-diamino-2-phenyl indole,DAPI)(Tiangen公司);核酸适配体W3序列和原文库(Library,W3筛选时的随机寡核苷酸文库)序列(上海生工生物公司)(表2)。

表1 乳腺癌组织芯片Table 1 Breast cancer tissue chip

表2 实验所用DNA序列Table 2 DNA sequences used in experiments
*N refers to a random sequence.
1.2 方法
1.2.1 流式细胞测量术检测核酸适配体W3与细胞的特异性结合:合成5’端6-羧基荧光素(6-carboxy-fluorescein, FAM)标记的核酸适配体W3和Library。分别取对数增殖期人乳腺癌细胞系MDA-MB-231、MDA-MB-468、MCF-7和人胚肾细胞系HEK293,用无酶细胞消化液消化细胞,吹打成单细胞悬液;1 000 r/min离心5 min,弃上清;加入FAM-W3或FAM-Library(终浓度为250 nmol/L),分别与细胞4 ℃孵育30 min,1 000 r/min离心5 min,弃上清;PBS洗涤两次,加入300 μL PBS重悬细胞,采用流式细胞测量术检测每组细胞的FAM荧光信号。荧光信号越强,表示结合能力越强。
1.2.2 流式细胞测量术检测量子点偶联的适配体W3(aptamer W3-quantum dots, W3-QDs)对不同细胞系的结合情况:合成5’端生物素(biotin)标记的核酸适配体W3和Library。取对数增殖期人乳腺癌细胞系MDA-MB-231、MDA-MB-468、MCF-7和人胚肾细胞系HEK293,无酶细胞消化液消化细胞,吹打成单细胞悬液。1 000 r/min离心5 min,弃上清;加入Biotin-W3或Biotin-Library(终浓度为250 nmol/L),分别与细胞4 ℃孵育30 min,1 000 r/min离心5 min,弃上清;加入QD-SA室温孵育20 min,1 000 r/min离心5 min,弃上清;PBS洗涤2次,加入300 μL PBS重悬细胞,流式细胞测量术检测每组细胞的QD荧光信号。利用FlowJo软件计算每组的荧光信号值,并与FAM-W3组比较荧光信号值大小,值越大,信号越强,说明灵敏度越高。
1.2.3 W3-QDs探针对乳腺癌组织的靶向成像:组织芯片60 ℃烤片4 h,100%二甲苯脱腊2次×15 min;100%乙醇2次×10 min,95%、90%、85%、75%和50%乙醇各5 min;PBS清洗3次×5 min;切片置于0.01 mol/L柠檬酸钠修复液中高压修复100 s,自然冷却至室温;PBS洗3次×5 min;加入封闭液(洗涤缓冲液+1% BSA+10% FBS)4 ℃孵育60 min;加入Biotin-W3 4 ℃过夜孵育;PBS洗3次×5 min,加入QD-SA室温孵育20 min;PBS洗3次×5 min,激光共聚焦荧光显微镜观察芯片组织上的红色QD荧光信号并拍照。
1.3 统计学分析
2 结果
2.1 核酸适配体W3的结合特性
与Library相比,核酸适配体W3与MDA-MB-231细胞和MDA-MB-468细胞的荧光结合峰发生了明显的右移,说明核酸适配体W3与这两种细胞均有不同程度的结合,而与MCF-7细胞和HEK293细胞的荧光结合峰几乎没有发生移动,即没有发生结合(图1)。
2.2 W3-QDs与乳腺癌细胞的特异性结合
W3-QDs与乳腺癌细胞系MDA-MB-231和MDA-MB-468孵育后的荧光强度明显高于FAM-W3(P<0.05)(图2),而对乳腺癌细胞系MCF-7和人胚肾细胞系HEK293仍然没有明显的荧光信号。与FAM-W3相比,W3-QD具有更高的灵敏度。
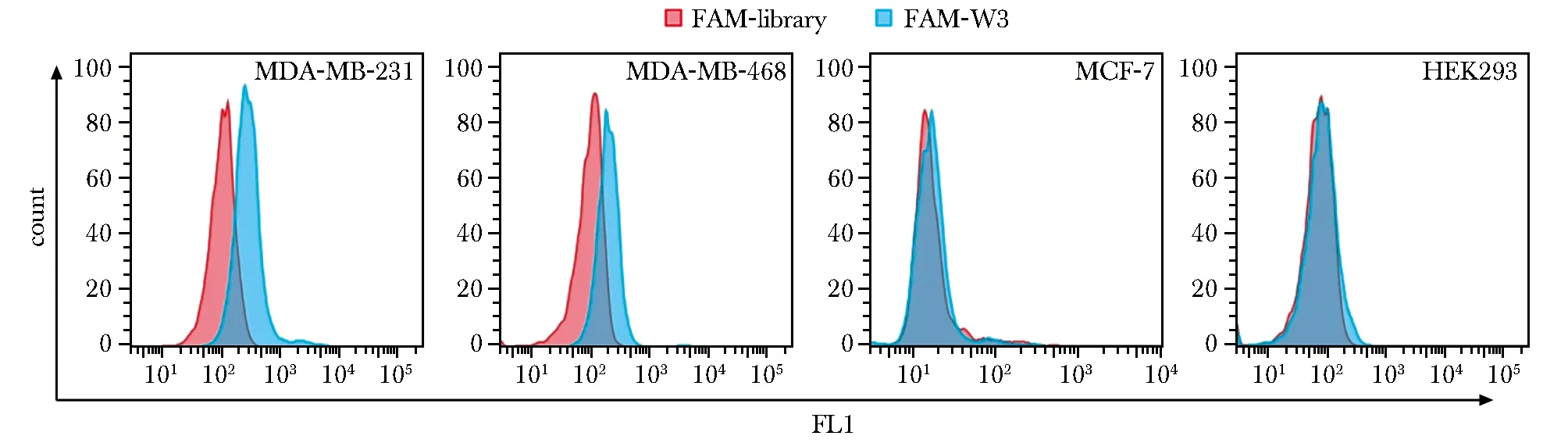
图1 流式细胞测量术检测核酸适配体W3与不同细胞系的结合Fig 1 Flow cytometry detection of the binding of aptamer W3 to various cell lines
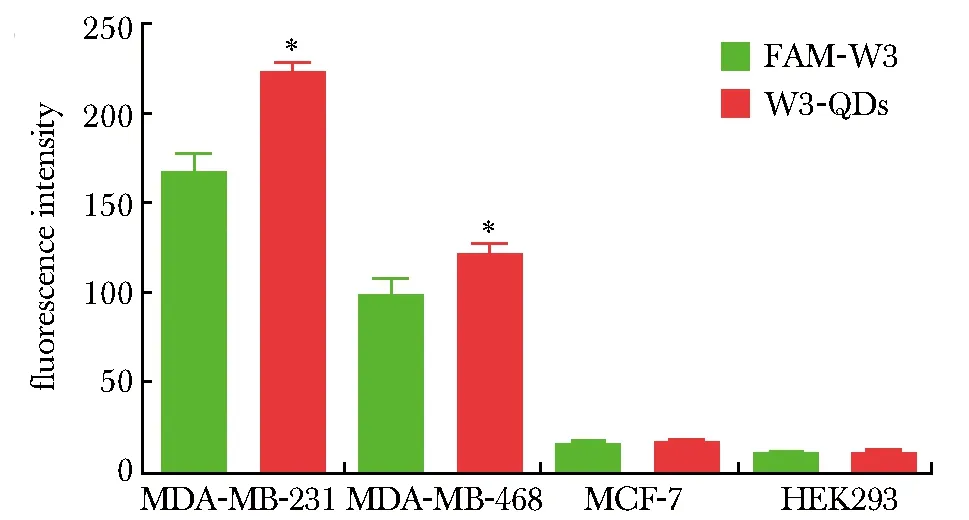
*P<0.05 compared with FAM-W3 group图2 W3-QDs与FAM-W3对细胞结合荧光强度的统计学分析Fig 2 Statistical analysis based on fluorescence intensity of
2.3 W3-QDs对乳腺癌组织的结合特性
组织芯片上的4例健康人乳腺组织、5例乳腺癌癌旁组织和2例乳腺良性肿瘤均没有观察到明显的QD特异性红色荧光,而其余乳腺癌原发灶和转移灶上均可以观察到不同荧光信号强度的QD红色荧光,且红色荧光主要分布在细胞膜表面。此外,乳腺癌转移灶组织上的荧光信号明显高于原发灶组织上的荧光信号(图3)。
2.4 W3-QDs的荧光强度与患者临床特征的关系
根据乳腺癌组织上QD红色荧光信号强度,将其分为4个等级(图4)。0期~2B期的乳腺癌组织上观察到的荧光信号较弱甚至没有,阳性率为52.9%(9/17),其中9例的阳性中7例是弱阳性(1+),2例是中等阳性(2+)。而恶性程度较高的3A~4期的乳腺癌组织中呈现100%(10/10)的阳性率,其中4例为弱阳性(1+),4例为中等阳性(2+),2例为强阳性(3+)(表3)。11例转移灶组织中只有2例没有观察到荧光信号,阳性率可达81.8%(9/11)(表4)。
2.5 W3-QDs对乳腺癌患者淋巴结的结合特性
淋巴结转移是一种常见的乳腺癌恶化病理指标。阴性淋巴结组织上几乎没有观察到明显的QD红色荧光,而阳性淋巴结组织上可以观察到强烈的QD红色荧光(图5),具体乳腺癌淋巴结组织荧光信号强度见(表5),阳性淋巴结组织上的阳性率可达83.3%(5/6)。
3 讨论
与传统医学影像方法CT、 PET和MRI等进行诊断相比,分子影像技术由于采用对疾病相关标志物具有特异性识别能力的靶向分子探针进行成像,可以满足重大疾病如肿瘤的早期诊断和准确分型。

图3 W3-QDs对临床乳腺癌组织的结合特性Fig 3 Binding properties of W3-QDs to clinical breast cancer tissue (×400)

图4 W3-QDs在乳腺癌组织上不同荧光程度的分级Fig 4 Different degrees of fluorescence of W3-QDs on breast cancer tissue (×400)

表3 乳腺癌原发灶组织上的荧光信号强度Table 3 Intensity of fluorescence signaling on primary breast cancer tissue
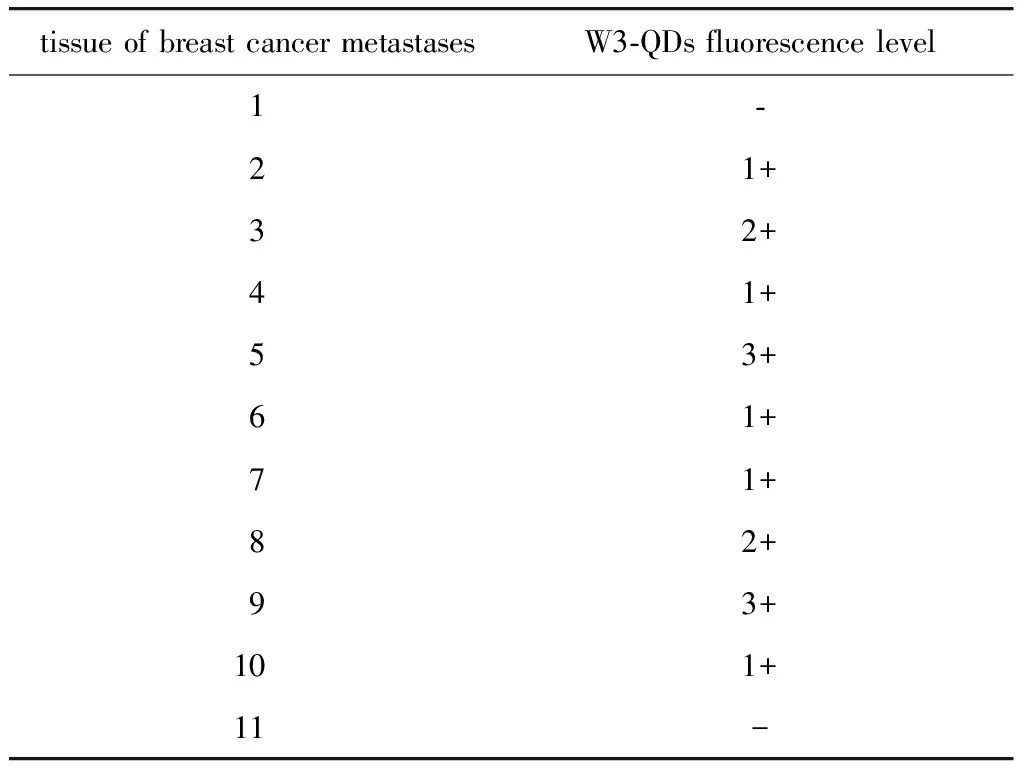
表4 乳腺癌转移灶组织上的荧光信号强度
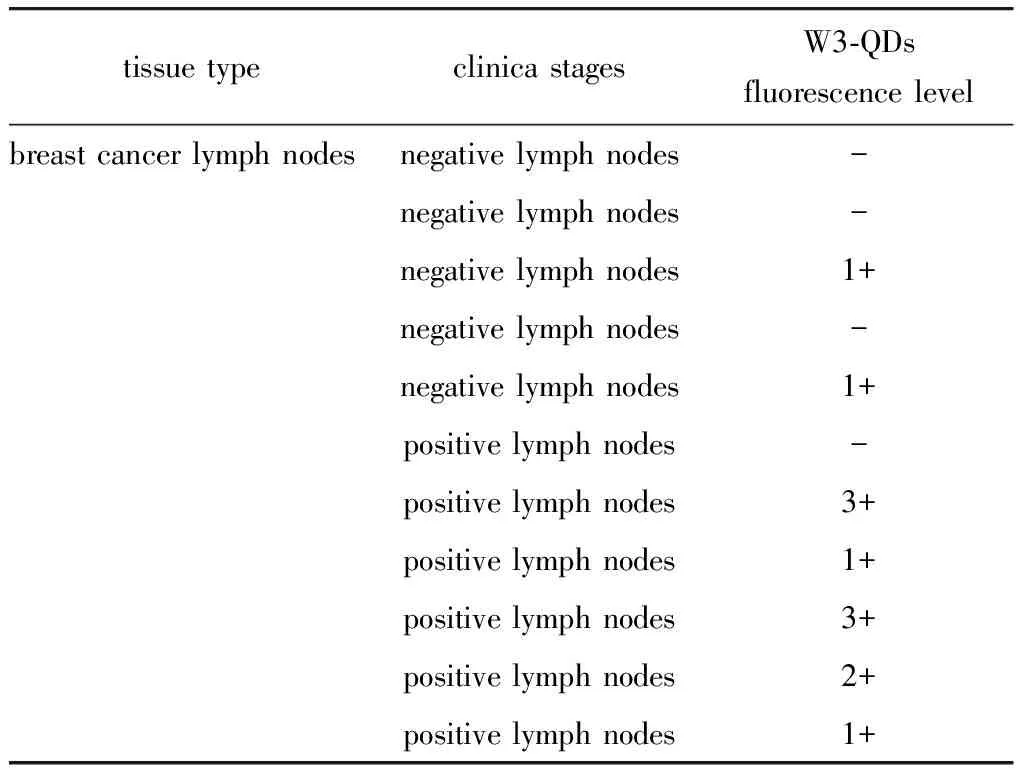
表5 乳腺癌淋巴结组织荧光信号强度

图5 W3-QDs对乳腺癌患者淋巴结的结合特性Fig 5 Binding specificity of W3-QDs to lymph nodes in breast cancer patients (×400)
目前单克隆抗体是临床常用的组织免疫荧光染色探针,但是抗体制备复杂、耗时费力、分子质量大、具有免疫原性等缺点,限制了其适用范围[8]。核酸适配体作为“化学抗体”,在临床组织标本的诊断方面具有极为广阔的应用前景[9]。有研究表明[10],在对淋巴组织进行成像分析时,靶向CD30的核酸适配体比抗体具有更高的灵敏度和特异性。本研究利用前期Cell-SELEX筛选获得的核酸适配体W3对临床乳腺癌组织进行靶向成像分析,结果发现,核酸适配体W3具有良好的肿瘤特异性,有可能成为乳腺癌诊断的分子探针。进一步对肿瘤组织标本的荧光信号进行分析,发现荧光信号的强弱与肿瘤恶性程度、淋巴结转移与否密切相关,表现为恶性程度高的或者发生淋巴结转移的肿瘤组织,荧光信号更强,这提示核酸适配体W3可以作为恶性乳腺癌的靶向成像分子探针。
近年来,具有特殊物理化学性质的功能性纳米材料如金纳米[11]、磁性颗粒[12],由于其独特的信号发生和增强效应,能够帮助提高肿瘤诊断的灵敏度和稳定性。其中,由于具有优良的光学性质,QD已成为新型的荧光探针,被广泛用于生物化学传感与生物医学成像等领域[13],特别是在肿瘤成像应用研究中,多种荧光QD已被用作肿瘤标志物识别探针,实现了细胞及体内肿瘤的特异性检测以及靶向成像[14]。前期研究[4]采用基于量子点的免疫组织化学(quantum dots based immunohistochemistry,QD-IHC),结果发现与常规IHC相比,QD-IHC显示出更高的检出率和灵敏度。此外,QD-IHC的操作更简单、结果分析更客观和优越的可重复性使其成为临床实践中更有吸引力的替代方案。本研究中,基于核酸适配体易于功能性修饰的特性,偶联QD形成量子点分子探针(W3-QDs),结果显示,W3-QDs对肿瘤细胞的成像效果明显强于荧光基团探针(FAM-W3),具有更强的荧光信号,说明利用W3-QDs进行靶向成像时具有更高的灵敏度。当W3-QDs对乳腺癌组织进行成像分析时发现,W3-QDs靶向不同时期的乳腺癌组织时荧光信号强度分级明显,还可以区分乳腺癌患者的阳性淋巴结和阴性淋巴结。
综上所述,以核酸适配体W3偶联量子点制备量子点探针W3-QDs,实现乳腺癌细胞系和临床乳腺癌组织的靶向成像,有可能为乳腺癌的早期诊断提供新的分子工具。
