水合氧化锆吸附剂在电池级硫酸锰溶液中除氟研究
2023-01-18胡慧萍董和大彭奇凡
胡慧萍,董和大,彭奇凡
(1.中南大学 化学化工学院,湖南 长沙,410083;2.长沙华迪水处理技术有限公司,湖南 长沙,410083)
随着煤、石油等天然资源的日益枯竭,以锂离子电池为代表的新兴能源逐渐占据能源市场主导地位[1-2]。电池级硫酸锰是用于制备锂离子电池正极材料如镍钴锰三元材料、锰酸锂材料的重要合成盐。因此,硫酸锰的纯度是决定锂电池性能的关键因素之一。
目前,我国硫酸锰主要是通过将菱锰矿用硫酸浸取而得[3],获得硫酸锰的同时引入了大量的钙镁离子。为除去钙、镁杂质,在工业生产中常采用加入过量MnF2的方式,使钙、镁离子形成难溶性CaF2和MgF2沉淀而除去。然而,过量MnF2的使用会引起MnSO4·H2O产品中氟含量过高的问题。研究表明,氟浓度过高不仅会腐蚀设备,还会降低锰酸锂电池的电池容量与充放电效率[4],故需将氟含量控制在较低水平。目前,我国针对电池级硫酸锰产品中氟含量上限尚未做出具体要求,类比同样可用作合成锂离子电池正极材料的高纯碳酸锂,参照YS/T 546—2008 对高纯碳酸锂的要求标准,纯度99.99%的Li2CO3中氟质量分数应小于5×10-5,电池级MnSO4·H2O 产品中氟质量分数也应以低于5×10-5为宜。以质量分数为20%的硫酸锰溶液结晶获得电池级MnSO4·H2O固体产品为例,结晶过程相当于将氟浓缩了约5倍,为避免结晶过程中氟析出而使产品中氟含量大于5×10-5,应控制结晶前硫酸锰溶液中氟质量浓度低于10 mg/L。
已有的除氟研究主要是围绕处理含氟废水开展的,针对硫酸锰溶液中氟的去除鲜有报道。应用于含氟废水的除氟方法主要有混凝法[5]、离子交换法[6]、化学沉淀法[7]、膜工艺法[8]等。混凝法虽然操作简单,但需加入大量混凝剂,引起溶液pH下降,需重新加碱调高pH 才能使混凝剂沉淀完全,而且该法产泥量大,污泥中会夹带大量锰,导致锰损失过大,不适用于深度除氟。离子交换法和膜工艺法除氟效果好,但成本过高。吸附法可较好地适用于电池级硫酸锰溶液中除氟,因其在控制除氟过程中不引入新杂质,可减少锰损失。用于电池级硫酸锰溶液除氟的吸附剂应具有吸附容量大、酸性条件下不溶解、合成简单的特点。有学者采用硫酸铝改性活性氧化铝作为吸附剂脱除硫酸锰溶液中氟化物[9],吸附容量为1.96 mg/g,吸附容量偏低,在酸性硫酸锰溶液中,铝可能会溶出而引进新杂质。
本文采用沉淀法制备水合氧化锆吸附剂,以起始pH、吸附剂添加量、吸附时间、起始氟质量浓度、温度为参数研究不同条件下吸附剂对硫酸锰溶液中氟的吸附效果的影响,考察除氟后锰损失与溶液中锆残留情况,并结合SEM,FT-IR 和XPS等表征技术就吸附机理进行分析。
1 实验
1.1 主要试剂与仪器
氧氯化锆(ZrOCl2·8H2O,分析纯,上海麦克林生化试剂有限公司);氟化钠(NaF,优级纯,国药集团化学试剂有限公司);硫酸锰(MnSO4·H2O,分析纯,国药集团化学试剂有限公司);其他试剂均为分析纯,实验用水为去离子水。实验过程中使用的模拟含氟硫酸锰溶液由硫酸锰与氟化钠混合溶解配制而成。
水浴恒温振荡器(THZ-82型,江苏金坛市中大仪器厂);pH计(FE-20型,梅特勒-托利多仪器(上海)有限公司);离子计(PXSJ-216F型,仪电科学仪器股份有限公司,配PF-2-01 型氟离子选择性电极);电热恒温鼓风干燥箱(DHG-9076A 型,上海精宏实验设备有限公司);电感耦合等离子发射光谱仪(ICP,PerkinElmer Avio 500 型,德国珀金埃尔默股份有限公司)。
1.2 水合氧化锆吸附剂合成
水合氧化锆吸附剂在DOU 等[10]的基础上加以改进:称取32.225 g ZrOCl2·8H2O溶于0.2 mol/L盐酸中,加入25 mL 乙二醇,超声分散10 min 后定容至500 mL。向上述锆盐溶液以900 r/min 的速度逐滴滴加4 mol/L 氨水至pH=7,继续搅拌2 h,60 ℃静置陈化24 h 后抽滤,再用去离子水、乙醇交替洗涤滤饼,最后将滤饼置于60 ℃恒温干燥箱干燥24 h,研细备用。
1.3 吸附性能测试
1.3.1 起始pH影响
称取0.1 g 水合氧化锆加入锰质量浓度为90.39 g/L、氟质量浓度为50 mg/L 的50 mL 硫酸锰溶液中,用稀硫酸和MnCO3将溶液pH 分别调至3.5,4.0,4.5,5.0和5.5,20 ℃恒温振荡吸附8 h,再将其过滤,测定滤液中氟质量浓度。
1.3.2 吸附剂用量影响
分 别 称 取0.02,0.04,0.10,0.16,0.24 和0.32 g水合氧化锆加入锰质量浓度为90.39 g/L、氟质量浓度为50 mg/L的50 mL硫酸锰溶液中,用稀硫酸和MnCO3将溶液pH 分别调至4.0,20 ℃恒温振荡吸附8 h,过滤后测定滤液中氟质量浓度。
1.3.3 吸附动力学实验
取0.1 g水合氧化锆加入锰质量浓度为90.39 g/L、氟质量浓度50 mg/L的50 mL硫酸锰溶液中,20 ℃恒温振荡2 min后过滤。其他条件不变,只改变振荡时间,测定不同吸附时间下滤液中氟质量浓度。
1.3.4 吸附等温实验
设置模拟含氟硫酸锰溶液起始氟质量浓度分别为20,50,100,140,200,250 和350 mg/L,用稀硫酸和MnCO3将溶液pH 均调至4.0,分别在5,20 和35 ℃下恒温振荡吸附8 h,过滤后测定滤液残留的氟质量浓度。
1.3.5 吸附剂表征
吸附剂吸附前后表面形貌采用扫描电子显微镜(SEM,JSM-7610Fplus 型,日本)检测;用傅里叶变换红外光谱(FT-IR,Nicolet 6700 型,美国)研究吸附剂官能团变化;元素结合能变化采用X 射线光电子能谱(XPS,Thermo Scientific K-Alpha型,美国)分析,使用Thermo Avantage软件对数据进行分析拟合。
1.3.6 检测方法
采用氟离子选择性电极法测试溶液中氟质量浓度,吸附剂的平衡吸附容量按下式计算:
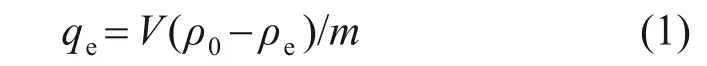
式中:ρ0为硫酸锰溶液中的起始氟质量浓度,mg/L;ρe为达到吸附平衡后溶液中的氟质量浓度,mg/L;qe为吸附剂平衡吸附容量,mg/g;V为待吸附溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 溶液起始pH的影响
溶液起始pH 对水合氧化锆吸附剂在硫酸锰溶液中的氟离子吸附效果的影响见图1。由图1可知:当起始pH为3.5~5.5时,吸附剂对氟离子均有吸附效果。当起始pH 为4.0 时,吸附剂对氟离子有最佳吸附效果,此时溶液中氟质量浓度由50.00 mg/L降至8.54 mg/L,吸附剂的平衡吸附容量为20.73 mg/g。当起始pH 降至3.5 时,溶液残留氟质量浓度升高至11.84 mg/L。当pH 大于4.0 时,pH越高,溶液中残留氟质量浓度越高,吸附效果持续降低,当pH 为5.5 时,吸附剂的平衡吸附容量下降至15.04 mg/g。
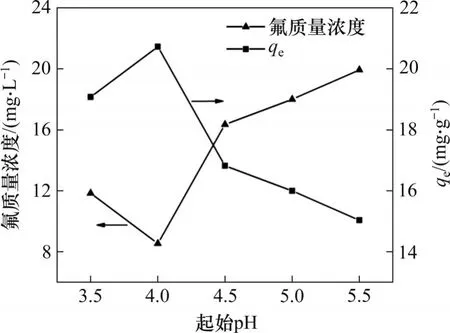
图1 起始pH对吸附效果的影响Fig.1 Effect of initial pH on adsorption efficiency
当溶液pH 由4.0 降至3.5 时,氢离子浓度增大,氟离子与氢离子易结合形成HF,使吸附效果下降。当pH>4时,随pH升高,OH-浓度增大,由于OH-与F-在离子半径及电负性上具有相似性,OH-也会占据吸附活性位点[11],OH-与F-产生竞争吸附导致吸附效果下降。
2.2 吸附剂用量影响
为探究吸附剂的合理用量,在最少量的吸附剂使用条件下确保溶液中残留氟质量浓度小于10 mg/L,研究吸附剂用量对吸附效果的影响,结果见图2。由图2 可知:当水合氧化锆吸附剂用量从0.5 g/L 增至2.0 g/L 时,溶液中氟质量浓度迅速由34.92 mg/L 降至8.54 mg/L,吸附剂的平衡吸附容量由34.92 mg/g 降至20.73 mg/g。继续增加吸附剂用量,氟质量浓度下降趋势逐渐趋于平缓,当吸附剂用量增至8 g/L 时,残留氟质量浓度降至2.92 mg/L,吸附剂吸附容量降至5.89 mg/g。从吸附剂用量经济因素考虑,确定水合氧化锆吸附剂用量为2 g/L。
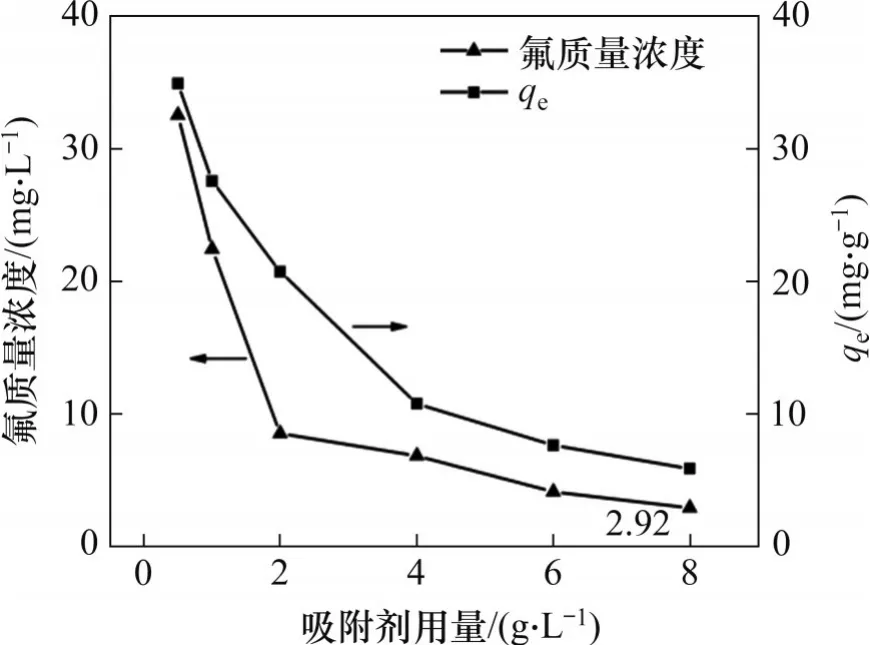
图2 吸附剂用量对吸附效果的影响Fig.2 Effect of dose of adsorbent on adsorption efficiency
2.3 吸附动力学
动力学参数是衡量吸附剂吸附性能的一个重要指标。为考察吸附时间对水合氧化锆吸附氟离子效果的影响,在pH=4.0,吸附剂用量为2 g/L,起始氟质量浓度为50 mg/L的条件下进行吸附动力学实验,结果见图3。
由图3 可知:在前3 h 内,吸附剂表现出对氟离子的快速吸附,这是因为吸附剂表面尚存在较多吸附活性位点,随吸附时间延长,活性位点逐渐被占据,表现为从3~5 h内吸附速率呈现下降趋势,当吸附8 h时,体系达到吸附平衡,此时吸附剂的平衡吸附容量为20.73 mg/g,溶液中氟质量浓度下降至8.54 mg/L。进一步延长吸附时间,溶液中氟质量浓度基本保持不变。
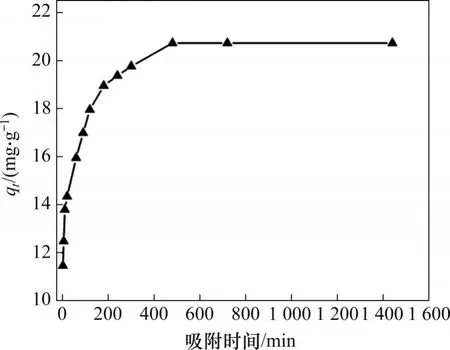
图3 吸附时间对吸附效果的影响Fig.3 Effect of adsorption time on adsorption efficiency
为进一步描述硫酸锰溶液中的氟离子在水合氧化锆吸附剂上的吸附过程,分别采用拟一级动力学模型和拟二级动力学模型对实验结果进行拟合,2种模型的线性表达式分别为:

式中:k1和k2分别为拟一级动力学模型和拟二级动力学模型的吸附速率常数;t为吸附时间;qt为t时刻时吸附剂的吸附容量。动力学模型拟合结果见表1。
由表1 可见:拟二级动力学模型拟合度R2>0.99,比拟一级动力学模型的拟合度高,且由拟二级动力学模型拟合计算出吸附剂吸附容量为20.73 mg/g,与实验值保持一致,进一步证明了硫酸锰溶液中的氟离子在水合氧化锆上吸附可用拟二级动力学模型描述。拟二级动力学模型认为吸附速率由被吸附物质与吸附剂之间发生的化学反应决定,以此推测,硫酸锰溶液中氟离子在水合氧化锆上的吸附可能主要属于化学吸附,氟离子与吸附剂之间可能形成了新的化学键[12]。

表1 动力学模型拟合参数Table 1 Dynamic model fitting parameters
2.4 吸附等温线
吸附等温线模型参数是评价吸附材料性能的另一重要指标。为同时考察温度对吸附效果的影响,在pH=4.0,吸附剂用量为2 g/L,吸附时间为8 h的条件下,考察5,20和35 ℃温度下的吸附等温线,结果见图4。

图4 不同温度下吸附等温线Fig.4 Adsorption isotherms with different temperatures
由图4可知:水合氧化锆吸附剂吸附容量随氟平衡质量浓度升高而增大;在35 ℃下,起始氟质量浓度350 mg/L,水合氧化锆对氟离子的平衡吸附容量达到60.74 mg/L,这说明水合氧化锆在高氟质量浓度下能达到较大吸附容量,即水合氧化锆吸附剂同样适用于吸附高氟硫酸锰溶液中氟离子;水合氧化锆的平衡吸附容量明显比硫酸铝改性活性氧化铝[9]的平衡吸附容量(1.96 mg/g)高。此外,温度升高有利于氟离子在水合氧化锆上的吸附,水合氧化锆的吸附容量增大。
采用Langmuir 和Freundlich 这2 种吸附等温模型对实验数据进行拟合,2 种模型线性表达式分别为:

式中:KL和KF分别为Langmuir 吸附平衡常数和Freundlich吸附经验常数;qm为Langmuir吸附等温模型理论最大平衡吸附容量;n为与温度有关的常数。
不同温度下2 种模型拟合结果见表2。由表2可知:Freundlich 吸附等温模型能较好地描述氟的吸附过程,氟在水合氧化锆上的吸附更倾向于多层吸附[10]。3个温度下水合氧化锆对氟均显示良好的吸附性能,1/n均在0.5左右,说明吸附较容易进行[13],吸附剂在室温范围内都能实际应用。随温度升高,Langmuir 吸附等温模型拟合的qm和KL均变大,升温有利于吸附,35 ℃时,水合氧化锆对硫酸锰溶液中氟离子理论最大平衡吸附容量达77.64 mg/g。

表2 Langmuir和Freundlich吸附等温模型拟合参数Table 2 Fitting parameters of Langmuir and Freundlich adsorption isotherm model
2.5 吸附机理研究
图5所示为水合氧化锆吸附前后的SEM照片,吸附前后水合氧化锆均呈不规则颗粒状,吸附后吸附剂表面形貌并未发生明显变化。水合氧化锆吸附前后的FT-IR 图如图6 所示。由图6 可见:在3 419 cm-1和1 615 cm-1的峰分别归属吸附剂表面吸附水的—OH 拉伸及弯曲振动吸收峰[14-15]。1 540 cm-1与1 358 cm-1峰归属于Zr—OH弯曲振动吸收峰[16],在吸附氟后,这2 个峰峰强度明显减弱,表明吸附剂中上的羟基参与了吸附过程。在1 409 cm-1出现了新峰,可能是由于形成了Zr—F键[17]。此外,吸附后在1 132,1 063 和991 cm-1出现的峰属SO42-特征峰[18],表明吸附剂对溶液中硫酸根存在一定吸附作用。

图5 水合氧化锆吸附前后SEM照片Fig.5 SEM images of hydrous zirconium oxide before and after adsorption
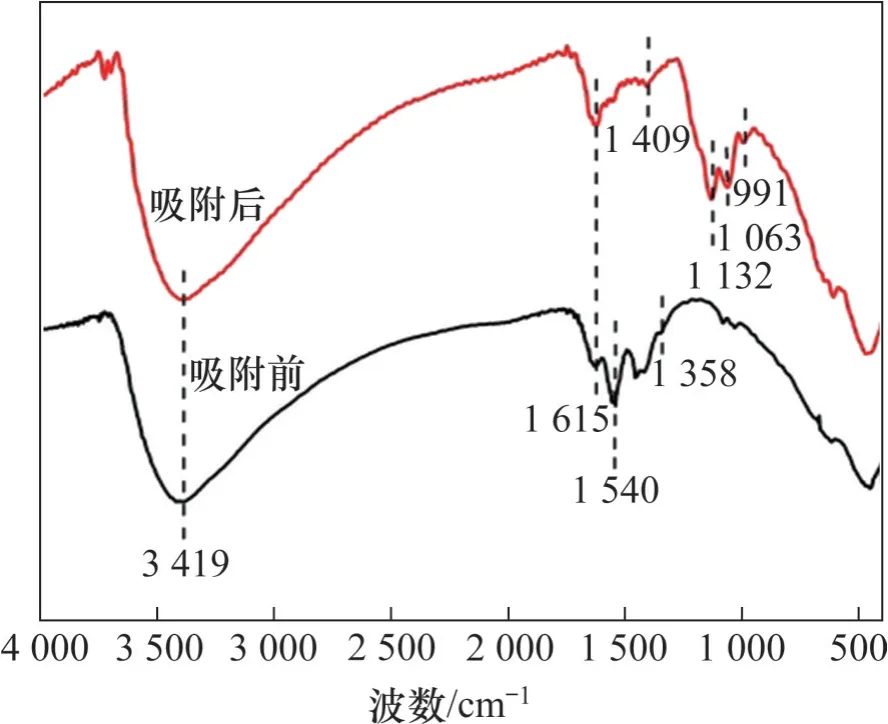
图6 水合氧化锆吸附前后FT-IR图Fig.6 FT-IR images of hydrous zirconium oxide before and after adsorption
图7 所示为水合氧化锆吸附前后XPS 全谱图,由图7可知:吸附后出现了F 1s新峰,证明溶液中氟离子成功吸附在水合氧化锆上。氟的能谱图如图8所示。由图8可见:F 1s峰位置位于684.91 eV处,介于NaF 的684.5 eV 与ZrF4的685.3 eV 之间,说明锆与氟之间形成了化学键[19]。吸附前后吸附剂各原子数百分数见表3,由表3 可知:吸附氟离子后,吸附剂上夹带的锰原子数仅占吸附剂总原子数的0.38%,这说明水合氧化锆除氟后锰损失极低,这是由于水合氧化锆吸附剂吸附容量大,用量少,从而减少了锰的夹带[20]。ICP检测吸附后硫酸锰溶液中锆残留仅为0.006 mg/L,水合氧化锆在除氟过程中基本不溶出。可见,水合氧化锆具有除氟效率高、锰损失少、不引入杂质的优点,适合用于电池级硫酸锰溶液中除氟。

图7 水合氧化锆吸附前后XPS全谱图Fig.7 XPS survey spectra of hydrous zirconium oxide before and after adsorption

图8 水合氧化锆吸附后F 1s能谱图Fig.8 F 1s spectra of hydrous zirconium oxide after adsorption

表3 吸附剂吸附前后各原子数百分数Table 3 Atomic quantity percentage of adsorbent before and after adsorption %
吸附前后Zr能谱图如图9所示,由图9可以看出:吸附前,Zr 3d3/2和Zr 3d5/2峰分别位于184.35 eV和182.03 eV 处,吸附氟离子后,Zr 3d3/2和Zr 3d5/2峰位置向高结合能方向移动,移至184.82 eV 和182.44 eV,分别增加了0.47 eV和0.41 eV,这证实了吸附剂上羟基被氟取代形成了Zr—F键,这是由于锆与氟成键引起锆电子密度下降,进而提高了Zr 3d3/2和Zr 3d5/2的结合能[21-22]。O 1s 能谱图如图10 所示。由图10 可见:吸附前分为3 个峰,分别在533.07,531.42 和530.12 eV 处,依次归属于吸附剂表面吸附水(H2O)、吸附剂表面羟基(Zr—OH)、金属氧化物(Zr—O),吸附氟离子后,Zr—OH 的峰面积占比由吸附前的57.75% 下降至36.71%,说明吸附剂中的羟基参与了吸附过程;吸附后出现在532.30 eV 处的新峰归属于S—O 键的特征峰[23]。结合FT-IR谱图分析可知,氟离子通过与水合氧化锆中的羟基发生离子交换而去除。
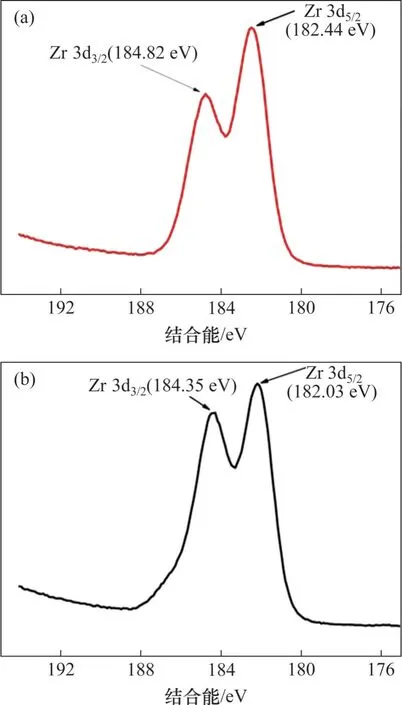
图9 水合氧化锆吸附前后Zr 3d能谱图Fig.9 Zr 3d spectra of hydrous zirconium oxide before and after adsorption
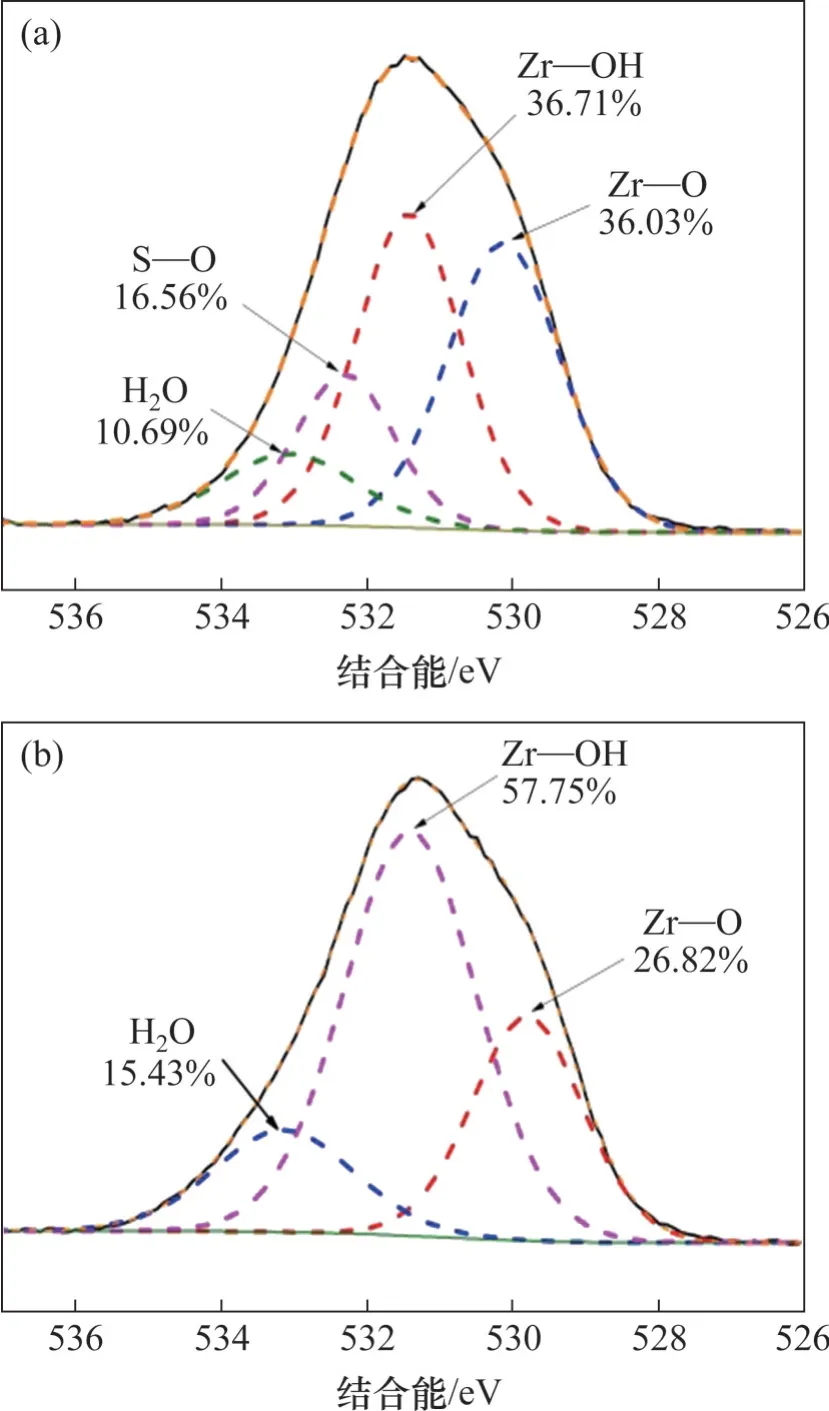
图10 水合氧化锆吸附前后O 1s能谱图Fig.10 O 1s spectra of hydrous zirconium oxide before and after adsorption
3 结论
1) 在pH 为4.0、吸附剂用量为2 g/L、吸附温度为20 ℃、吸附时间为8 h的条件下,硫酸锰溶液中氟质量浓度可由50 mg/L降至8.54 mg/L。
2) 硫酸锰溶液中氟离子在水合氧化锆上吸附符合拟二级动力学模型和Freundlich 吸附等温模型,升温有利于吸附,35 ℃下水合氧化锆对氟离子理论最大平衡吸附容量达77.64 mg/g。
3) 氟离子通过与吸附剂中的羟基发生离子交换而被去除。
4) 水合氧化锆除氟后溶液中的锆残留量与锰损失均极低,不引进新杂质,可保证产品纯度达到电池级硫酸锰要求,水合氧化锆适用于电池级硫酸锰溶液中氟的去除。
