乳腺多形性腺瘤临床病理分析并文献复习
2023-01-17周兵黄京刘浩茹黄传生
周兵,黄京,刘浩茹,黄传生
(1.九江市第一人民医院病理科,九江 332000;2.南昌医学院,南昌 330004;3.江西省肿瘤医院病理科,南昌 330006)
多形性腺瘤(Pleomorphic Adenoma,PA)也称为良性混合瘤,常发生于头面部如涎腺、喉、鼻窦、腭和鼻中隔,也可发生在皮肤,临床表现为慢性病程,渐进性生长[1]。自1978年由Sheth等首次发现1例原发于乳腺肌上皮的PA以来,后续国内外偶有个例报道[2]。本文现报道1例原发于乳腺的PA,并复习既往国内外文献报道9例临床及病理资料,并总结镜下形态及免疫组化表型,以期提高对该罕见病的认识水平。
1 材料与方法
1.1 临床资料 女性,53岁,因发现左乳肿物3 d入院。乳腺B超示:左乳实性低回声团,考虑纤维腺瘤可能。术中外下象限近乳晕处可见2.5 cm×2 cm灰白结节性肿物,表面光滑,与周围组织界线清,行肿物完整切除术。
1.2 方法 组织标本经中性福尔马林固定、石蜡包埋、4 μm厚度切片后,HE染色,倒置显微镜下进行组织形态学观察。免疫组化采用EnVision法,抗体SMA、P63、S-100、CK5/6、CD117、CK7、ER、PR、Cal-ponin、Her2、GCDFP-15和Ki67等均购自福州迈新公司,同时设立阴、阳对照,熟练技师按试剂说明标准化操作。
2 结果
2.1 眼观 送检灰白结节状肿物1个,2.5 cm×2 cm×2 cm,表面光滑,似有包膜,切面灰白、灰红,实性,质稍韧,局部质稍硬,灶性区域呈微囊性,流少许灰褐色液体。
2.2 镜检 乳腺腺体及导管旁见肿瘤由上皮细胞及肌上皮细胞构成,界限清楚,有纤维包膜,呈结节性生长,见图1。其旁可见增生的乳腺腺体及纤维组织伴导管挤压呈裂隙状,见图2。肿瘤结构复杂,形态多样,见由圆形、卵圆形矮柱状或立方状内层腺上皮及外层肌上皮排列呈不规则的腺管状、微囊状结构,腔内富含嗜酸性分泌物,见图3。部分区域以短梭形肌上皮细胞为主,呈杂乱、片状排列,细胞形态一致,较为温和,胞质淡染、核仁不可见,背景见少许炎性及玻变的纤维间质,其旁可见大囊腔形成,内含多量红染液体,见图4。部分区域可见黏液性或软骨粘液性间质,间质内见多量的真性软骨成分,软骨结构呈多结节状,软骨细胞陷入其中,软骨周围分布腺管结构呈岛状、分叶状排列,见图5。本例未见明确的鳞状上皮分化、骨样分化和脂肪瘤样分化等特殊分化成分。
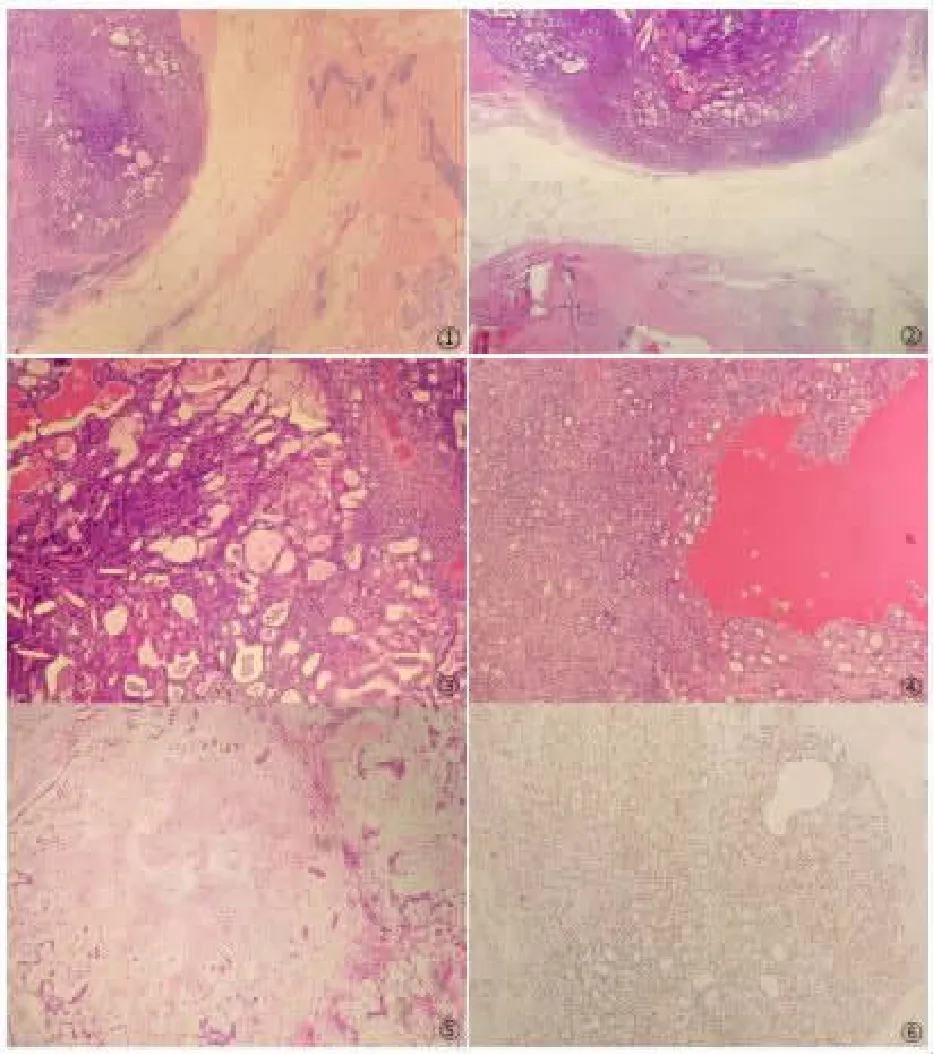
图1 乳腺腺体及导管旁见肿瘤形成(40)图2肿瘤旁合并纤维腺瘤(40)图3肿瘤由内层腺上皮及外层肌上皮构成腺腔样结构(100)图4单一的梭形肌上皮细胞呈索状、片状排列(100)图5间质呈黏液软骨样成分(100)图6瘤细胞P63呈弥漫阳性,EnVision法(100)
2.3 免疫表型 腺上皮标记CD117、CK7和肌上皮标记SMA、P63,见图6、S-100、CK5/6呈弥漫阳性,激素受体ER、PR呈灶性阳性;Her2、GCDFP-15为阴性表达,Ki67增殖指数约2%。
2.4 治疗及随访 局麻下行左乳肿物完全切除术,随访27个月,患者健在,未见肿瘤复发及转移。
3 讨论
乳腺PA最常见于女性病例,但男性病例也有个别报道[9]。发病年龄跨度较大,患者年龄从19岁到85岁均有文献报道[8],但本例和近年已报告的8例病例中以中老年为主,欧美人多见,亚洲人较少,这可能与不同地区的人种和哺乳习惯的差异有关。发病部位文献报道多见于右乳,但本例和既往我国报道病例以左乳多见[10]。PA有发生在乳晕区的倾向,这可能表明它可能起源于乳腺大导管,本例发生于外下象限近乳晕处与此类似[12]。临床多以患者可触及性的实性结节性包块就诊,因其并不具有影像学的特征性改变,在B超和钼靶上很难与其它乳腺肿瘤区别开来,本例乳腺B超初始诊断为纤维腺瘤,最后通过组织病理学检查确诊,见表1。
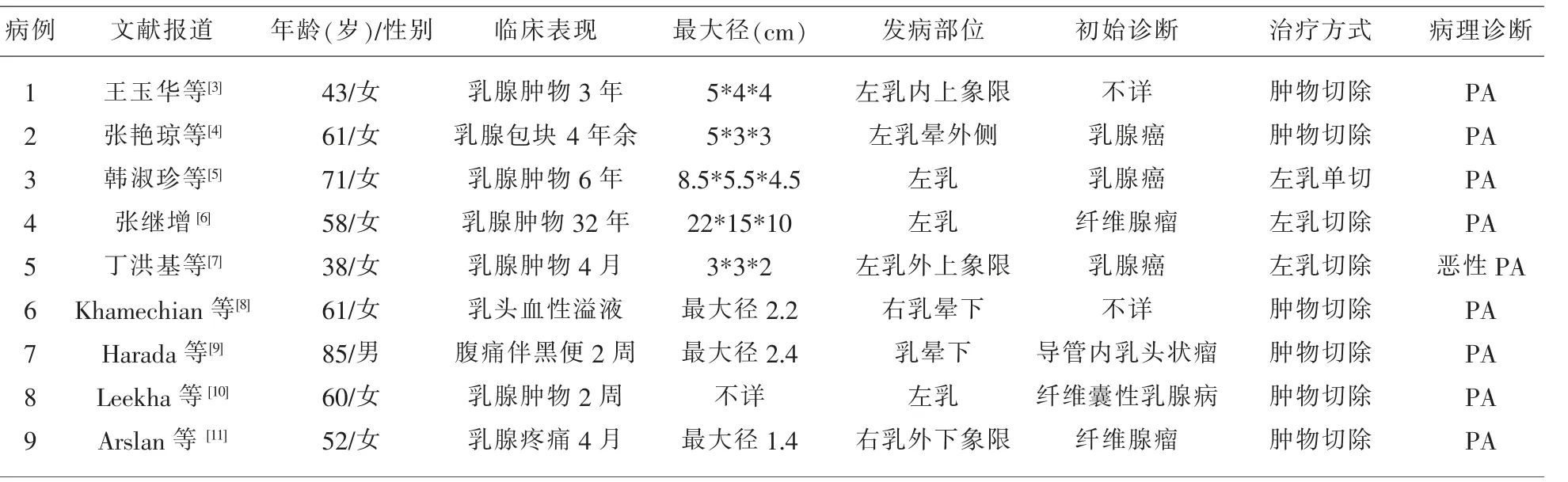
表1 文献报道乳腺PA临床病理特征
目前对于乳腺PA的起源存在着一定的争议,部分学者认为乳腺和唾液腺的胚胎发育存在着相似性,均存在双重的腺上皮和肌上皮细胞分化起源,而PA作为唾液腺最常见的良性肿瘤,同样也可以在乳腺上发生[13]。也有学者认为PA可能起源于乳腺导管内乳头状肿瘤,当其内的肌上皮细胞受到某些刺激时,可以发生多向潜能分化,这也可以解释PA间质内可以出现黏液软骨样化生和其它类型的化生,同时,部分乳腺PA病例中也可以存在导管内乳头状瘤的区域进一步证实了该观点[14]。也有学者认为PA与导管腺瘤或结节性腺肌上皮瘤存在关联性,因其上皮成分和组织结构与两者存在一定的关联性[15]。随着分子生物学的发展,越来越多的基因调控和蛋白表达被证实与PA的发生有关。一项国外的体外细胞学研究发现,当HRAS基因Q61R位点发生突变后,可以使乳腺上皮细胞增殖活性增加和发生肌上皮细胞分化,而肌上皮的分化被认为是发生PA的重要因素[16]。同时,多形性腺瘤基因1(PLAG1)和高迁移率族蛋白A2(HMGA2)的高表达被认为与乳腺PA的发生关系密切,能诱导乳腺干细胞的双相上皮分化模式[17]。
乳腺PA的诊断多不太复杂,形态学与其它部位发生的PA结构类似。镜下肿瘤边界清楚,呈结节状生长,组织结构具有明显的多形性特点。实质由大量圆形腺上皮细胞排列成腺管状和短梭形肌上皮细胞排列成片状共同构成,腺、肌上皮细胞形态温和,不具有异型性。间质由大量黏液样软骨基质和骨化生区构成,实质与间质界限不清,混杂分布。免疫组化多表达腺上皮标记CD117、CK7、CK8/18和 肌 上 皮 标 记SMA、P63、S-100、CK5/6、Calponin、GFAP;免疫标记不表达Her2和GCDFP-15被认为在诊断乳腺PA具有特征性,但ER、PR的表达还存在一定的争议,研究认为该部位表达于PA腺上皮细胞,本例免疫组化结果与此类似[18]。依据PA肿瘤细胞组织结构的不同,我们需要与乳腺其它肿瘤进行鉴别。(1)腺肌上皮瘤:腺上皮和肌上皮组成的小叶型、梭形细胞型结构伴间质的黏液样变性时与PA形态类似,但前者大体边界常不清,无纤维性被膜包饶,且间质不存在明显的的软骨和骨化性区域。(2)硬化性导管乳头状肿瘤:当导管内乳头状瘤间质发生黏液样变性和软骨样化生时与PA形态类似,但前者不具有组织学的多形性,且整体以纤维血管为轴心的乳头状生长方式,同时外层腺上皮和内层肌上皮腺管结构与PA排列方式相反。(3)腺样囊性癌:复杂多样的组织学形态和腺腔样的生长方式,同时腔内富含嗜酸性分泌物均与PA形态类似,但前者边界不清、细胞异型性明显,且肿瘤细胞伴有明显的嗜神经现象。(4)化生性癌:明显的黏液样软骨基质和骨化生区与PA的典型形态学一致,但前者边界不清,细胞异型明显,核分裂易见,可见明显的坏死区,且黏液样软骨基质一般不混杂排列,常出现忽然的移行。
乳腺PA首选治疗方法为手术切除,虽然肿瘤性质为良性,但因肿瘤富含的黏液成分的外溢和肿瘤细胞包膜外的延伸性,不充分的切除会导致肿瘤的复发,手术切除范围建议大于肿瘤边缘3mm,当不能确定达到完全性切除时,补充放疗被认为可以有效防止复发[19]。PA恶变也有个别文献报道[20],特别发生在反复复发的病例,但尚未见到发生转移的文献报道,本例随访27个月,未出现复发、恶变或转移。
