胰蛋白酶和胶原酶灌注法分离提取小鼠原代肝细胞的比较
2023-01-17任文洁林哲绚
任文洁,林哲绚
(汕头大学医学院生物分析实验室,广东 汕头 515041)
肝脏是哺乳动物体内重要的代谢和解毒器官,参与机体多种生理病理过程[1]。原代肝细胞的培养可用于探索肝脏在物质代谢中的作用,阐明各种肝脏疾病的发病机制,对研发新药物也至关重要。因此获得高活性和形态完整的原代肝细胞是进行肝脏体外研究的基础。原代肝细胞的分离提取方法有直接剪切法、组织块培养法、胰蛋白酶(胰酶)离体消化法、Seglen灌注法、半原位胶原酶灌注法等[2]。但剪切法,组织块培养法和胰酶离体消化法所分离得到的肝细胞,存活率不高,机械损伤大,而且酶消化条件不易控制。Seglen灌注法及半原位胶原酶灌注法分离得到的肝细胞存活率高且数量多,但其操作技巧性较高且需要特殊设备(如精密型蠕动泵),限制了该方法的广泛应用。本研究在灌注法的基础上进行改良,建立一种简单易行,低成本的小鼠原代肝细胞分离方法,并对比胰酶和胶原酶灌注法分离提取的小鼠原代肝细胞。
1 材料与方法
1.1 动物
SPF级C57BL/6J小鼠,雄性,10~16周,体重20~25 g,购自湖南斯莱克景达实验动物有限公司。常规喂养,温度18~22℃,湿度50%~60%,12 h白天黑夜循环。本研究经汕头大学医学院实验动物伦理委员会审核批准。
1.2 主要试剂和仪器
HEPES(上海阿拉丁生化科技股份有限公司);胰蛋白酶(BBI生命科学有限公司);胶原酶D、DNA酶Ⅰ(德国默克集团);蛋白酶、地塞米松(美国Sigma公司);胰岛素(上海麦克林生化科技有限公司);胎牛血清(美国赛默飞世尔科技公司);青链霉素、Percoll细胞分离液、糖原PAS染色试剂盒(北京索莱宝科技有限公司);DMEM高糖培养基(美国Hyclone公司);台盼蓝、Alexa Fluor 488标记山羊抗兔IgG(H+L)、荧光染料Hoechst 33258(上海碧云天生物技术有限公司);山羊抗兔角蛋白-18抗体(武汉三鹰生物技术有限公司)。卡默尔微型蠕动泵(上海卡川尔流体科技有限公司);细胞培养箱(美国Thermo公司);Imager A1相差倒置荧光显微镜、Imager A2正置荧光显微镜(德国蔡司公司)。
1.3 溶液配制
胰酶灌注液Ⅰ:EDTA 0.5 mmol/L,HEPES 25 mmol/L,D-Hanks液20 mL。胰酶灌注液Ⅱ:胰酶0.125%,HEPES 15 mmol/L,D-Hanks液10 mL。 胶 原 酶 灌 注 液 Ⅰ :EDTA 0.5 mmol/L,D-Hanks液10 mL。胶原酶灌注液Ⅱ:蛋白酶E 3.2 mg,Hanks 8 mL。胶原酶灌注液Ⅲ:胶原酶D 4.8 mg,Hanks液12.5 mL。清 洗 液:DNA酶Ⅰ0.02 mg/mL,格氏平衡盐溶液50 mL。纯化液:50% Precoll细胞分离液。鼠尾胶原Ⅰ:鼠尾13 μL,0.02 mol/L冰醋酸10 μL,无菌水1 mL。完全培养基:胰岛素0.5 μg/mL,地塞米松100 nmol/L,青链霉素1%,胎牛血清10%,DMEM高糖培养基200 mL。
1.4 方法
1.4.1 胰酶两步灌注法(1)准备:灌注液以及DMEM高糖培养基于42℃水浴锅中预温30 min[3],准备好动物实验台以及手术器械,并在无菌操作台上照射紫外线30 min。蠕动泵管道以胰酶灌注液Ⅰ循环运行,防止气泡产生。(2)灌注:CO2窒息法处死小鼠并将其泡在酒精内10~20 s。转移至无菌操作台。解剖小鼠,暴露腹腔以及整个胸腔。结扎下腔静脉肝上段,从下腔静脉水平进针。开启灌注,并在门静脉处剪一个小口。灌注流速3 mL/min;消耗胰酶灌注液Ⅰ15 mL,流出液体澄清,即停止灌注。将泵管转移至胰酶灌注液Ⅱ中,继续灌注,消耗胰酶灌注液Ⅱ10 mL。肝脏逐渐肿胀,并用玻璃分针轻按肝脏,凹陷且回弹速度慢,即可。(3)分离:用镊子夹住连接各个肝叶的纤维束聚集部位,顺着结缔组织剪切,将肝脏浸入含3 mL 10%胎牛血清的玻璃皿中以终止灌注,再加入10 mL清洗液。轻轻剥离肝叶包膜,再用镊子夹住纤维束,摇动以分散残留的细胞。将细胞悬液过滤,即得到肝细胞悬液。(4)纯化:将已过滤的肝细胞悬液转移至50 mL离心管中,低温低速离心(4℃,50×g,3 min)。弃上清,加入15 mL清洗液并进行3次轻吹打,重复离心3次。弃上清,加入10 mL完全培养基重悬细胞,并缓慢加入到10 mL的纯化液中,离心(4℃,400×g,10 min),弃上层,剩下的细胞沉淀即为肝实质细胞,加入5 mL完全培养基重悬细胞。
1.4.2 胶原酶灌注法与胰酶两步灌注法相同,灌注液不同。灌注:灌注流速3 mL/min,待胶原酶灌注液Ⅰ消耗9 mL时,停泵。更换至胶原酶灌注液Ⅱ中,继续灌注,消耗8 mL(或15 mL)。停泵,更换至胶原酶灌注液Ⅲ中,消耗11 mL(或21 mL)。若需要更多的细胞数量,可增加灌注体积及时间[3]。分离:将分离的肝脏放入装有胶原酶灌注液Ⅲ的离心管中,密封并放入42℃预温5 min。将肝脏浸入含10%胎牛血清培养基的培养皿中进行撕肝,经200目滤网过滤,滤液即为肝细胞悬液。
1.4.3 细胞计数及台盼蓝染色细胞悬液稀释10倍后,与台盼蓝以9∶1(体积比)混匀,显微镜下进行细胞计数。细胞折射率较强的圆形细胞为肝实质细胞,被染为蓝色的细胞为死细胞。计算细胞存活率(活细胞数/细胞总数×100%)。
1.4.4 肝细胞形态学观察分离的肝细胞接种于鼠尾胶原Ⅰ预处理的含完全培养基的培养板,于37℃、5%CO2、湿度95%的培养箱中培养。24 h后更换培养基。分别于分离6 h、12 h、24 h、48 h,3 d,7 d后在倒置显微镜下观察并拍照。
1.4.5 肝细胞的鉴定通过糖原PAS染色法[4]及CK-18免疫荧光细胞化学染色[5]鉴定肝细胞。PAS染色法简要步骤如下。将纯化后的原代肝细胞爬片,高碘酸避光氧化,再经希夫试剂室温避光染色,苏木素复染,自来水冲洗,晾干,镜检拍照。CK-18免疫荧光细胞化学染色简要步骤如下。细胞爬片培养24~48 h后,弃上清,4%多聚甲醛室温固定。PBS冲洗3次,0.2%Triton X-100渗透。PBS洗3次,1%BSA封闭30 min。山羊抗兔CK-18抗体4℃孵育过夜,Alexa Fluor 488标记山 羊 抗 兔IgG(H+L) 抗 体37℃ 孵 育1 h。Hoechst 33258(5 μg/mL)室温孵育10 min,60%缓冲甘油封片,荧光显微镜观察拍照。对照组用PBS替代一抗。
1.4.6 细胞活性的检测采用MTT法检测细胞活性。将新鲜提取的小鼠原代肝细胞以5×103/孔接种于96孔板中,分别于接种6 h、12 h、24 h、48 h、3 d、7 d后进行MTT实验。弃掉培养基,加入含MTT(5 mg/mL)的DMEM高糖培养基110 μL(体积比为1∶10)培养4 h,弃培养基,加入150 μL二甲基亚砜避光震荡10 min,用酶标仪检测各孔吸光度值D(570 nm)。每组设6个复孔,实验独立重复3次。
1.5 统计学方法
应用SPSS 25.0统计软件进行分析,符合正态分布的计量资料以表示,组间比较用独立样本t检验;不同酶灌注法分离的肝细胞接种不同时间的细胞活性比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两种分离方法的提取过程比较
胰酶灌注法经过两步灌注后,肝脏土灰色并呈现肿胀状态,轻按肝叶回弹速度慢。在进行撕肝时,肝叶成块状,不易形成糜状。过滤前后,溶液浑浊程度低(图1A)。胶原酶灌注法经过三步灌注后,肝叶逐渐塌软,轻按肝叶回弹速度慢或基本不回弹。撕肝时肝叶呈糜状,溶液浑浊程度高(图1B)。经过低温低速离心3次并纯化后,两种方法均可获得肝实质细胞。
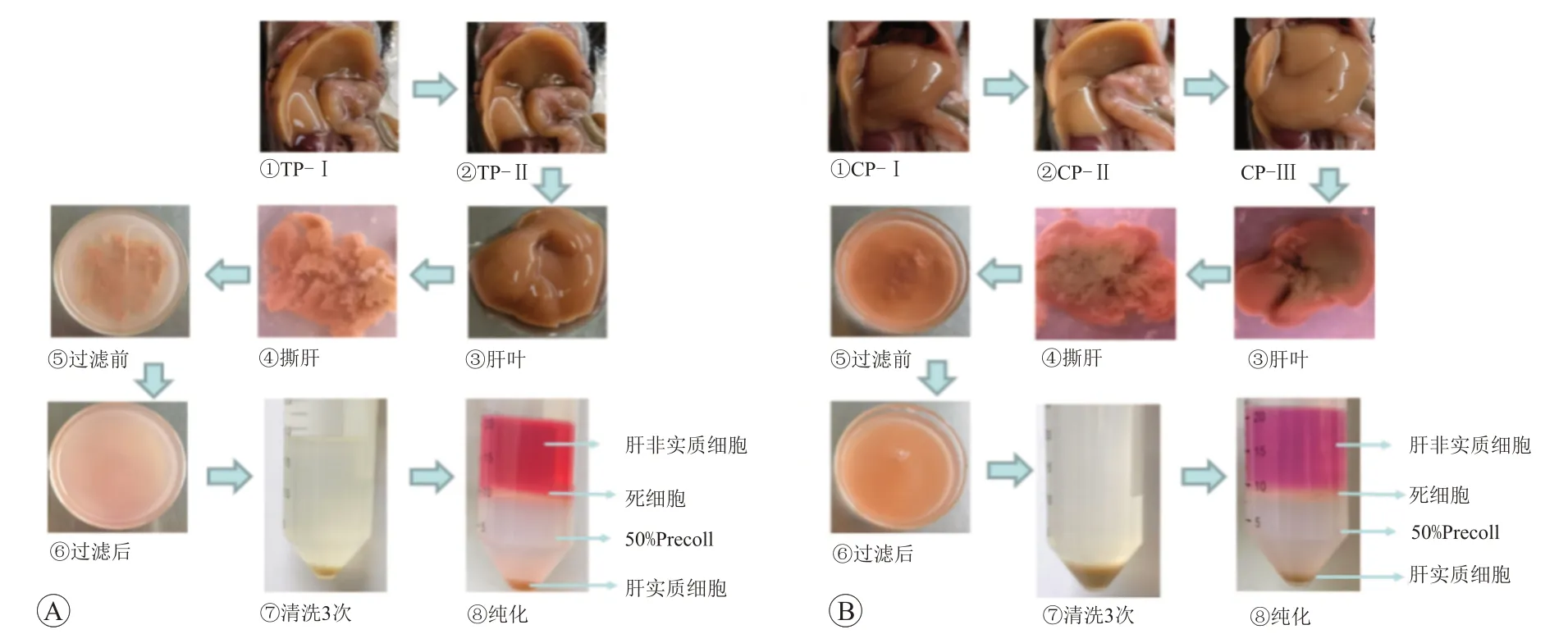
图1 不同酶灌注法分离提取肝细胞过程
2.2 细胞数量与存活率
与胰酶灌注法相比,胶原酶灌注法分离提取的肝细胞数量明显更多(P<0.05),见表1。肝细胞悬液经纯化后,两种方法分离所得细胞存活率均可达到90%以上。台盼蓝染色观察到刚分离的活细胞呈圆形或椭圆形,细胞体透亮、饱满,而被染为蓝色的为死细胞(图2)。
表1 两种灌注法分离所得肝细胞数量及存活率的比较(n=6,)

表1 两种灌注法分离所得肝细胞数量及存活率的比较(n=6,)
1)与胰酶灌注法比,P<0.05。
方法胰酶灌注法胶原酶灌注法细胞总数(个/10 μL)63.0±7.4 119.5±20.51)活细胞数(个/10 μL)58.5±7.0 109.0±16.9死细胞数(个/10 μL)4.0±2.5 10.5±6.7存活率/%93.0±2.0 93.0±5.0

图2 肝实质细胞的台盼蓝染色(×100)
2.3 肝细胞形态学观察
接种6 h后,肝细胞基本贴壁,呈铺路石状,细胞边界清晰,可见单核或双核。接种24 h后,肝细胞有向外延伸的趋势,胞体明显增大、平展并呈不规则多角形。培养3 d后,肝细胞形成条索状或岛状结构,相邻的细胞彼此连接更加紧密(图3)。细胞贴壁7 d后,细胞间融合成片,界限消失,未见明显细胞核。两种酶灌注法分离出的肝细胞在形态上无明显差异。
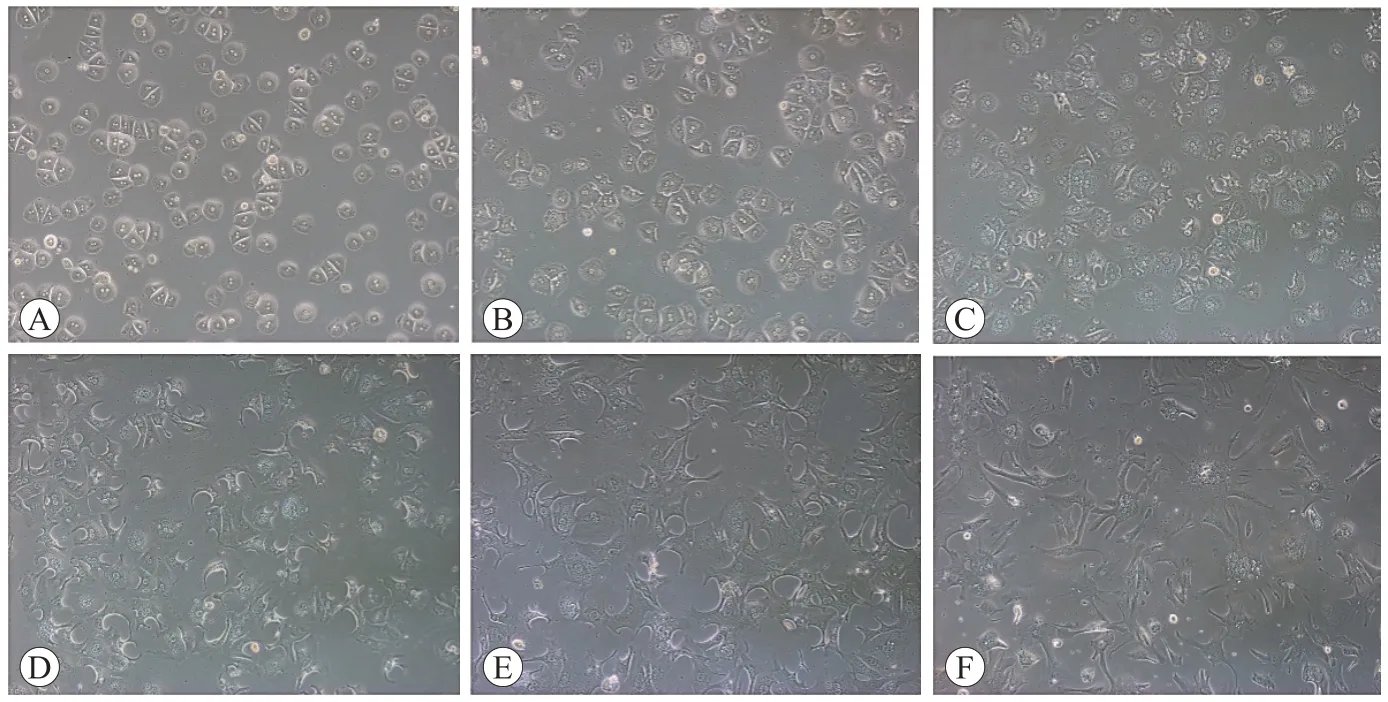
图3 原代肝细胞培养不同时间的形态图(×100)
2.4 肝细胞鉴定
肝细胞培养24 h经PAS染色后可见细胞胞质呈紫红色,并呈均质或颗粒状分布(图4)。免疫荧光染色结果表明,阳性细胞胞质可观察到绿色荧光(图5)。两种酶灌注法分离出的细胞经鉴定并计数,获取的原代肝细胞纯度均>90%。

图4 原代肝细胞的PAS染色(×200)

图5 原代肝细胞的抗CK-18免疫荧光染色(× 200)
2.5 不同培养时间的肝细胞活性
重复测量方差分析结果表明小鼠原代肝细胞培养48 h后,胶原酶灌注法分离的细胞吸光度值高于胰酶灌注法(F=5.501,P<0.001);不同酶灌注法分离提取的细胞在接种12 h时吸光度值达到最大值,并随接种时间的延长,细胞吸光度值逐渐下降(F=628.787,P<0.001);不同酶灌注法和接种时间之间存在交互效应,胰酶灌注法分离的细胞吸光度值下降幅度高于胶原酶灌注法(F=52.527,P<0.001),见图6。
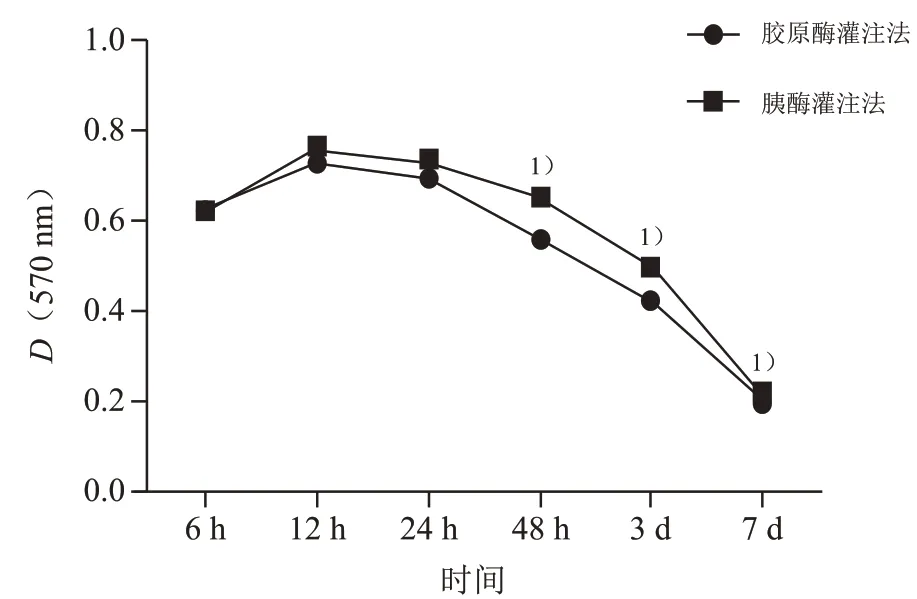
图6 原代肝细胞接种不同时间的细胞MTT显色吸光度值
3 讨论
原代肝细胞比永生化的肝细胞系更真实地反映肝细胞的生理反应,因而广泛地应用于肝脏毒理学、药理学、生理学等各方面的研究[6]。原代肝细胞的分离提取是肝细胞体外培养的关键步骤,获取高活性,高纯度以及形态完整的肝细胞是原代肝细胞分离提取的核心目标。国内外研究者建立了多种原代肝细胞分离培养的方法,但存在操作复杂、技术性高、实验条件高、成本高以及低活性,低产率等问题[7]。例如直接剪切法对细胞的机械损伤大,导致细胞存活率和获得率低;组织块培养法操作复杂,剪切以及剔除组织块时易造成污染,肝细胞爬出时间长且纯度不高;胰酶离体消化法的消化时间及用量不易控制,消化过度形成絮状组织块,不易剔除导致纯度不高,消化不充分导致获得率低;Seglen 灌注法操作技术高,流程多且繁琐,胶原酶成本高等。本研究根据实验室现有条件对经典两步灌注法进行改良,使用0.125%胰酶进行消化,得出最佳消化用量为10 mL,细胞获得率,活性及纯度高,且成本低。本研究根据文献[3],减少胶原酶用量,缩短灌注时间及操作流程,既可获得大量肝细胞,细胞纯度及存活率均满足体外原代肝细胞实验要求,也大大降低了成本。同时,本研究对胰酶和胶原酶灌注法分离提取小鼠原代肝细胞的形态、活性、纯度、细胞数量及存活率进行了比较。
胰蛋白酶是一种丝氨酸蛋白水解酶,作为肽链内切酶,可水解赖氨酸或精氨酸羧基端,从而可使细胞间的蛋白质水解,细胞离散。然而,胶原蛋白是细胞外基质的主要成分,因其稳定而保守的三螺旋结构,不易被普通蛋白酶降解。胶原蛋白酶D 是一种胶原蛋白水解酶,具有解离组织以释放单个细胞的作用,但价格较高。在本研究中,胰酶灌注法先用含EDTA 的D-Hanks 溶液灌注以去除血细胞和螯合肝细胞间的钙离子,破坏肝细胞间的桥粒连接;再用含胰酶的D-Hanks 溶液进行灌注,以利于肝细胞的分离,可获取肝细胞量为(3~7)×106/只。经反复试验得出最适胰酶浓度为0.125%,最适灌注体积为10 mL。胶原酶灌注法同样先以EDTA 灌注减少细胞间的黏附;其次链蛋白酶E 联合胶原酶灌注以充分消化肝组织。Hanks 溶液的Ca2+可激活胶原酶D,使用含胶原酶D 的Hanks 溶液灌注充分消化细胞间的连接以及纤维组织,获得肝细胞(2~8)×107/只。不管使用何种蛋白酶,在灌注过程中,均需控制灌注用量及时间,避免消化不充分或消化过度,从而保持高活性和高产率。
原代肝细胞的培养条件较高。在本研究中,将新鲜提取的肝细胞接种于Ⅰ型鼠尾胶原包被的培养皿(培养板),可促进肝细胞贴壁,避免细胞聚集成团生长。在高糖DMEM 培养基中加入10%胎牛血清和胰岛素,既满足细胞生长需求,又可增加肝细胞的贴壁率,促进核蛋白磷酸化以及铁的摄入[8]。原代肝细胞培养时,地塞米松可促进肝细胞线粒体再生,并提高肝细胞稳定性[9]。本研究中两种分离方法获得的肝细胞在相同培养条件下,培养不同时间的细胞形态变化基本一致;通过台盼蓝染色,糖原染色和抗CK-18 免疫荧光细胞化学染色鉴定,存活率及纯度均达到90%以上。显然,胶原酶的消化更有利于获得大量肝细胞,这与胶原酶作用机制有关,而胰酶灌注法虽得率较低,但仍可获得活性、纯度较高的原代肝细胞,因其成本更低,也不失为一种较好的替代方法。
综上所述,本研究建立了简单易行,低成本的酶灌注法,分离提取的肝细胞可在一定条件下保持稳定的活性,可应用于与肝细胞相关的多种体外实验研究。
