胡椒PnCAD基因的克隆和表达分析
2023-01-16孙也乔胡丽松伍宝朵郝朝运
孙也乔,王 珏,胡丽松,伍宝朵,郝朝运,5,范 睿,5*
胡椒基因的克隆和表达分析
孙也乔1,2,3,王 珏1,2,3,胡丽松2,3,伍宝朵2,4,郝朝运2,4,5,范 睿2,4,5*
1. 海南大学热带作物学院,海南海口 570228;2. 中国热带农业科学院香料饮料研究所,海南万宁 571533;3. 海南省遗传育种与种质资源重点实验室,海南万宁 571533;4. 海南省热带香辛饮料作物遗传改良与品质调控重点实验室,海南万宁 571533;5. 海南省Sim Soonliang院士工作站,海南万宁 571533
木质素在植物体中具有运输水分、支撑植株和加强植物体免受侵害等功能,是苯丙烷代谢途径的重要产物之一。其中肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)是该途径中重要的限速酶。本研究在胡椒转录组测序的基础上,用RACE法进行克隆,对基因全长进行生物信息学分析,并对其蛋白进行理化性质、亚细胞定位和系统进化树等分析;最后运用实时荧光定量PCR进行分析。结果表明:克隆得到基因的全长cDNA,长度为1364 bp,开放阅读框(open reading frame,ORF)为1071 bp,编码356个氨基酸,预测相对分子量为3.879 kDa,等电点为6.27,属于亲水性蛋白;含有3个N-糖基化特征序列和9个磷酸化位点,可能处于细胞质内。结构域分析发现,胡椒CAD蛋白含有NAD(P)结合位点、多个催化锌和结构锌结合位点。系统进化树分析表明,胡椒CAD与细辛CAD6亲缘关系最近,胡椒和细辛的同源性最高为76%,均隶属于比较原始的双子叶植物。通过荧光定量分析发现,黄花胡椒在辣椒疫霉菌侵染下表达量升高,在8 h达到最高值,约为对照的10倍;之后在24 h时出现小幅度升高,约为对照组的6倍,之后下降。‘热引1号’胡椒的表达量在侵染8 h时达到最低,之后缓慢上升。总体来说,所有时间下黄花胡椒基因表达量均高于‘热引1号’胡椒,且差异显著。本研究结果可为今后研究胡椒抗非生物胁迫功能提供参考,为基因的功能研究提供理论依据。
胡椒;;基因克隆;生物信息学分析;荧光定量PCR
胡椒(L.)是海南省重点支持和发展的热带特色农业产业之一,更是海南省农业经济收入的重要来源。此外,海南作为中国最大的胡椒生产区,占据全国胡椒生产总量的90%以上[1]。胡椒在医学领域和食品工业用途广泛[2]。胡椒具有4000多年历史,主要种植在热带和亚热带,全球种植面积达到60万hm2。中国是世界第五大胡椒生产国,截至目前中国胡椒种植面积约为2.6万hm2。现在的主栽品种‘热引1号’胡椒是由中国热带农业科学院香料饮料研究所选育并推广种植,面积占全国90%以上,但由于其极易感染胡椒瘟病,很大程度上限制了胡椒产业的良性发展[3]。
木质素在植物体中具有运输水分、支撑植株和加强植物体免受侵害等功能[4-7],其生物合成是在多种酶的参与下完成的,是苯丙烷代谢途径的重要产物之一[8]。木质素的生物合成过程可总结为苯丙氨酸或酪氨酸在一系列酶的催化下,逐步转化为木质素单体,最终聚合成木质素的过程[9]。肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase, CAD)是木质素合成过程中的重要限速酶,也是单体合成下游途径中的重要还原酶,对S型、G型和H型木质素的合成具有一定的作用[4, 10]。肉桂醇脱氢酶属于中链脱氢酶/还原酶家族,在NADPH的作用下可将肉桂醛还原为肉桂醇,是植物细胞壁单信号代谢途径的最后一步。前人通过正、反义表达和突变体实验研究表明,植物基因可调整木质素的总量及单体的比例[11]。隋娟娟等[12]对香椿叶片进行高温、低温、干旱、盐胁迫后,发现在非生物胁迫下基因表达量与叶片木质素含量呈显著正相关;与野生型相比,在拟南芥反义表达基因植株的木质素总量大大降低,并出现倒伏现象[13];张颖俊[14]研究发现干旱胁迫下油菜基因表达水平与茎秆和根系中的木质素含量均呈显著正相关;拟南芥和基因同时突变后,木质素含量下降94%[15]。可见,基因在木质素生物合成过程中发挥着重要调控功能。目前,国内外已对多种植物的基因成员进行鉴定,如陆地棉、亚麻、小麦、洋草麦和榅桲等[16-20],但关于胡椒基因的研究尚未全面开展。胡椒全基因组测序已完成,在此基础上,本研究中采用RACE方法从叶片上克隆得到1个基因,同时对该基因的生物信息学进行分析。采用实时荧光定量PCR(qPCR)检测基因在辣椒疫霉菌侵染及不同时间下叶片的相对表达量,为深入研究在胡椒生长发育及抗瘟病的作用机制提供理论参考,对提高胡椒产量和抗性具有重要意义。
1 材料与方法
1.1 材料
实验材料为‘热引1号’胡椒叶片样本和黄花胡椒叶片样本,均采集于农业农村部万宁胡椒种质资源圃。
1.2 方法
1.2.1 总RNA提取和cDNA第一链的合成 总RNA提取参照李国泽等[21]的改良Trizol法。cDNA第一链的合成使用 RevertAid First Strand cDNA Synthesis Kit(Fermentas)。
1.2.2基因克隆 利用已发表的胡椒转录组序列,采用Primer Premier 5.0设计引物B497F2和B497R1(F:5ʹ-CAGTAATGAGAATTGT CT-3ʹ;R:5ʹ-TCACTTCAATGATTTCTC-3′)。参照伍宝朵等[22]的PCR扩增程序和体系,PCR产物用1.0%琼脂糖凝胶电泳检测,并使用PCR产物回收试剂盒回收目的片段,将其连接至pMD18- T后转化,并送生工生物工程(上海)股份有限公司测序。
1.2.3 RACE实验 参照罗聪等[23]和王继雪等[24]的方法,引物序列见表1。
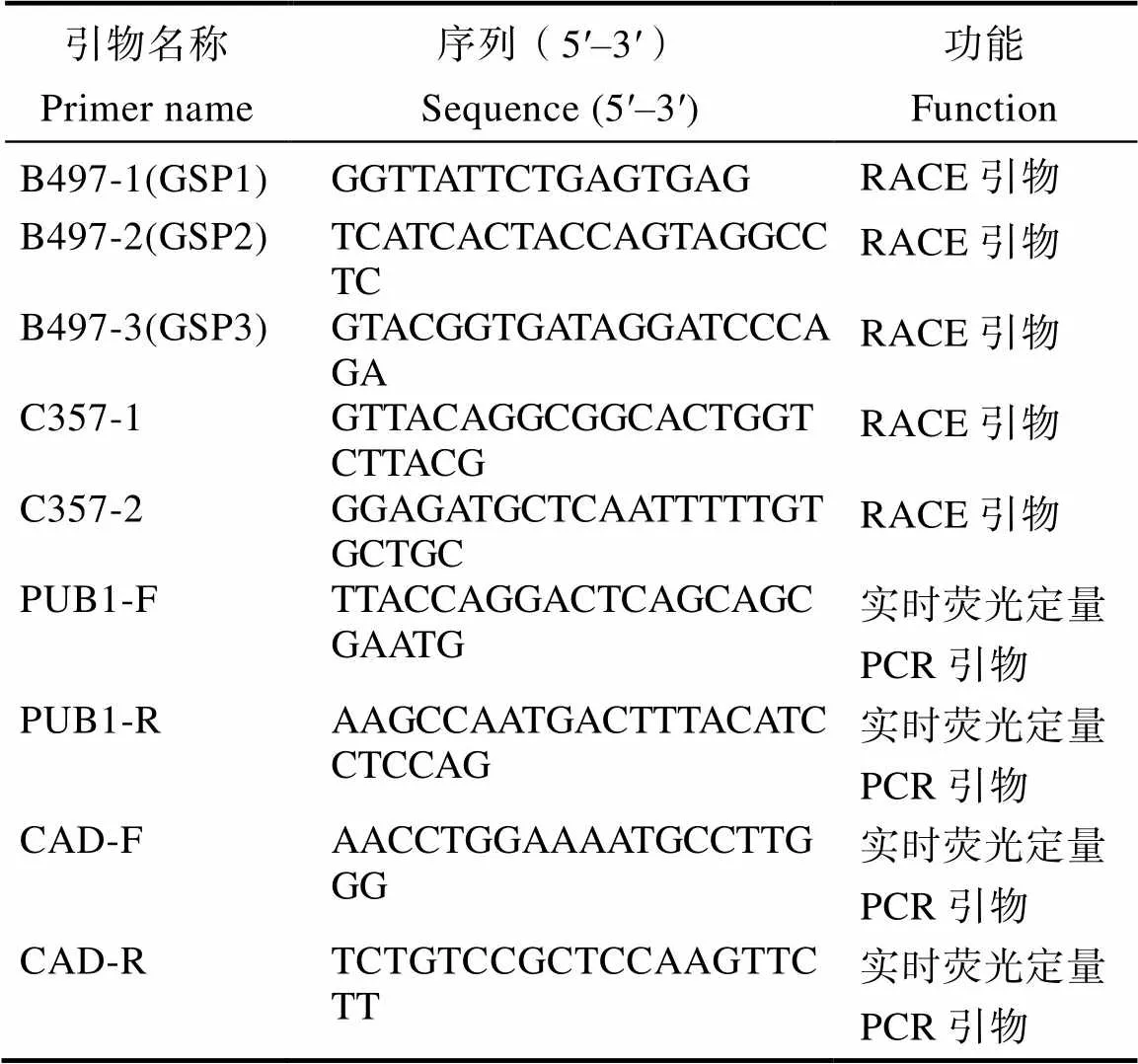
表1 引物名称及序列
1.2.4 胡椒的基因和PnCAD蛋白的生物信息学分析 利用NCBI的ORF Finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)分析基因的开放阅读框及编码的氨基酸序列;利用ProtParam(http://web.expasy.org/protparam/)分析PnCAD蛋白的蛋白序列;利用在线软件ExPASy ProtScale(https://web.expasy.org/compute_pi/)预测该蛋白质的分子量、等电点和亲水性及疏水性;利用SWISS-MODEL软件(http://swissmodel. expasy.org/)预测PnCAD蛋白的三级结构;利用NCBI的BLAST程序(https://blast.ncbi.nlm. nih.gov/Blast.cgi)进行同源性比对分析;利用在线软件SMART(http://smart.embl-heidelberg.de/)预测分析该基因氨基酸序列功能结构域;利用DNAman进行同源序列比对分析;利用MEGA 7.0软件邻接(neighbor joining, NJ)法构建系统进化树[25-27]。
1.2.5 实时荧光定量PCR 以感病种质‘热引1号’胡椒和抗病种质黄花胡椒为材料开展病原菌接种,方法及采样时间参考张叶等[28]的研究,采用Trizol法提取‘热引1号’胡椒和黄花胡椒叶片总RNA,并利用RevertAid First Strand cDNA Synthesis Kit(Fermentas)试剂盒反转录合成cDNA。以cDNA为模板进行qPCR检测。扩增程序:95℃预变性3 min;95℃变性10 s,55℃退火20 s,进行40个循环,72 ℃延伸10 min。以PUB1为内参[29],采用2–ΔΔCT法计算基因的相对表达量[30],采用Origin 8.0软件制图。
2 结果与分析
2.1 胡椒CAD基因的RACE克隆
以胡椒叶片cDNA为模板,PCR扩增得到单一条带,长度约为1063 bp(图1)。对cDNA的5¢端和3¢端进行扩增,琼脂糖凝胶电泳结果显示,扩增产物均仅有1条特异性扩增条带(图1A、图1B)。测序结果表明,5¢-RACE和3¢-RACE产物大小分别为178、315 bp,拼接后获得全长cDNA序列1364 bp,命名为。氨基酸和核苷酸序列对比,该基因有1个1071 bp的完整开放阅读框,编码356个氨基酸,起始密码子和终止密码子分别为ATG和TGA(图2)。
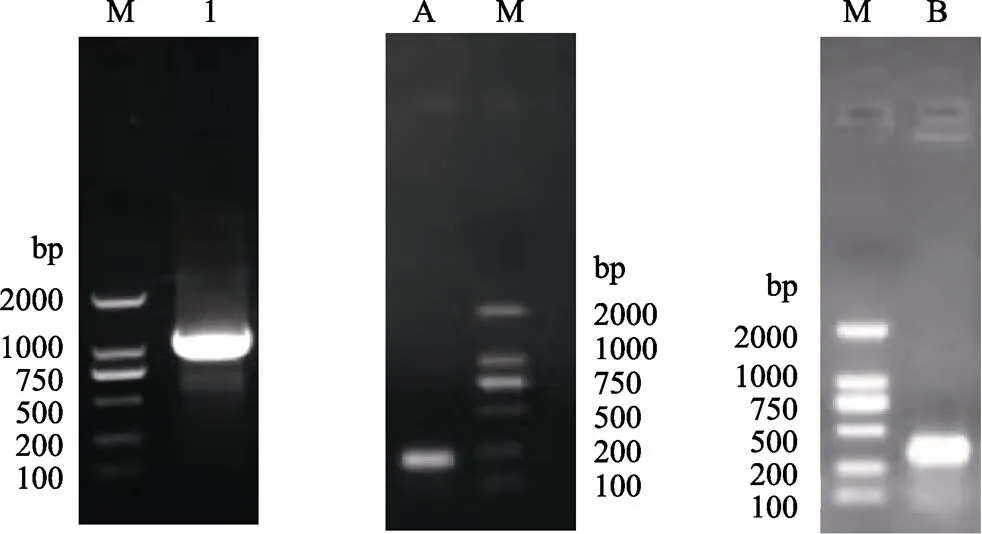
M:DL2000 marker;1:PCR产物;A:5′-RACE 产物;B:3′-RACE 产物。
2.2 胡椒PnCAD蛋白生物信息学分析
PnCAD蛋白相对分子量为38.79 kDa,pI为6.27,分子式为C1720H2702N458O514S24,原子总数为5418,脂肪指数为82.92,共有35个氨基酸残基(Arg+Lys)带正电荷和39个氨基酸残基(Asp+Glu)带负电荷,预测其不稳定指数(II)为29.97,可将此蛋白质定位为稳定蛋白质。亲水性总平均值(grand average of hydropathiciy, GRAVY)为‒0.062,表明PnCAD为亲水性蛋白。预测该蛋白不含有跨膜结构域,编码区蛋白定位到细胞质中,编码区蛋白不含有信号肽(图3)。对基因的氨基酸进行糖基化位点分析,结果显示有3个存在N-糖基化特征序列,且电势均超过了阈值0.5,分别是82、208和244,可对这3个位点进行后续研究[31]。磷酸化位点预测结果发现,共有9个磷酸化位点,8个丝氨酸磷酸化位点和1个苏氨酸磷酸化位点。结果表明PnCAD蛋白共有9个潜在的翻译后修饰(post-translation modification, PTM)。

黑色方框表示ATG起始密码子;*表示终止密码子;双下划线表示Poly(A)加尾信号;单下划綫表示poly(A)序列;圆圈符号为可能的N糖基化位点。蓝色方框区域为可能的PnCAD结构域(access No cd05283);蓝色阴影区域表示可能的二聚体界面的结合位置,红色阴影区域为NADP底物结合位点及催化锌结合位点,绿色阴影区域为结构锌结合位点。
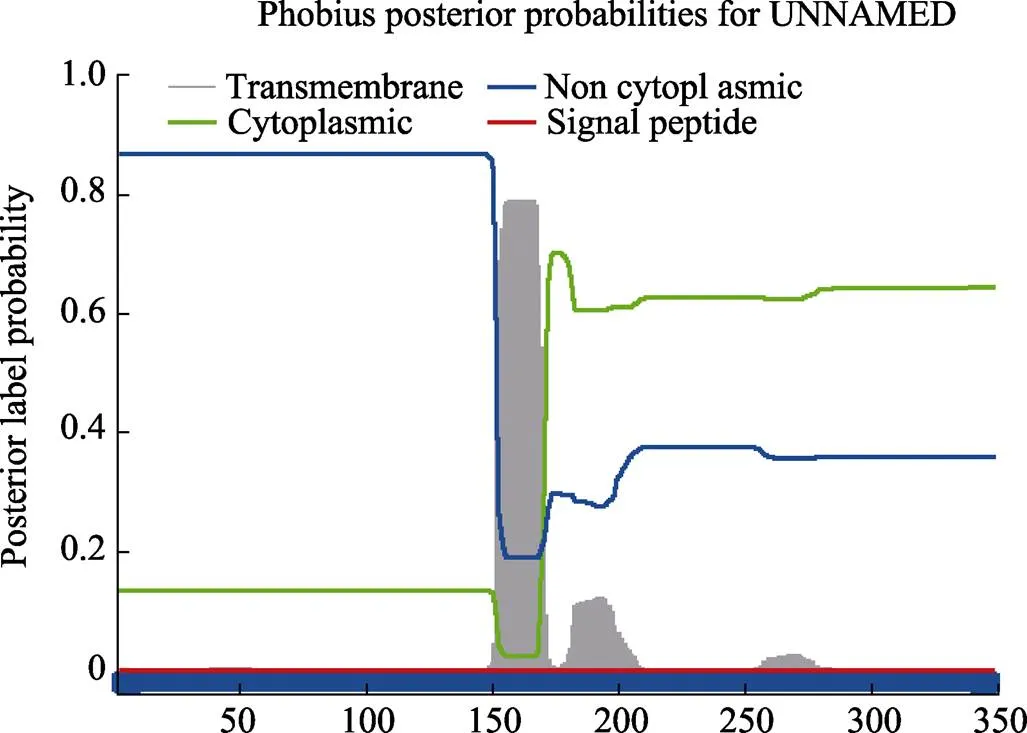
图3 信号肽及跨膜结构分析
2.3 PnCAD蛋白保守结构域和三级结构分析
用SMART在线软件对PnCAD进行蛋白保守结构域[29]检测,结果显示PnCAD蛋白含有CAD1保守结构域和1个NAD(P)结合位点,具有氧化还原酶活性,此外还含有催化锌结合位点Cys48、His70、Cys165,结构锌结合位点Cys101、Cys104、Cys107、Cys115,二聚体界面Val114、Thr172、His177、Asn270~Val300、Dimer interface。推测NADP底物结合位点主要由Cys48、Ala50、His70、Thr96、Cys165、Thr301组成(图4)。SWISS- MODEL构建CDS区三级结构,结果发现与MDR超家族的酶结构很相似。CAD以同源二聚体的形式存在,存在2个锌离子结合位点,同源二聚体ADs可结合4个锌离子。其中催化锌结合位点正好位于底物结合位点的正中心,该NADP底物结合位点主要由其他五部分组成,形成一个凹陷的空腔(图5)[32]。
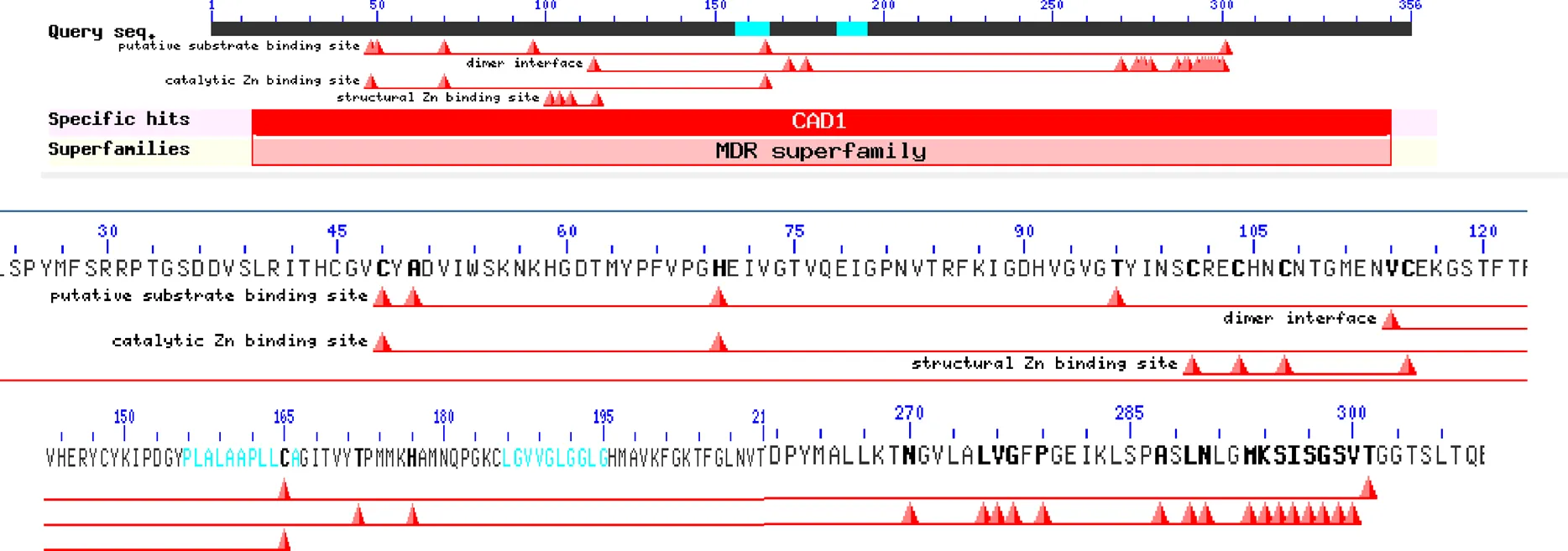
图4 PnCAD蛋白保守区结构预测
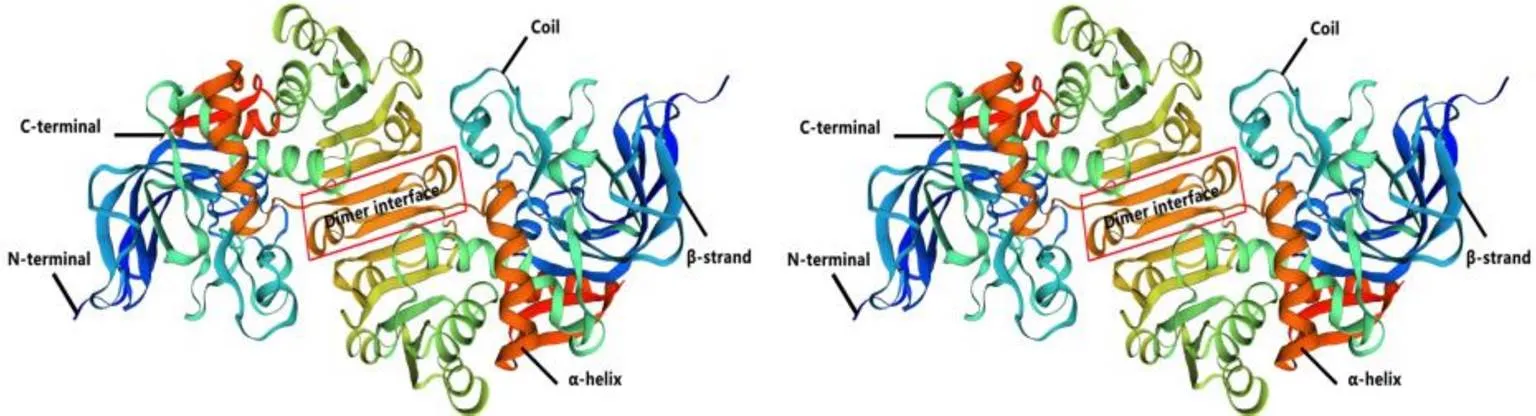
图5 胡椒PnCAD蛋白三级结构预测结果
2.4 PnCAD蛋白序列的多重序列比对和进化分析
利用NCBI Blastp对PnCAD蛋白序列进行同源比对,结果见图6,其与细辛的氨基酸序列相似性为76%,其CAD酶的CAD1结构域都较为保守,特别是底物结合位点(红色三角表示)位置的氨基酸残基保守性非常高,相对来说二聚体结合面的同源性较低。利用MEGA 7.0构建PnCAD和其他物种的CAD氨基酸序列系统发育树,结果显示胡椒PnCAD与细辛AsCAD6亲缘关系最为接近,隶属于比较原始的双子叶植物。与其他双子叶植物距离较远,与凤梨、大米、小麦等单子叶植物聚类在同一个大分支上(图7)。
2.5 PnCAD基因的表达分析
本研究以为内参基因,以无菌水处理为对照,用病原菌处理8、12、24、48 h后进行表达模式分析。在接水处理中,黄花胡椒的表达量和‘热引1号’胡椒的基本相似;在病原菌接种8 h时,黄花胡椒的表达量是对照的10倍,随后表达量降低同时高于对照组;在病原菌接种24 h时,表达量又增高,大约是对照的6倍,之后稍微降低。‘热引1号’胡椒在接种8 h时,其基因表达量最低,之后逐渐缓慢升高,但所有的接种组都比黄花胡椒含量低,且差异显著(图8)。
3 讨论
本研究在转录组测序基础上,通过RACE技术克隆胡椒基因,基因大小为1364 bp,编码356个氨基酸残基,蛋白质理论分子量大小约为3.879 kDa,预测pI为6.27。PnCAD蛋白属于亲水性蛋白,其中包含9个磷酸化位点和3个N-糖基化特征序列;根据亚细胞定位发现,该蛋白位于细胞质上,且不含有跨膜结构域和信号肽位点,这与在水芹、腊梅中克隆到的基因结果相同[9, 33]。利用网站构建基因的CDS区三级结构,该蛋白的三级结构与MDR超家族的酶结构很相似;对PnCAD蛋白保守结构域进行预测,结果显示PnCAD蛋白含有CAD1保守结构域,属于MDR超家族;分析后发现胡椒CAD蛋白含有1个NAD(P)结合位点、多个催化锌和结构锌结合位点具有高度保守性。郝丽芬等[19]克隆洋草麦肉桂醇脱氢酶基因的CDS序列,含有多个催化锌结合位点和底物锌结合位点,也具有典型的CAD1结构域,与本研究结果基本一致。车玉红等[20]对榅桲果肉组织中基因的编码区全序列进行测序和表达分析,结果显示,在果实发育早期,木质素合成快,基因表达量高,随着木质素合成速度趋缓,基因的表达量逐渐降低。表明基因表达量与木质素合成呈正相关,与本研究结果基本一致。

图6 胡椒PnCAD蛋白的氨基酸序列与其他植物CAD的同源性比较

图7 胡椒PnCAD蛋白的进化树分析
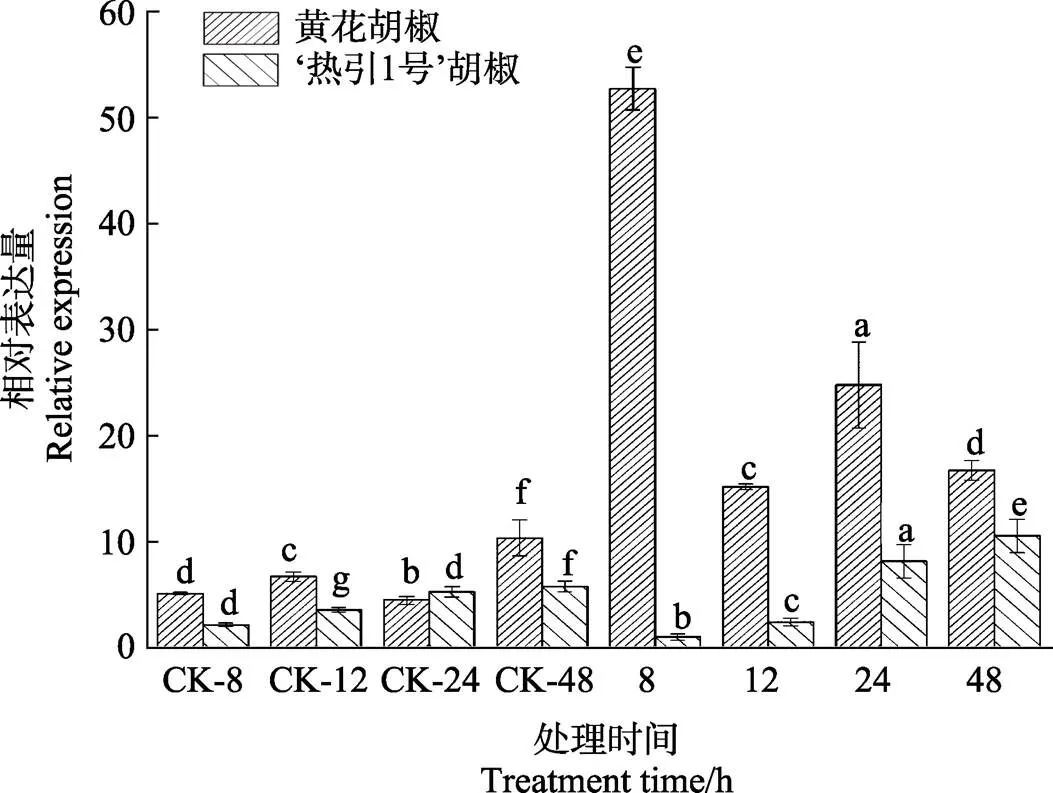
图8 PnCAD基因表达结果
本研究发现胡椒和细辛的同源性最高达到76%,同隶属于比较原始的双子叶植物,其CAD酶的CAD1结构域均较保守,特别是底物结合位点位置的氨基酸残基的保守性非常高;在辣椒疫霉菌侵染下,胡椒基因的表达量出现升高,在8 h达到最高值,分析可能是由于病原菌的侵染调节了基因的表达,使PnCAD蛋白维持在相应的水平,说明基因参与调控胡椒瘟病的抗性。另外,胡椒不同抗性种质受辣椒疫霉菌侵染后表达存在差异,接种后抗病种质的表达量均高于感病种质,表明基因的表达模式在不同抗性水平的胡椒种质中也存在一定的差异。目前,对在植物中被病原体感染、辐射等外界刺激所激活而表达基因的研究很多。前人研究表明谭雅芹[34]用灰霉菌侵染野生型和转化植株,得出超表达转化株的菌丝形成率低于野生型植株,说明在灰霉菌胁迫下可能通过合成类木质素参与防御反应。刘贺娟[35]对甜瓜幼苗接种枯萎病菌后,植株根、茎、叶中的木质素含量、PAL、CAD等酶活性均有不同程度的升高;除茎外根系和叶片中均有诱导的基因家族成员,甜瓜响应病菌侵染,这与本研究一致。上述研究结果表明,在病原菌侵染下,基因均能通过提高表达来改变植物体内木质素的合成,是较为理想的目标基因。本研究为今后研究胡椒抗非生物胁迫功能提供参考,为的功能研究提供理论依据。
[1] 张 军. 海南农垦胡椒产业发展情况[J]. 中国热带农业, 2021(2): 24-27.
ZHANG J. The development of pepper industry in Hainan state farm[J]. Journal of Chinese Tropical Agriculture, 2021(2): 24-27. (in Chinese)
[2] 郝朝运, 胡丽松, 范 睿, 谭乐和, 伍宝朵, 杨建峰. 中国特有药用植物黄花胡椒种子萌发特性研究[J]. 热带作物学报, 2017, 38(11): 2071-2075.
HAO C Y, HU L S, FAN R, TAN L H, WU B D, YANG J F. Seed germination characteristics of, an endemic medical plant to China[J]. Chinese Journal of Tropical Crops, 2017, 38(11): 2071-2075. (in Chinese)
[3] 胡丽松, 范 睿, 伍宝朵, 黄大雄, 李志刚, 郝朝运. 砧木状态和嫁接时间对胡椒种间嫁接成活率的影响分析[J]. 热带农业科学, 2018, 38(2): 11-15.
HU L S, FAN R, WU B D, HUANG D X, LI Z G, HAO C Y. The effect of rootstock and grafting time on the survival rate of interspecific grafting of black pepper[J]. Chinese Journal of Tropical Agriculture, 2018, 38(2): 11-15. (in Chinese)
[4] SATTLER S E, SAATHOFF A J, HAAS E J, PALMER N A, FUNNELL-HARRIS D L, SARATH G, PEDERSEN J F. A nonsense mutation in a cinnamyl alcohol dehydrogenase gene is responsible for the sorghumphenotype[J]. Plant Physiology, 2009, 150(2): 584-595.
[5] LEE D, MEYER K, CHAPPLE C, DOUGLAS C J. Antisense suppression of 4-coumarate:coenzyme A ligase activity inleads to altered lignin subunit composition[J]. The Plant Cell, 1997, 9(11): 1985-1998.
[6] BOERJAN W, RALPH J, BAUCHER M. Lignin biosynthesis[J]. Annual Review of Plant Biology, 2003, 54(1): 519-546.
[7] SAATHOFF A J, HARGROVE M S, HAAS E J, AARON J, TOBIAS C M, TWIGG P, SATTLER S, SARATH G. Switchgrass pviCAD1: understanding residues important for substrate preferences and activity[J]. Applied Biochemistry and Biotechnology, 2012, 168(5): 1086-1100.
[8] 曹佳强, 李 波, 杨 洋, 胡文冉, 王玉晶, 范 玲. 木质素生物合成中肉桂醇脱氢酶基因(CAD)的研究进展[J]. 分子植物育种, 2014, 12(5): 1034-1043.
CAO J Q, LI B, YANG Y, HU W R, WANG Y J, FAN L. Advanced progress in the cinnamyl alcohol dehydrogenase gene involved in lignin biosynthesis[J]. Molecular Plant Breeding, 2014, 12(5): 1034-1043. (in Chinese)
[9] 仇 亮, 朱胜琪, 王永鑫, 冯 凯, 刘洁霞, 熊爱生. 水芹肉桂醇脱氢酶基因的克隆与表达特性分析[J]. 西北植物学报, 2018, 38(6): 1003-1009.
QIU L, ZHU S Q, WANG Y X, FENG K, LIU J X, XIONG A S. Cloning and expression characteristics analysis ofgene in[J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(6): 1003-1009. (in Chinese)
[10] MANSELL R L, GROSS G G, STOCKIGT J, FRANKE H, ZENK M H. Purification and properties of cinnamyl alcohol dehydrogenase from higher plants involved in lignin biosynthesis[J]. Phytochemistry, 1974, 13(11): 2427-2435.
[11] 卢雯瑩, 崔贺云, 高 杉, 崔顺梅, 吴营照. 肉桂醇脱氢酶基因研究进展及其在小麦抗倒伏中的应用[J]. 天津农业科学, 2020, 26(10): 7-10.
LU W Y, CUI H Y, GAO S, CUI S M, WU Y Z. Research progress of cinnamyl alcohol dehydrogenase gene and its application in lodging resistance in wheat[J]. Tianjin Agricultural Sciences, 2020, 26(10): 7-10. (in Chinese)
[12] 隋娟娟, 邓红祥, 杨京霞, 孙晶晶, 屈长青. 香椿基因的克隆与非生物胁迫下的表达特性[J]. 基因组学与应用生物学, 2019, 38(10): 4617-4625.
SUI J J, DENG H X, YANG J X, SUN J J, QU C Q. Cloning and expression characteristics ofgene under abiotic stress condition in[J]. Genomics and Applied Biology, 2019, 38(10): 4617-4625. (in Chinese)
[13] JOURDES M, CARDENAS C L, LASKAR D D, MOINUDDIN S G A, DAVIN L B, LEWIS N G. Plant cell walls are enfeebled when attempting to preserve native lignin configuration with poly--hydroxycinnamaldehydes: evolutionary implications[J]. Phytochemistry, 2007, 68(14): 1932-1956.
[14] 张颖俊. 干旱胁迫下油菜木质素含量及其关键基因表达的时空动态变化[D]. 重庆: 西南大学, 2015.
ZHANG Y J. Temporal and spatial dynamic changes of the lignin content and the expression of key genes ofunder drought stress[D]. Chongqing: Southwest University, 2015. (in Chinese)
[15] YOUN B, CAMACHO R, MOINUDDIN S G A, LEE C, DAVIN L B, LEWIS N G, KANG C. Crystal structures and catalytic mechanism of the arabidopsis cinnamyl alcohol dehydrogenasesand[J]. Organic & Biomolecular Chemistry, 2006, 4(9): 1687.
[16] 张经博, 李 波, 杨 洋, 胡文冉, 陈方圆, 谢丽霞, 范 玲. 陆地棉CAD基因家族的进化和表达分析[J]. 新疆农业科学, 2016, 53(7): 1177-1187.
ZHANG J B, LI B, YANG Y, HU W R, CHEN F Y, XIE L X, FAN L. Evolution and expression analysis of upland cotton CAD gene family[J]. Xinjiang Agricultural Sciences, 2016, 53(7): 1177-1187. (in Chinese)
[17] 黄海燕, 王玉富, 薛召东, 邱财生, 郝冬梅. 亚麻基因克隆及序列分析[J]. 湖北农业科学, 2008(5): 496-498.
HUANG H Y, WANG Y F, XUE Z D, QIU C S, HAO D M. Clone of partial sequence of cinnamyl alcohol dehydrogenase gene in flax[J]. Hubei Agricultural Sciences, 2008(5): 496-498. (in Chinese)
[18] MA Q H. Functional analysis of a cinnamyl alcohol dehydrogenase involved in lignin biosynthesis in wheat[J]. Journal of Experimental Botany, 2010, 61(10): 2735-2744.
[19] 郝丽芬, 房永雨, 孙 林, 赵俊利, 史志丹, 詹鹤年, 丁海君. 洋草麦基因的克隆与生物信息学分析[J]. 畜牧与饲料科学, 2021, 42(3): 7-13.
HAO L F, FANG Y Y, SUN L, ZHAO J L, SHI Z D, ZHAN H N, DING H J. Cloning and bioinformatic analysis ofgene in[J]. Animal Husbandry and Feed Science, 2021, 42(3): 7-13. (in Chinese)
[20] 车玉红, 杨 波, 郭春苗, 木巴热克·阿尤普, 吴津蓉, 杜 鹃. 榅桲果实基因的克隆、序列分析及表达[J]. 新疆农业科学, 2020, 57(5): 814-821.
CHE Y H, YANG B, GUO C M, MUBAREKE A Y P, WU J R, DU J. Cloning, sequence analysis and expression ofgene of quince fruit[J]. Xinjiang Agricultural Sciences, 2020, 57(5): 814-821. (in Chinese)
[21] 李国泽, 邵亚林, 常 玮, 丁 勇. 3种兜兰属植物叶片总RNA提取方法的研究[J]. 西南农业学报, 2021, 34(4): 827-833.
LI G Z, SHAO Y L, CHANG W, DING Y. Methods of total RNA extraction from leaves of threespecies[J]. Southwest China Journal of Agricultural Sciences, 2021, 34(4): 827-833. (in Chinese)
[22] 伍宝朵, 胡丽松, 范 睿, 杨建峰, 郝朝运. 胡椒基因克隆与表达分析[J]. 西南农业学报, 2018, 31(10): 2010-2015.
WU B D, HU L S, FAN R, YANG J F, HAO C Y. Cloning and expression analysis ofinL.[J]. Southwest China Journal of Agricultural Sciences, 2018, 31(10): 2010-2015. (in Chinese)
[23] 罗 聪, 何新华, 陈 虎, 韦泳丽, 李明娟. 一种高效获取基因5′末端的RACE方法[J]. 植物生理学报, 2011, 47(4): 409-414.
LUO C, HE X H, CHEN H, WEI Y L, LI M J. A high-efficient method of RACE technique for obtaining the gene 5end[J]. Plant Physiology Journal, 2011, 47(4): 409- 414. (in Chinese)
[24] 王继雪, 孙延鸣. RACE法克隆巴什拜羊SP-A基因及序列分析[J]. 西南农业学报, 2018, 31(10): 2196-2201.
WANG J X, SUN Y M. RACE cloning and sequential analysis of pulmonary surfactant-associated protein A in bashibay sheep[J]. Southwest China Journal of Agricultural Sciences, 2018, 31(10): 2196-2201. (in Chinese)
[25] FELSENSTEIN J. Confidence limits on phylogenies: an approach using the bootstrap[J]. Evolution, 1985, 39(4): 783-791.
[26] ZUCKERKANDL E. Evolutionary divergence and convergence in proteins[J]. Evolving Genes & Proteins, 1965: 97-166.
[27] KUMAR S, STECHER G, TAMURA K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016(7): 1870.
[28] 张 叶, 邢跃先, 王梓钰, 闻 竞, 郝东云, 李世界. 张 艳. 玉米镰孢穗腐病菌接种方法的研究[J]. 东北农业科学, 2021, 46(3): 64-69.
ZHANG Y, XING Y X, WANG Z Y, WEN J, HAO D Y, LI S J, ZHANG Y. Study on inoculation methods of ear rot caused byandin maize[J]. Journal of Northeast Agricultural Sciences, 2021, 46(3): 64-69. (in Chinese)
[29] 胡丽松, 范 睿, 伍宝朵, 吴 刚, 谭乐和, 郝朝运. 胡椒实时荧光定量PCR内参基因的筛选[J]. 热带作物学报, 2017, 38(10): 1901-1906.
HU L S, FAN R, WU B D, WU G, TAN L H, HAO C Y. The identification of internal control genes for real-time PCR normalization in black pepper[J]. Chinese Journal of Tropical Crops, 2017, 38(10): 1901-1906. (in Chinese)
[30] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[31] 马立娟, 佟文哲, 杜丽平, 崔馨予, 马 清, 肖冬光. N-糖基化对黑曲霉AnLPMO15g与纤维素酶协同作用的影响[J]. 高校化学工程学报, 2019, 33(5): 1148-1155.
MA L J, TONG W Z, DU L P, CUI X Y, MA Q, XIAO D G. Effects of-glycosylation on synergism of AnLPMO15g fromand cellulase[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(5): 1148-1155. (in Chinese)
[32] TAN C S, HASSAN M, HUSSEIN Z A M, ISMAIL I, HO K L, NG C L, ZAINAL Z. Structural and kinetic studies of a novel nerol dehydrogenase from, a nerol- specific enzyme for citral biosynthesis[J]. Plant Physiology and Biochemistry, 2017: 359-368.
[33] 李志菜. 蜡梅肉桂醇脱氢酶基因的克隆、表达特性分析及功能验证[D]. 重庆: 西南大学, 2013.
LI Z C. Cloning, expression analysis and function identification of cinnamyl alcohol dehydrogenase gene from(Linn.) Link[D]. Chongqing: Southwest University, 2013. (in Chinese)
[34] 谭雅芹. 灰霉菌胁迫下小立碗藓肉桂醇脱氢酶1基因功能的初步研究[D]. 贵阳: 贵州师范大学, 2018.
TAN Y Q. Preliminary study on the function of1 inunder the stress of[D]. Guiyang: Guizhou Normal University, 2018. (in Chinese)
[35] 刘贺娟. 病菌侵染对甜瓜木质素合成相关酶活性、基因表达及可能防御途径的影响[D]. 沈阳: 沈阳农业大学, 2016.
LIU H J. Effects of pathogenic bacterium on activities of lignin-related enzymes and genes expressions ofand the possible defense pathway in oriental melon (var.Makino)[D]. Shenyang: Shenyang Agricultural University, 2016. (in Chinese)
Cloning and Bioinformatics Analysis of PepperGene by Race
SUN Yeqiao1,2,3, WANG Jue1,2,3, HU Lisong2,3, WU Baoduo2,4, HAO Chaoyun2,4,5, FAN Rui2,4,5*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Institute of Spices and Beverages, Chinese Academy of Tropical Agricultural Sciences, Wanning, Hainan 571533, China; 3. Hainan Key Laboratory of Genetics, Breeding and Germplasm Resources, Wanning, Hainan 571533, China; 4. Hainan Key Laboratory of Genetic Improvement and Quality Control of Tropical Spice Beverage Crops, Wanning, Hainan 571533, China; 5. Hainan SIM Soonliang Academician Workstation, Wanning, Hainan 571533, China
Lignin has some functions in plants, such as transporting water, supporting plants and strengthening plants against damage, etc. It is one of the important products of phenylpropane metabolism.Among them, cinnamyl alcohol dehydrogenase (CAD) is an important rate-limiting enzyme in the lignin synthesis pathway.In this experiment, on the basis of pepper transcriptome sequencing, the RACE method was used for gene cloning, bioinformatics analysis of the full-lengthgene, and many analyses of its protein such as physicochemical properties, subcellular localization and phylogenetic tree. It was analyzed by qPCR. The cinnamyl alcohol dehydrogenase gene was cloned by the race method. Finally, a full-length cDNA with a length of 1364 bp was obtained, including 1071 bp open reading frame (ORF), encoding 356 amino acids. The predicted relative molecular weight was 3.879 kDa and the isoelectric point was 6.27. It belonged to hydrophilic protein.It contained three N-glycosylation characteristic sequences and nine phosphorylation sites, which were likely to be in the cytoplasm. Domain analysis showed that CAD protein contained NAD (P) binding sites, multiple catalytic zinc and structural zinc binding sites. Phylogenetic tree analysis showed that pepper CAD was closely related toCAD 6, and the highest homology was 76%, both of which belonged to primitive dicotyledons. Through fluorescence quantitative analysis, it could be found that the expression ofunder the infection ofincreased, reached the highest value at 8 h, about 10 times that of the control, then increased slightly at 24 h, about 6 times that of the control group, and then decreased. Generally speaking, the gene expression level ofat all time was higher than that ofcv.and was significantly different. The experimental data could provide reference data for the future study of the anti abiotic stress function of black pepper, and also provide a theoretical basis for the functional study of gene.
;; gene cloning; bioinformatics analysis; qPCR
S961.6
A
10.3969/j.issn.1000-2561.2022.12.004
2022-03-28;
2022-06-23
中央级公益性科研院所基本科研业务费专项(No. 1630142020001)。
孙也乔(1998—),女,硕士研究生,研究方向:作物抗逆分子育种。*通信作者(Corresponding author):范 睿(FAN Rui),E-mail:tlfr83@163.com。
