镉胁迫对姬松茸产量与镉吸收的效应及防控技术
2023-01-16刘朋虎翁伯琦王义祥
陈 华,刘朋虎,叶 菁,林 怡,翁伯琦,王义祥*
镉胁迫对姬松茸产量与镉吸收的效应及防控技术
陈 华1,3,刘朋虎2,3,叶 菁1,3,林 怡1,3,翁伯琦1,3,王义祥1,3*
1. 福建省农业科学院农业生态研究所,福建福州 350003;2. 福建农林大学国家菌草工程技术研究中心,福建福州 350002;3. 福建省红壤山地农业生态过程重点实验室,福建福州 350003
设立外源添加0、10、20、30、40 mg/kg镉胁迫处理,探讨不同镉胁迫浓度对2个姬松茸品种产量、品质、镉吸收的影响,并研究其防控技术。结果表明:不同镉胁迫浓度对姬松茸J37和J1子实体农艺性状的影响有差异,随着外源镉浓度的增加,其子实体的菌盖重量、菌柄重量、菌盖厚度、菌盖直径、菌柄长度、菌柄直径等6个指标均呈逐渐降低的趋势。J37和J1第一、二、三潮次子实体产量、粗蛋白含量则随镉浓度的增大而明显下降,外源添加0、10、20、30、40 mg/kg镉胁迫处理的J37第一潮子实体产量比J1分别提高32.5%、45.1%、31.0%、38.2%、36.5%;镉胁迫对J1与J37的粗蛋白含量影响敏感点分别为10 mg/kg和20 mg/kg;当镉浓度为20 mg/kg时,J1的多糖含量比J37高8.2%;当镉浓度依次增加时,J1的镉富集量均高于J37。10 mg/kg和20 mg/kg镉胁迫处理J1和J37后,施用45 mg/kg CaSO4,对镉胁迫的毒害缓解作用最佳,施钙肥对镉胁迫毒害的平均防控率分别达36.2%和47.6%。栽培基质中镉浓度达20 mg/kg,是姬松茸耐受镉毒害的敏感节点或者转折阈值,其第一潮次产量下降幅度超过40%;姬松茸耐受生长基质镉胁迫浓度要控制在10 mg/kg范围内;姬松茸子实体重量或者菌盖直径、菌柄直径变小可作为生长前期镉胁迫产生毒害的直观判断依据。
姬松茸;镉胁迫;子实体;农艺性状;产量;镉含量
土壤镉污染,不仅对植物生长有毒害作用,而且会引发农产品的镉超标,尤其是农作物副产物作为食用菌等栽培原料还会产生延伸性的污染,其引发的菇类产品镉超标将直接影响食品安全,并进一步对人体健康产生较大的危害[1-2]。姬松茸(Murrill)由于良好的品质与特殊的风味,深受广大消费者的喜爱[3]。但生产实践表明,姬松茸对镉等重金属比较敏感,在姬松茸栽培过程容易发生镉累积与超标现象,进而影响姬松茸的绿色生产与菇品安全,防控姬松茸生产过程的镉污染已经引起人们高度重视[4-5]。本项目组前期研究表明,要避免与防控姬松茸镉污染或镉累积超标,除了要着力选育低镉姬松茸品种外,就是要深入探讨姬松茸吸收与富集镉的规律与便捷防控措施,尤其是深入探索并了解姬松茸在不同生长阶段对镉吸收与累积过程的内在动态变化及其相互关系[6-7]。
就姬松茸镉响应研究进展方面,李三暑等[4]测定并分析了姬松茸镉污染状况,徐丽红等[8]深入开展了姬松茸对有害重金属镉的吸收富集规律及控制技术研究,林戎斌[9]探索了镉在姬松茸生产中的迁移、分布规律及降低镉含量措施,李波[10]研究了镉胁迫下2个姬松茸品种的生长及镉富集特性。而深入研究镉胁迫对姬松茸栽培过程不同潮次农艺性状的影响及其镉超标的有效防控技术,包括寻求有效降低镉吸收累积的实现途径方面的报道则较少。本研究以项目组通过60Co辐射诱变而成功选育的低镉姬松茸新品种J37与常规生产品种姬松茸J1为供试品种,外源添加不同浓度的镉为胁迫处理,系统探索不同镉浓度胁迫下,姬松茸子实体生长与品质及其镉吸收累积量的动态响应,以期总结其内在变化规律,为栽培环节耐受镉胁迫的姬松茸品种选育及筛选若干农艺性状作为镉毒害表征指标提供参考与借鉴,同时探讨在培养基中施用适当的硫酸钙作为防控镉累积的效果,为进一步探讨不同姬松茸品种耐受镉胁迫的分子生物学机制及其防控技术研究提供科学依据。
1 材料与方法
1.1 材料
选择J1和J37姬松茸(Murrill)为供试菌种,常规生产品种J1与项目组选育的低镉姬松茸品种J37均由福建农林大学国家菌草工程技术研究中心联合项目组提供。姬松茸栽培的基本培养料配方为:棉籽壳20.0%,玉米芯12.5%,牛粪(干)35.0%,麸皮10.0%,稻草(干)10.0%,圆叶决明干草10.0%,CaCO31.0%,石灰1.5%。麦粒种:小麦20 kg,硫酸钙0.4 kg。
1.2 方法
1.2.1 试验设计 试验设0(CK)、10、20、30、40 mg/kg共5个外源添加不同镉浓度处理,将培养料按料水比1∶1.25混合,并将配制好的氯化镉母液按试验设计的相应量加入培养料中。将搅拌均匀的培养料分装入聚丙烯袋中,每袋装料1.8 kg,每个菌株每个处理设20个重复,随机区组排列。
选择在10、20 mg/kg外源添加不同镉浓度处理中,分别施用0、15、30、45、60 mg/kg硫酸钙,探讨其防控姬松茸子实体镉吸收与累积的成效,评估降镉防控措施的可行性与实际效果。每个菌株每个处理设20个重复,随机区组排列。
1.2.2 栽培管理 姬松茸的出菇栽培按照常规袋栽管理。先将分装好的栽培袋封口,放入高压灭菌锅中,121℃灭菌2 h;随后在无菌接种箱中按照无菌操作接种,再将接种好的菌袋放置在28℃恒温培养室中;待菌丝长满袋后,分别将栽培袋移至栽培室,并按随机区组排列,开袋覆土。待出菇后分别采收,称重,烘干,冷藏备用。
1.2.3 子实体农艺性状及产量测定 将采收后的新鲜子实体用小刀与小刷子轻轻去掉菌柄带出的土,然后分别用天平和数显卡尺对子实体进行称重和测量,对每个菌株每个梯度的出菇数量、主要农艺性状、菇鲜重分别统计与称重。农艺性状测量指标包括:单株子实体菌盖重量和菌柄重量,单株子实体菌柄长度和菌盖厚度,以3次重复计算平均值;子实体产量分为三潮收获,每一潮产量分别为3次重复的平均值。
1.2.4 子实体中镉含量测定 将新鲜子实体去土后,置于60℃下烘干至恒重,用高速粉碎机将烘干的样品磨成粉。子实体样品消解采用硝酸-过氧化氢混合微波消解。称取0.2 g子实体粉,放入预先清洗干净的微波消煮管中,加入5.0 mL硝酸密封过夜;第2天消煮前,每个消煮管加入2.0 mL过氧化氢,在100℃预热25 min;之后将消煮管置于常温后拧紧盖子,放入微波消煮仪中进行消煮。将消煮的液体淋洗到50 mL容量瓶中,并进行适当稀释,之后用火焰原子吸收光谱仪进行镉含量的测定[11]。同时做空白试验,每个样品均设3个重复。所用试剂均为优级纯,所用水均为超纯水。在样品的测定过程中以黑木耳无机成分标准物质(GBW10089)进行分析质量控制,结果显示标准物质测定数据较集中,并且平均值接近标准值,说明精密度高,准确度也高,符合质量控制要求[8]。
1.2.5 子实体粗蛋白与多糖含量测定 姬松茸子实体粗蛋白(凯氏定氮法)[12]与多糖含量(分光光度法)[13]按照常规方法测定。
1.3 数据处理
采用SPSS 19.0软件对实验数据进行差异显著性分析和相关性分析。
2 结果与分析
2.1 不同浓度镉胁迫对不同生长潮次姬松茸农艺性状的影响
2.1.1 对姬松茸子实体菌盖重量的影响 由表1显示,在0、10、20、30、40 mg/kg镉浓度胁迫下,诱变新菌株J37第一潮菇子实体的平均菌盖重量分别比原菌株J1增加24.9%、20.6%、13.4%、23.8%、13.7%;第二潮菇子实体的平均菌盖重量则分别比原菌株J1增加14.9%、17.3%、4.3%、23.7%、39.9%;第三潮菇子实体的平均菌盖重量分别比原菌株J1增加11.1%、8.1%、1.4%、4.7%、18.2%。由此表明,在镉胁迫下,诱变新菌株J37的3个潮次生长过程的子实体菌盖重量均优于原菌株J1。就第三潮子实体而言,在40 mg/kg镉胁迫浓度下,虽然诱变新菌株J37菌盖重量与同浓度胁迫下第一潮子实体相比降幅达37.1%,但仍比原菌株J1在同浓度镉胁迫下第三潮子实体菌盖重量(0.297 g)增18.2%。
2.1.2 对不同生长潮次姬松茸子实体菌盖厚度的影响 在0、10、20、30、40 mg/kg镉浓度胁迫下,诱变新菌株J37第一潮菇子实体的平均菌盖厚度分别比原菌株J1增加2.2%、8.0%、3.1%、35.1%、36.1%;而J37第二潮菇子实体的平均菌盖厚度分别比原菌株J1增加14.9%、17.28%、4.27%、23.71%、39.93%;J37第三潮菇子实体的平均菌盖厚度分别比原菌株J1增厚6.9%、13.9%、17.6%、23.5%、31.7%;表明诱变新菌株J37在镉胁迫下,3个潮次生长过程的子实体的菌盖厚度均优于原菌株J1。就第三潮子实体而言,在40 mg/kg镉胁迫浓度下,虽然诱变新菌株J37菌盖厚度与同浓度胁迫下第一潮子实体相比降幅达35.7%,但仍比原菌株J1在同浓度镉胁迫下第三潮子实体菌盖厚度(0.410 cm)厚31.7%(表1)。
2.1.3 对不同生长潮次姬松茸子实体菌盖直径的影响 在0、10、20、30、40 mg/kg镉浓度胁迫下,诱变新菌株J37第一潮菇子实体的平均菌盖直径分别比原菌株J1增16.7%、21.2%、27.9%、24.3%、29.0%;新菌株J37第二潮菇子实体的平均菌盖直径分别比原菌株J1增10.3%、20.8%、29.2%、12.1%、13.6%;新菌株J37第三潮菇子实体的平均菌盖直径分别比原菌株J1增21.4%、26.3%、26.5%、13.0%、4.1%;由此表明,诱变新菌株J37在镉胁迫下,3个潮次生长过程的子实体的菌盖直径均优于原菌株J1。就第三潮子实体而言,在40 mg/kg镉胁迫浓度下,虽然诱变新菌株J37菌盖直径与同浓度胁迫下第一潮子实体相比降幅达29.7%,但仍比原菌株J1在同浓度镉胁迫下第三潮子实体菌盖直径(0.900 cm)增4.11%(表1)。
2.1.4 对不同生长潮次姬松茸子实体菌柄重量的影响 由表1显示,在0、10、20、30、40 mg/kg镉浓度胁迫下,诱变新菌株J37第一潮菇子实体的平均菌柄重量分别比原菌株J1增46.4%、63.4%、58.2%、57.1%、70.9%;J37第二潮菇子实体的平均菌柄重量分别比原菌株J1增37.1%、39.5%、43.4%、61.9%、68.2%;J37第三潮菇子实体的平均菌柄重量分别比原菌株J1增24.1%、40.4%、53.1%、53.1%、42.6%;由此表明,诱变新菌株J37在镉胁迫下,3个潮次生长过程的子实体的菌柄重量均优于原菌株J1。就第三潮子实体而言,在40 mg/kg镉胁迫浓度下,虽然诱变新菌株J37菌柄重量与同浓度胁迫下第一潮子实体相比降幅达27.4%,但仍比原菌株J1在同浓度镉胁迫下第三潮子实体菌柄重量(0.416 g)增42.6%。
2.1.5 对不同生长潮次姬松茸子实体菌柄高度的影响 由表1显示,在0、10、20、30、40 mg/kg镉浓度胁迫下,诱变新菌株J37第一潮菇子实体的平均菌柄高度分别比原菌株J1降低12.3%、12.9%、15.4%、15.4%、11.1%;J37的第二潮菇子实体的平均菌柄高度分别比原菌株J1增14.9%、17.3%、4.3%、23.7%、39.9%;J37的第三潮菇子实体的平均菌柄高度分别比原菌株J1增6.9%、13.9%、17.6%、23.5%、31.7%;由此表明,诱变新菌株J37在镉胁迫下,后2个潮次生长过程的子实体菌柄高度均优于原菌株J1。就第三潮子实体而言,在40 mg/kg镉胁迫浓度下,虽然诱变新菌株J37菌柄高度与同浓度胁迫下第一潮子实体相比降幅达40.1%,但仍比原菌株J1在同浓度镉胁迫下第三潮子实体菌柄高度(2.437 cm)增高19.5%。
2.1.6 对不同生长潮次姬松茸子实体菌柄直径的影响 由表1显示,在0、10、20、30、40 mg/kg镉浓度胁迫下,诱变新菌株J37第一潮菇子实体的平均菌柄直径分别比原菌株J1增8.4%、4.7%、5.8%、13.7%、20.5%;J37第二潮菇子实体的平均菌柄直径分别比原菌株J1增1.6%、12.9%、15.1%、19.6%、20.6%;J37第三潮菇子实体的平均菌柄直径分别比原菌株J1增5.0%、12.8%、10.1%、9.8%、19.5%;由此表明,诱变新菌株J37在镉胁迫下,3个潮次生长过程的子实体菌柄直径均优于原菌株J1。就第三潮子实体而言,在40 mg/kg的镉胁迫浓度下,虽然诱变新菌株J37菌柄直径与同浓度胁迫下第一潮子实体相比降幅达19.6%,但仍比原菌株J1在同浓度镉胁迫下第三潮子实体菌柄直径(0.287 cm)增63.8%。
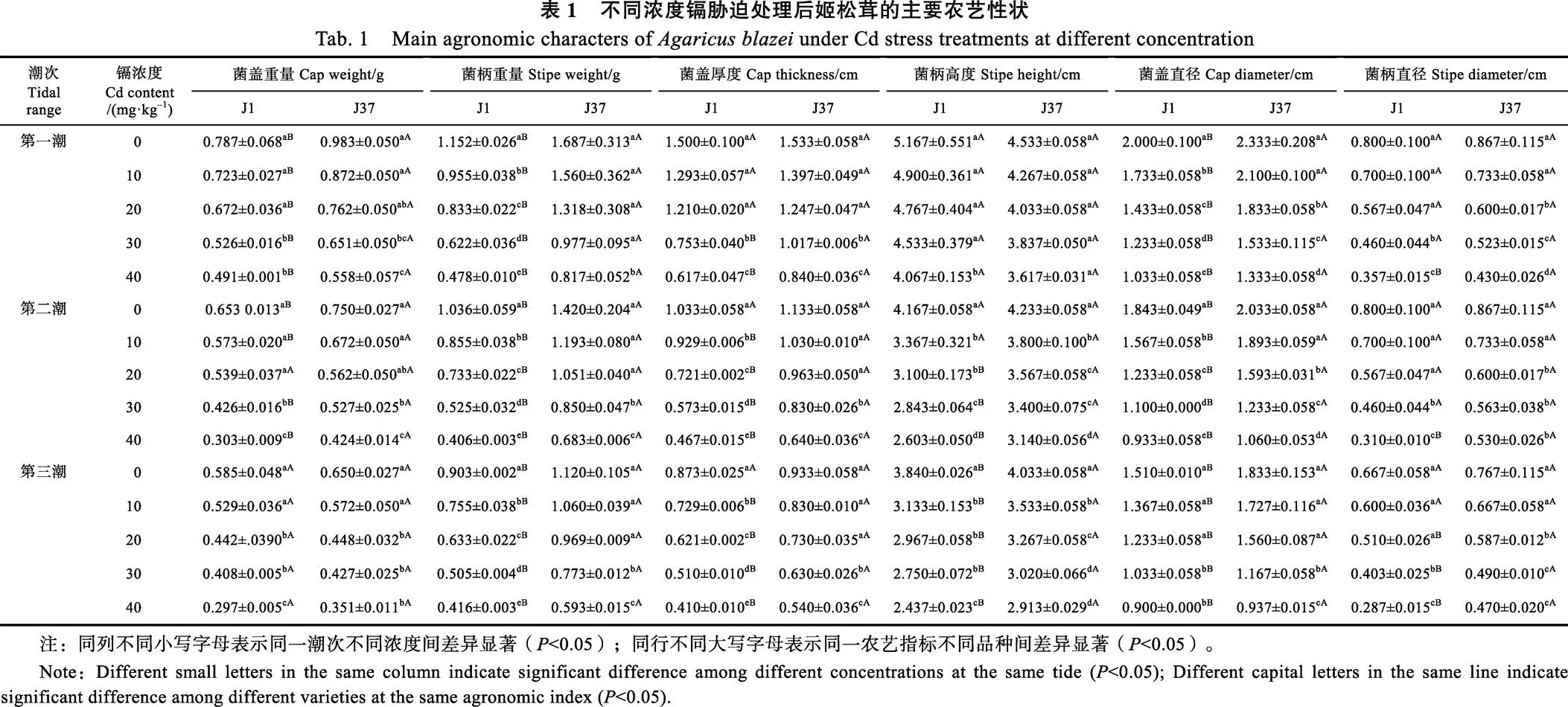
2.2 不同浓度镉胁迫处理对姬松茸不同潮次产量的影响
由图1可知,菌株J1和J37第一、二、三潮次产量均随镉浓度的增大而减小,镉浓度和产量之间呈负相关,说明高浓度镉胁迫会抑制姬松茸的生长。第一潮次中,菌株J1和J37的产量回归方程分别为=–3.90482–17.771+290.13和= –6.85712–14.59+383.8。在0、10、20、30、40 mg/kg不同浓度镉胁迫下,菌株J37产量分别比原菌株J1增32.5%、45.1%、31.0%、38.2%、36.5%,表明J37产量显著高于J1。镉浓度为10 mg/kg时,姬松茸J37产量增加率最大,达45.09%。第二潮次中,J1和J37的产量回归方程分别为= –1.52382–6.6571+111.53和=–2.66672–5.4667+ 147.73,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J37产量分别比J1增32.7%、44.7%、31.1%、38.1%、35.6%,镉浓度为10 mg/kg时,姬松茸产量增加率最大。第三潮次中,J1和J37的产量回归方程分别为=–0.57142–2.8381+ 44.6和=–1.14292–1.6762+58.533,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J37产量分别比J1增32.6%、47.1%、32.3%、39.2%、36.1%,镉浓度为10 mg/kg时,J37产量仍保持较好的生长势头,与第一潮次和第二潮次结果一致,显示较好的耐镉产量效应与生长潜力。
A:第一潮次;B:第二潮次;C:第三潮次。*表示相同处理不同品种间差异显著(P<0.05)。
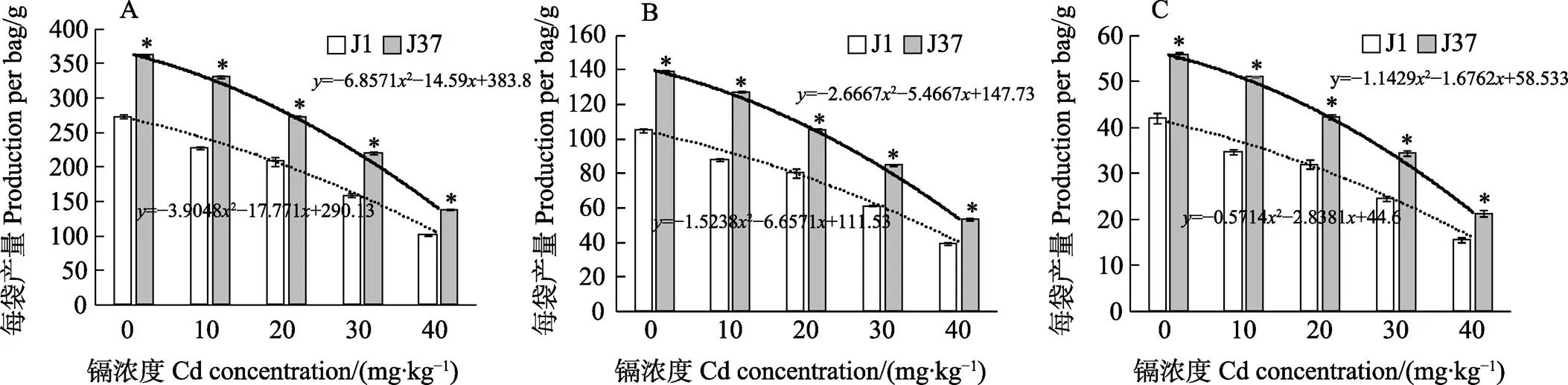
2.3 不同浓度镉胁迫处理对不同潮次姬松茸子实体粗蛋白含量的影响
由图2可知,在第一、二、三潮次中,镉浓度在0~40 mg/kg时,菌株J1和J37子实体的粗蛋白含量随镉浓度的升高而递减,呈负相关,说明镉能够抑制姬松茸细胞内的蛋白质合成途径。且在3个潮次中相同镉浓度下,J37的粗蛋白含量均高于J1。第一潮次中,J1和J37的回归方程分别为=–0.42862–0.4286+40.8和=–0.47622– 0.4762+45.6,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J37子实体的粗蛋白含量分别比J1高12.5%、10.5%、11.1%、14.6%、10.7%,镉浓度为30 mg/kg时,粗蛋白含量仍有14.6%的增长率。在第二潮次中,J1和J37的回归方程分别为=–0.33332–0.6667+38.867和=–0.07142– 2.4714+43.4,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J37子实体的粗蛋白含量分别比J1高7.9%、5.6%、4.0%、5.3%、7.4%,与第一潮次相比,粗蛋白增长率明显下降。第三潮次中,J1和J37的产量回归方程分别为=0.23812– 5.1619+43.8和=0.04762–4.019+44.4,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J37子实体的粗蛋白含量分别比J1高3.4%、7.7%、6.5%、7.7%、6.9%,J37的平均粗蛋白含量均略高于J1。
A:第一潮次;B:第二潮次;C:第三潮次。*表示相同处理不同品种间差异显著(P<0.05)。
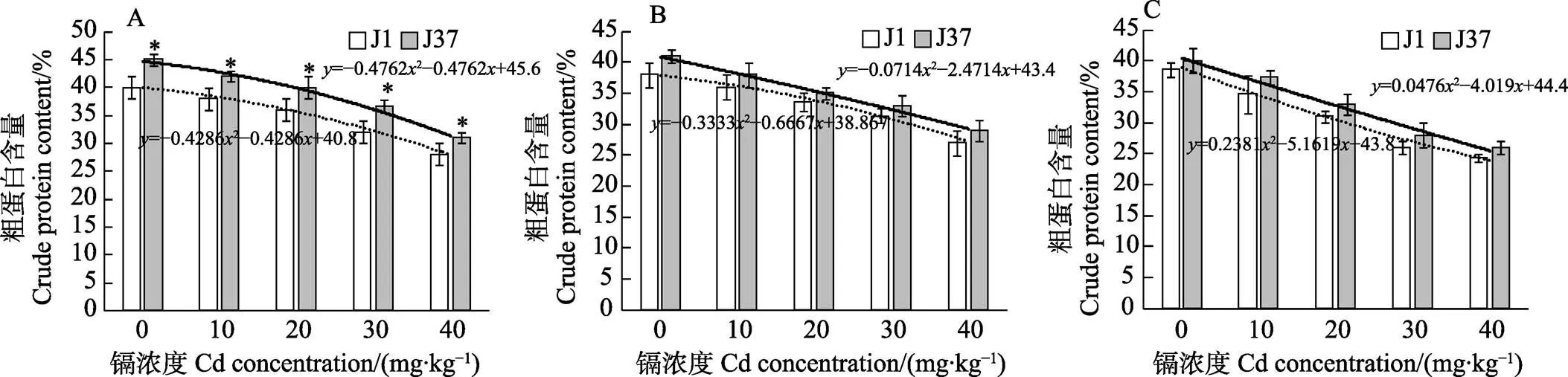
2.4 不同浓度镉胁迫处理对不同潮次姬松茸子实多糖含量的影响
由图3可知,镉浓度在0~40 mg/kg时,J1和J37姬松茸子实体多糖含量随镉浓度的升高而降低,呈负相关,表明高浓度的镉胁迫会抑制姬松茸子实体多糖的合成。在第一潮次中,J1和J37的回归方程分别为=0.01432–0.6457+6.2和=0.07622–1.2038+7.68,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J37子实体的多糖含量分别比J1增18.7%、9.8%、9.1%、8.1%、5.9%,镉浓度为0时,J37子实体的多糖含量最高。第二潮次中,J1和J37的回归方程分别为= –0.04522–0.2652+5.62和=0.09292–1.2671+ 7.4,镉浓度为0、10、30、40 mg/kg时,J37子实体的多糖含量分别比J1高17.0%、8.2%、1.9%、6.3%,而镉浓度为20 mg/kg时,J1多糖含量比J37高8.2%,说明镉浓度从10 mg/kg增加到20 mg/kg时,J37子实体的多糖含量下降17.0%,在第二潮次中降幅比较大,可以推测J37第二潮次子实体多糖代谢途径在10~20 mg/kg镉浓度区间较为敏感。第三潮次中,J1和J37的回归方程分别为=–0.052–0.31+5.52和=0.12–1.32+7.32,镉浓度为0、10、30、40 mg/kg时,J37子实体的多糖含量分别比J1高19.6%、6.3%、12.1%、14.3%,镉浓度为20 mg/kg时,J1和J37多糖含量相等,均为4.20 g/100 g。就姬松茸子实体多糖含量而言,J1与J37受镉胁迫的影响几乎相近,J37没有显示出更强的多糖转化与累积能力。
2.5 不同浓度镉胁迫处理对不同潮次姬松茸子实体镉含量的影响
由图4可知,在第一、二、三潮次中,镉浓度在0~40 mg/kg时,J1和J37姬松茸子实体的镉富集量随镉浓度的升高而增加,呈正相关,且J1的镉富集量均高于J37。相同镉浓度下,J1和J37第一、二、三潮次子实体的镉富集量均呈逐渐下降趋势。在第一潮次中,J1和J37的回归方程分别为=0.34292–0.5571+7.92和=0.10432+ 1.3283+1.754,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J1的镉富集量分别比J37高145.4%、58.5%、60.3%、16.6%、27.8%,镉浓度为0 mg/kg时,J1的镉富集量达7.6 mg/kg,远高于J37的镉富集量。第二潮次中,J1和J37的回归方程分别为=0.13572+0.3157+6.34和= 0.09052+1.0305+1.86,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J1的镉富集量分别比J37高139.3%、60.4%、60.4%、27.4%、22.6%。第三潮次J1和J37的回归方程分别为=0.07862+ 0.5586+4.96和=0.09432+0.8223+2.018,在0、10、20、30、40 mg/kg不同浓度镉胁迫下,J1的镉富集量分别比J37高110.3%、32.6%、52.0%、25.4%、12.8%,表明J37抵制镉吸收的能力强于J1,是一个较好耐镉品种。
A:第一潮次;B:第二潮次;C:第三潮次。*表示相同处理不同品种间差异显著(P<0.05)。
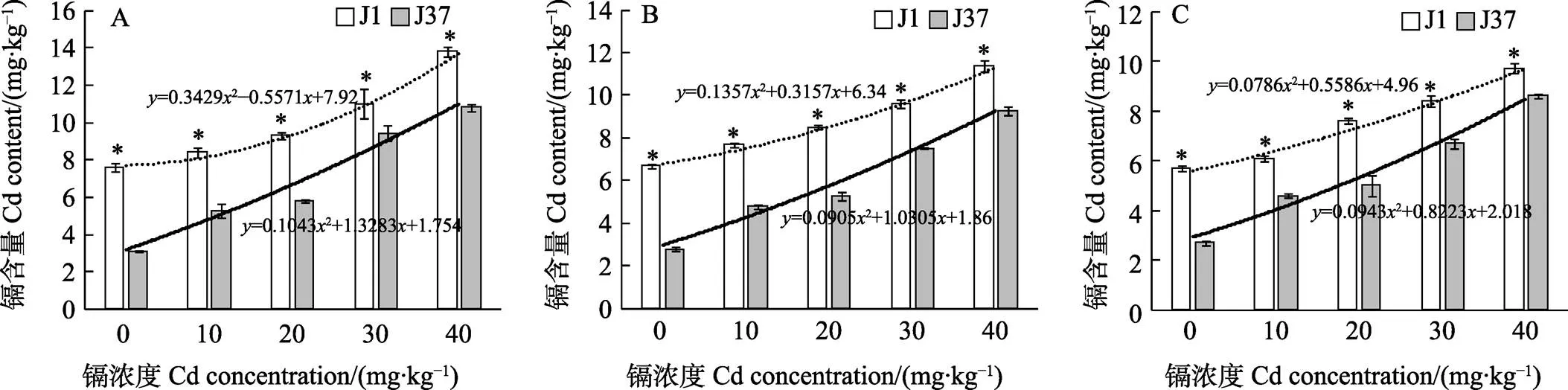
A:第一潮次;B:第二潮次;C:第三潮次。*表示相同处理不同品种间差异显著(P<0.05)。
2.6 10、20 mg/kg镉胁迫处理下不同浓度CaSO4对子实体产量的影响
J1和J37在10 mg/kg镉胁迫处理下,施用0、15、30、45、60 mg/kg CaSO4,J1和J37姬松茸产量呈先升后降的趋势;J1和J37的回归方程分别为=–9.57142+79.962+143和=–5.8812+ 41.652+462.27,J37子实体的产量分别比J1高122.8%、117.0%、73.0%、69.7%、75.3%,施用45 mg/kg CaSO4对镉胁迫毒害的缓解作用最佳,J1和J37的产量分别为326.67 g/m2和554.33 g/m2。J37在10 mg/kg镉胁迫处理下,施用0~60 mg/kg CaSO4对J37子实体的产量影响较小。与0 mg/kg CaSO4相比,施用15 mg/kg CaSO4后的J37产量下降1.2%,说明不施钙肥与施用15 mg/kg CaSO4对J37姬松茸子实体产量的影响效果不显著(图5A)。
J1和J37在20 mg/kg镉胁迫处理下,施用0、15、30、45、60 mg/kg CaSO4,J1和J37姬松茸产量呈先增后降的趋势。施用45 mg/kg CaSO4对镉胁迫毒害的缓解作用最明显,此时J1和J37产量达到最大值,回归方程分别为=–3.16672+ 20.433+299.27和=–2.97622+20.757+399.13,施用0、15、30、45、60 mg/kg CaSO4后,J37产量分别比J1高31.6%、31.1%、31.2%、31.0%、33.2%(图5B)。
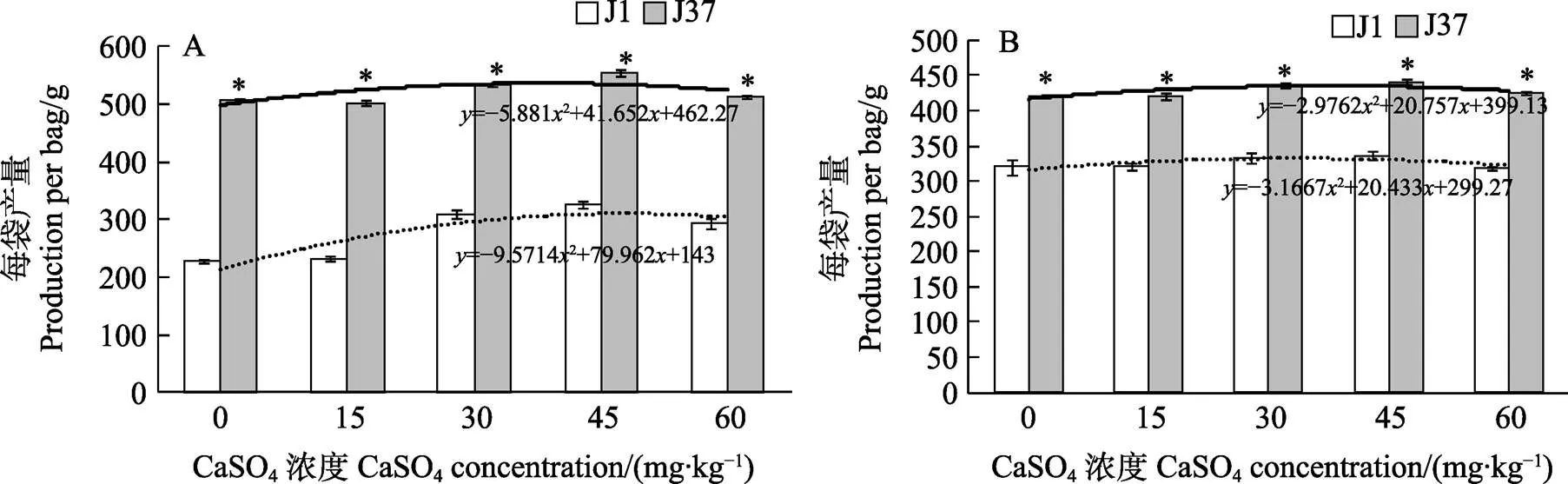
A:10 mg/kg镉胁迫处理;B:20 mg/kg镉胁迫处理。*表示相同处理不同品种间差异显著(P<0.05)。
2.7 10、20 mg/kg镉胁迫处理下不同浓度CaSO4对子实体镉含量的影响
J1和J37在10 mg/kg镉胁迫处理下,施用0、15、30、45、60 mg/kg CaSO4,J1和J37姬松茸的镉富集量均随CaSO4浓度的升高而呈下降趋势,表明CaSO4对镉富集具有显著的缓解作用。J1和J37的回归方程分别为=0.08572–1.0143+ 9.42和=0.04292–0.5571+5.8867,施用0、15、30、45、60 mg/kg CaSO4,J1的镉富集量分别比J37高58.5%、55.9%、54.3%、57.3%、54.7%,说明施钙对J37的防控效果较好,其子实体镉含量明显低于J1(图6A)。
J1和J37经过20 mg/kg镉胁迫处理后,施用0、15、30、45、60 mg/kg CaSO4,J1和J37姬松茸镉富集量均呈先降后增的趋势,在CaSO4浓度为45 mg/kg时,J1和J37的镉富集量最低,分别为7.83 mg/kg和4.60 mg/kg,对镉胁迫的毒害缓解作用最好。施用45 mg/kgCaSO4时,J1和J37的镉富集量分别比不施CaSO4处理低14.9%和17.9%,镉胁迫的毒害缓解作用良好。J1和J37的回归方程分别为=0.16672–1.22+10.38和=0.1312–0.929+6.4467,施用0、15、30、45、60 mg/kg CaSO4,J1的镉富集量分别比J37高64.3%、71.0%、67.1%、70.3%、66.5%,表明在施钙条件下,J37的镉富集量明显低于J1(图6B)。
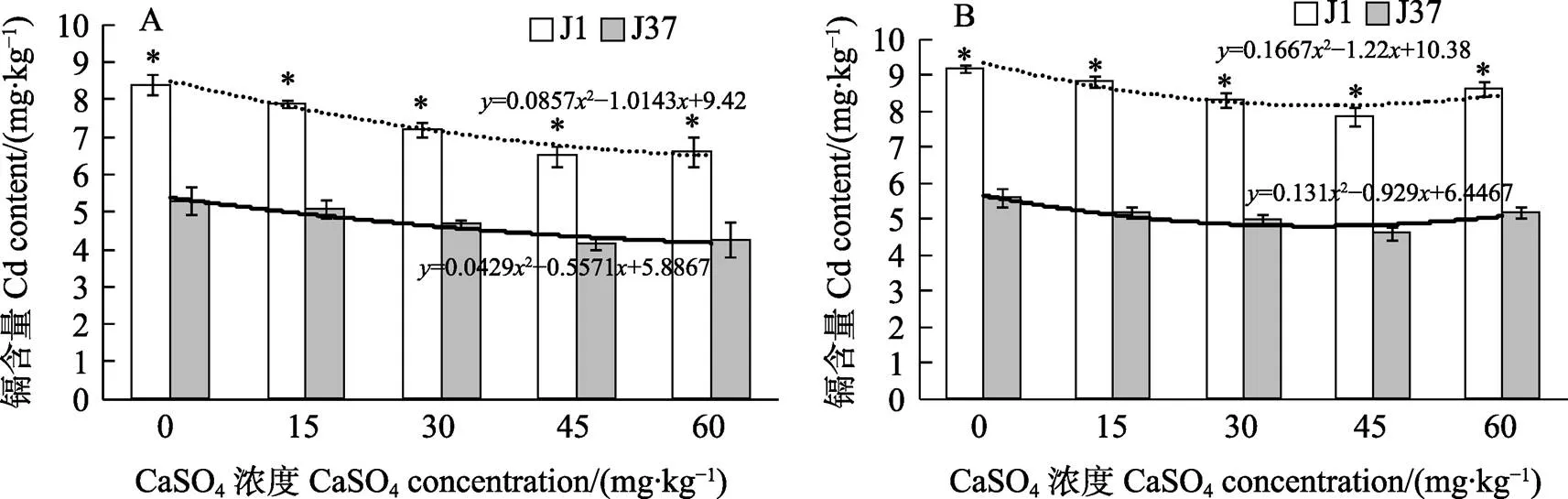
A:10 mg/kg镉胁迫处理;B:20 mg/kg镉胁迫处理。*表示相同处理不同品种间差异显著(P<0.05)。
3 讨论
对外源镉胁迫处理与2个菌株子实体农艺性状进行分析表明,J1与J37子实体各农艺性状与外源镉浓度之间均呈负相关,表现为随着外源镉浓度的增加,2个菌株子实体的生长明显受到镉胁迫的抑制,各生长指标均呈下降趋势;其中J1的子实体各农艺性状降幅大于J37,说明J1子实体的生长受镉的抑制作用大于J37子实体。作为直观的判断指标应该为单个子实体重量(菌盖重量+菌柄重量),该指标是生产实践的关键农艺要素,菌盖直径与菌柄直径可作为判断姬松茸是否受镉毒害的参考指标。
姬松茸生长过程对镉较为敏感已在生产实践中被证实[12-13],要避免姬松茸镉污染或者镉超标所造成危害与损失,除了着力选育低镉姬松茸新品种之外,还需深入探讨姬松茸生长过程中的镉吸收与富集机理,尤其是阐明影响姬松茸生长势-镉危害之间的内在关系及其动态响应具有重要意义[14-15]。本研究表明,在10 mg/kg镉胁迫浓度时,对姬松茸农艺性状、产量、镉含量开始产生一定影响,但耐镉品种(J37)则仍保持较好的生长势头,这可能是低镉条件下对J37菌丝、子实体细胞的刺激效应所引发的短期行为,待镉元素吸收并逐步累积,其对农艺性状、产量以及镉含量的影响很快就显现出来[16],因而需要进一步探讨镉的胁迫和积累对细胞结构的影响[17-18],同时要深入研究镉的胁迫对姬松茸生长过程酶系统动态变化的影响[19],并进行多因素相关分析,进而有目的或者有针对性地开展分子生物学研究,力求从基因组水平阐明内在关系[20],并确定精准的诊断指标,为姬松茸高产优质育种提供科学依据。而合理施用钙肥对姬松茸受镉胁迫的毒害产生一定的防控作用,推测可能是由于姬松茸对元素吸收的选择性或者引发拮抗作用所致,而在姬松茸生长过程中钙对镉的阻控作用,则较少文献报道,本项目组正深入开展相关研究工作,将进一步验证其内在机制并报道相关研究进展。
4 结论
(1)不同浓度镉胁迫处理(0、10、20、30、40 mg/kg)对姬松茸J37和J1子实体农艺性状的影响有差异。随外源镉浓度的增加,其菌盖重量、菌盖厚度、菌盖直径、菌柄重量、菌柄长度、菌柄直径等6个指标均呈先略增后降的趋势,且相同镉浓度胁迫下,J37比J1下降幅度低;单个子实体重量(菌盖重量+菌柄重量)是直接影响姬松茸产量的主要农艺指标,单个子实体重量下降,或者菌盖变小、菌柄细长可以作为姬松茸受镉胁迫危害的表征与初步判断依据。其内在机制与便捷诊断方法仍有待进一步深入探讨。
(2)在0、10、20、30、40 mg/kg镉浓度时,J1和J37姬松茸第一、二、三潮次产量随镉浓度的增大而下降,镉浓度和产量之间呈负相关,说明高浓度的镉胁迫会抑制姬松茸的生长。不同镉浓度胁迫下,J37第一、二、三潮子实体产量均高于J1,表明J37的耐镉害的产量效应优于J1。研究结果显示,栽培基质中镉浓度达20 mg/kg时,姬松茸第一、二、三潮次产量下降幅度均超过40.0%,推测镉浓度20 mg/kg是姬松茸耐受镉毒害的敏感节点。
(3)镉浓度在0、10、20、30、40 mg/kg时,J1和J37姬松茸子实体的粗蛋白、多糖含量随着镉浓度的增加而递减,镉浓度与粗蛋白含量、多糖含量呈负相关,说明镉能抑制姬松茸细胞内的蛋白质和多糖的合成;不同镉浓度胁迫下,J37第一、二、三潮次子实体粗蛋白含量均高于J1;镉胁迫对J1、J37蛋白品质影响敏感点分别为10、20 mg/kg。不同镉浓度胁迫下,J37第一潮次的子实体多糖含量均高于J1,但从第二潮次开始,当镉浓度为20 mg/kg时,J1多糖含量比J37高8.2%,说明镉浓度从10 mg/kg增加到20 mg/kg时,J37多糖含量下降,可以推测J37第二潮次子实体多糖的代谢途径对10~20 mg/kg镉浓度较为敏感。在第一、二、三潮次中,镉浓度在0~40 mg/kg时,J1和J37姬松茸子实体的镉富集量随镉浓度的增大而增加,呈正相关,且J1的镉富集量均高于J37。在相同镉浓度胁迫下,J1和J37第一、二、三潮次子实体的镉富集量均呈递减趋势,即姬松茸镉富集量第一潮次>第二潮次>第三潮次。
(4)合理施用钙肥对姬松茸受镉胁迫毒害有一定的缓解作用与防控效果。在10 mg/kg镉胁迫处理后,施用0、15、30、45、60 mg/kg CaSO4,J1和J37姬松茸产量均呈先升后降的趋势;J1和J37的产量回归方程分别为=–9.57142+79.962+ 143和=–5.8812+41.652+462.27,J37子实体的产量高于J1,施用45 mg/kg CaSO4对镉胁迫毒害的缓解作用最佳,J1和J37产量分别为326.67 g/m2和554.33 g/m2。在20 mg/kg胁迫处理后,施用0、15、30、45、60 mg/kg CaSO4,J1和J37姬松茸的镉富集量呈先降后增的趋势,在CaSO4浓度为45 mg/kg时,J1和J37的镉富集量最低,分别为7.83 mg/kg和4.60 mg/kg,对镉胁迫的毒害缓解作用最好。施用45 mg/kg CaSO4时,J1、J37姬松茸镉富集量分别比不施CaSO4处理低14.9%、17.9%,镉胁迫的毒害缓解作用比较明显;施钙肥对镉胁迫毒害的平均防控率分别达36.2%、47.6%。
(5)姬松茸耐受生长基质镉胁迫浓度要控制在10 mg/kg以内;防控姬松茸生产过程镉污染或者镉超标的关键点,除了选择耐镉危害以及能阻控镉吸收累积的品种外,还应选择低镉栽培原料与覆盖土壤,力求从源头上抓好姬松茸的质量安全与绿色生产。
[1] 张玉秀, 于 飞, 张媛雅, 宋小庆. 植物对重金属镉的吸收转运和累积机制[J]. 中国生态农业学报, 2008, 16(5): 1317-1321.
ZHANG Y X, YU F, ZHANG Y Y, SONG X Q. Absorption transport and accumulation mechanism of heavy metal cadmium by plants[J]. Chinese Journal of Eco-Agriculture, 2008, 16(5): 1317-1321. (in Chinese)
[2] 刘 强, 张婉秋, 周贵宇, 梁 雷, 白晓亮, 陈 杨. 辽河干流坝间耕地土壤重金属污染特征研究[J]. 中国生态农业学报, 2017, 25(10): 1545-1553.
LIU Q, ZHANG W Q, ZHOU G Y, LIANG L, BAI X L, CHEN Y. Characterization of heavy metal pollution of arable soils between dry flow dams in Liaohe, China[J]. Chinese Journal of Eco-Agriculture, 2017, 25(10): 1545-1553. (in Chinese)
[3] 林 杰, 蔡丹凤, 王雪英. 食用菌珍品——姬松茸[J]. 福建农业, 1995(8): 10.
LIN J, CAI D F, WANG X Y. Edible mold -[J]. Fujian Agriculture, 1995(8): 10. (in Chinese)
[4] 李三暑, 江枝和, 颜明娟, 郑永标, 黄乃江, 杨佩玉. 福建省姬松茸菇镉污染状况及其防治[J]. 江西农业大学学报, 2000, 22 (1): 94-97.
LI S S, JIANG Z H, YAN M J, ZHENG Y B, HUANG N J, YANG P Y. The situation of cadmium pollution inMurrill and its prevention & control in Fujian Province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2000, 22(1): 94-97. (in Chinese)
[5] 刘朋虎, 赖瑞联, 陈 华, 王义祥, 翁伯琦. 镉对食用菌生长的影响及防控技术研究进展[J].生态环境学报, 2019, 28(2): 419-428.
LIU P H, LAI R L, CHEN H, WANG Y X, WENG B Q. Effects of Cd on edible fungi growth and Cd pollution prevention and control techniques in mushroom production[J]. Ecology and Environmental Sciences, 2019, 28(2): 419-428. (in Chinese)
[6] 刘朋虎, 李 波, 江枝和, 王义祥, 翁伯琦. 姬松茸菌株J1与J77镉富集差异及生理响应机制[J]. 农业环境科学学报, 2017, 36(5): 863-868.
LIU P H, LI B, JIANG Z H, WANG Y X, WENG B Q. Comparison and physiological mechanisms of cadmium (Cd) accumulation by strain J1 and mutant J77 of[J]. Journal of Agro-Environment Science, 2017, 36(5): 863-868. (in Chinese)
[7] 刘朋虎, 李 波, 江枝和, 雷锦桂, 翁伯琦, 黄在兴. 镉对姬松茸农艺性状及矿物质元素吸收的影响[J]. 农业环境科学学报, 2018, 37(1): 58-63.
LIU P H, LI B, JIANG Z H, LEI J G, WENG B Q, HUANG Z X. Effects of cadmium (Cd) in different concentrations on agronomic traits and mineral elements absorption of[J]. Journal of Agro-Environment Science, 2018, 37(1): 58-63. (in Chinese)
[8] 徐丽红, 何莎莉, 吴应淼, 叶长文, 张永志, 王钢军. 姬松茸对有害重金属镉的吸收富集规律及控制技术研究[J]. 中国食品学报, 2010, 10(4): 152-158.
XU L H, HE S L, WU Y M, YE C W, ZHANG Y Z, WANG G J. Study on the absorption and accumulation of cadmium by[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(4): 152-158. (in Chinese)
[9] 林戎斌. 镉在姬松茸生产中迁移、分布规律及降低镉含量措施的研究[D]. 福州: 福建农林大学, 2011.
LIN R B. Study on migration and distribution of cadmium inproduction and measures to reduce cadmium content[D]. Fuzhou: Fujian Agriculture and Forestry University, 2011 (in Chinese)
[10] 李 波. 镉胁迫下两个姬松茸品种生长及镉富集特性研究[D]. 福州: 福建农林大学, 2016.
LI B. Growth and cadmium accumulation characteristics of twoMurrill varieties under cadmium stress[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016. (in Chinese)
[11] 李春香, 韩 娟, 徐小慧, 侯延民. 乙醇-硫酸铵双水相萃取-火焰原子吸收光谱法测定镉[J]. 冶金分析, 2009, 29(9): 60-65.
LI C X, HAN J, XU X H, HOU Y M. Determination of cadmium by ethanol-ammonium sulfate two-phase extractioncombined with flame atomic absorption spectrometr[J]. Metallurgical Analysis, 2009, 29(9): 60-65. (in Chinese)
[12] 陈智慧, 史 梅, 王秋香, 张晓红. 用凯氏定氮法测定食品中的蛋白质含量[J]. 新疆畜牧业, 2008(5): 22-24.
CHEN Z H, SHI M, WANG Q X, ZHANG X H. Determination of protein content in food by Kjeldahl method[J]. Animal Husbandry of Xinjiang, 2008(5): 22-24. (in Chinese)
[13] 苏家杰, 李 盎, 孙家豪, 黄华铖, 王 波. 紫外可见分光光度计测定竹荪中粗多糖含量的不确定度评价[J]. 广州化学, 2020, 45(2): 28-33.
SU J J, LI A, SUN J H, HUANG H C, WANG B. Evaluation of uncertainty in determination of crude polysaccharide content in dictyophora indusiata by UV-Vis spectrophotometer[J]. Guangzhou Chemistry, 2020, 45(2): 28-33. (in Chinese)
[14] 施巧琴, 林 琳, 陈哲超, 陈松生, 谢必峰, 吴松刚, 陈静仪, 柯毅龙, 李贤明, 林 园. 重金属在食用菌中的富集及对其生长代谢的影响[J]. 菌物学报, 1991, 10(4): 301-311.
SHI Q Q, LIN L, CHEN Z C, CHEN S S, XIE B F, WU S G, CHEN J Y, KE Y L, LI X M, LIN Y. Accumulation of heavy metals in edible fungi and its effect on growth and metabolism[J]. Mycosystema, 1991, 10(4): 301-311. (in Chinese)
[15] 刘高翔, 杨美智子, 刘洋铭, 庄永亮, 孙丽平. 食用菌对镉的富集作用及其机理的研究概况[J]. 食品工业科技, 2012, 33(13): 392-394.
LIU G X, YANG M Z Z, LIU Y M, ZHUANG Y L, SUN L P. The bioaccumulation characteristics and mechanisms of cadmium in edible mushrooms[J]. Science and Technology of Food Industry, 2012, 33(13): 392-394. (in Chinese)
[16] MELGAR M J, ALONSO J, PÉREZ-LÓPEZ M, GARCÍA M A. Influence of some factors in toxicity and accumulation of cadmium from edible wild macrofungi in northwest Spain[J]. Journal of Environmental Science and Health, Part b: Pesticides, Food Contaminants & Agricultural Wastes, 1998, 33(4): 439-455.
[17] 黄敏敏, 江枝和, 翁伯琦, 王义祥. 镉对姬松茸菌丝体细胞超微结构的影响[J]. 热带作物学报, 2011, 32(6): 1082-1085.
HUANG M M, JIANG Z H, WENG B Q, WANG Y X. The effect of cadmium on mycelial ultrastructure ofMurill[J]. Chinese Journal of Tropical Crops, 2011, 32(6): 1082-1085. (in Chinese)
[18] 李三暑, 雷锦桂, 陈惠成. 镉、磷、钙在姬松茸细胞内的积累和分布特征及其交互作用[J]. 食用菌学报, 2001, 8(4): 24-27.
LI S S, LEI J G, CHEN H C. Accumulation and distribution of cadmium, phosphorus and calcium and their interaction incells[J]. Acta Edulis Fungi, 2001, 8(4): 24-27. (in Chinese)
[19] 李 波, 刘朋虎, 江枝和, 王义祥, 翁伯琦. 外源镉胁迫对姬松茸菌丝生长及其酶活性的影响[J]. 热带作物学报, 2016, 37(3): 456-460.
LI B, LIU P H, JIANG Z H, WANG Y X, WENG B Q. Effects of exogenous cadmium stresses on the mycelium growthand enzyme activity ofMurill[J]. Chinese Journal of Tropical Crops, 2016, 37(3): 456-460. (in Chinese)
[20] 刘高磊. 中国香菇重要性状的全基因组关联分析[D]. 武汉: 华中农业大学, 2017.
LIU G L. Genome wide association analysis of important characters in[D]. Wuhan: Huazhong Agricultural University, 2017. (in Chinese)
Effects of Cadmium Stress on Yield and Cadmium Absorption ofand Its Control Techniques
CHEN Hua1,3, LIU Penghu2,3, YE Jing1,3, LIN Yi1,3, WENG Boqi1,3, WANG Yixiang1,3*
1. Agricultural Ecology Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China; 2. National Research Center of Fungus Engineering Technology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 3. Fujian Key Laboratory of Agro-ecological Processes in Red Soil Hilly Region, Fuzhou, Fujian 350003, China
Cadmium (Cd) accumulation is an important problem influencingindustry. Therefore, breeding low-Cd content varieties and exploring Cd prevention and control technology inwere of great importanceIn this study, the effect of Cd on their yield and cadmium absorption of two varieties ofJ37 and J1 under Cd stress treatments were investigated. The effect of CaSO4application on cadmium absorption ofalso was investigated. The effects of different Cd stress treatments on the traits of fruit bodies of J37 and J1strains. With the increase of exogenous Cd concentration, the pileus weight, stipe weight, pileus thickness, pileus diameter, stipe length, and stipe diameter decreased, respectively. The yield of J37 under different Cd stress increased by 32.5%, 45.1%, 31.0%, 38.2% and 36.5% than those of J1 in the first tides, respectively. Moreover, the yield of J37 was also higher than that of J1 in the second and third tides. The sensitive Cd concentration on protein quality of J1 and J37 was 10 mg/kg and 20 mg/kg, respectively. Under 20 mg/kg Cd treatment, the polysaccharide content of J1 was 8.2% higher than that of J37. But the Cd accumulation in J1 was all higher than that of J37 with the increase of Cd stress. Under the conditions of 10 mg/kg and 20 mg/kg Cd stress, the effects of CaSO4application with 45 mg/kgon cadmium poisoning of J1 and J37 were the most obvious. The average control rate of cadmium poisoning by applying calcium fertilizer was 36.2% and 47.6%, respectively. Under the conditions of this experiment, 20 mg/kg cadmium content in the culture was the sensitive node ofto tolerate cadmium poisoning, and the yield ofdecreased by more than 40.0% in the first tide. When the Cd concentration in the culture was less than 10 mg/kg,could tolerate Cd stress. Results also showed that the weight or cap diameter or stalk diameter might be used as a direct indicator for judging the Cd toxicity.
Murill; cadmium stress; sporocarp; agronomic trait; yield; cadmium content
X173;S646
A
10.3969/j.issn.1000-2561.2022.12.009
2022-04-01;
2022-07-19
中央引导地方科技项目(No. 2021L3021);福建省科技厅农业引导性项目(No. 2020N0007);福建省红壤山地农业生态过程重点实验室开放课题(No. Aephrs-202001)。
陈 华(1976—),男,硕士,副研究员,研究方向:生态农业。*通信作者(Corresponding author):王义祥(WANG Yixiang),E-mail:sd_wolong@163.com。
