丙酸睾酮对三疣梭子蟹氨基酸和脂肪酸组成的影响
2023-01-16陈清伟张伟仁李庆龙李荣华母昌考王春琳宋微微
陈清伟 张伟仁 李庆龙 李荣华,3,* 母昌考,3 王春琳,3 宋微微,3
(1宁波大学海洋学院应用海鲜生物技术教育部重点实验室,浙江宁波 315211;2浙江海洋高效健康养殖协同创新中心,浙江宁波 315211;3农业农村部绿色海水养殖重点实验室(省部共建),浙江宁波 315211)
类固醇激素在维持生命、调控生殖功能、机体发育等方面具有重要作用[1]。雄激素是一类含有雄烷基结构的类固醇类物质的总称,由19个碳原子构成[2]。已有研究表明,雄激素是脊椎动物生物体脂质代谢[3]、脑神经调节[4]和生殖发育[5]重要的参与者。
在脊椎动物的脂肪代谢中,雄激素与雄激素受体结合后会直接或间接影响脂肪细胞的增殖分化、脂肪分解等,使得生物体脂肪含量发生改变[6]。睾酮(testosterone,T)可通过增强线粒体能量代谢来降低脂肪含量[7]。雄激素对蛋白质代谢也具有重要作用,在雄激素受体介导下,雄激素可促进骨骼肌蛋白质合成及肌肉质量增长[8]。丙酸睾酮(testosterone propionate,TP)是以17β丙酸酯形式合成的睾酮衍生物,在脊椎动物血浆中可迅速被水解成游离睾酮,发挥雄激素调节功能[9]。有研究发现,阉割后的小鼠精囊大部分氨基酸浓度显著提高,但经丙酸睾酮注射后可恢复正常[10]。目前,已在拟穴青蟹(Scylla paramamosain)[11]、巴伦支海红帝王蟹(Paralithodes camtschaticus)[12]和中华绒螯蟹(Eriocheir sinensis)[13]等多种甲壳动物中检测到雌、雄性激素的存在,且性激素含量随生长发育呈波动变化。但关于性激素对甲壳动物氨基酸和脂肪酸代谢方面影响的研究较少。
三疣梭子蟹(Portunus trituberculatus)属于节肢动物门(Arthropoda),甲壳纲(Crustacea),十足目(Decapoda),梭子蟹科(Portunidae),是我国重要的经济蟹类。目前,关于三疣梭子蟹体内的性激素种类及其发挥的作用尚鲜有报道。本研究比较了投喂含不同水平丙酸睾酮的饲料对三疣梭子蟹氨基酸和脂肪酸组成的影响,以期为外源性激素对无脊椎动物氨基酸和脂肪酸代谢影响的相关研究提供基础资料。
1 材料与方法
1.1 材料与试剂
试验用三疣梭子蟹蟹苗于2021年6月购自浙江省宁波市奉化区臭皮匠水产养殖场,选取健康的450只Ⅰ期三疣梭子蟹幼蟹,购回后用盐度22的消毒海水暂养。试验饲料为天邦全熟化配合饲料,购自广东天邦饲料科技有限公司(风干基础:粗蛋白40%、粗脂肪6%、粗纤维5%、粗灰分18%、总磷1.2%、赖氨酸2%、水12%);试验用丙酸睾酮购自上海麦克林生化科技有限公司,其有效成分的质量分数为98%(以C22H32O3计)。
1.2 主要仪器
2AB电热鼓风干燥机,天津泰斯特仪器有限公司;LX0711箱式高温电阻炉,天津莱玻特瑞仪器设备有限公司;NAI-6索氏抽提脂肪测定仪,上海那艾实验仪器有限公司;KA-1A自动定氮仪,上海本昂科学仪器有限公司;1290-6460液相色谱质谱联用仪、1260高效液相色谱仪,美国Agilent公司;BR4I离心机、Trace1310 ISQ气相色谱-质谱仪,美国Thermo Fisher Scientific公司。
1.3 试验方法
1.3.1 饲料制作将丙酸睾酮粉末溶于无水乙醇中,在饲料表面均匀喷洒,制备成浓度为200(TP 200)和400 mg·kg-1的丙酸睾酮饲料(TP 400),对照组(TP 0)不添加丙酸睾酮粉末,在干燥阴凉处自然通风过夜晾干,使酒精充分挥发。于-20℃条件下干燥密封保存备用。
1.3.2 喂养试验选择规格整齐、活力好的C1期三疣梭子蟹450只[初始体质量(0.02±0.00)g],随机分成3个试验组,设1个对照组和2个处理组,每个试验组均设3个重复组,每个重复投放50只幼蟹,养殖于9个绿色帆布池(长×宽×高=150 cm×100 cm×60 cm)中,每一只幼蟹均有独立的养殖筐(图1)。对照组投喂经无水乙醇处理后未添加丙酸睾酮的试验饲料,试验组分别投喂含有200和400 mg·kg-1丙酸睾酮的饲料,养殖周期为90 d。试验期间,每天按体质量的5%投喂饲料,根据前一天的摄食量调整投喂量,并于60 min后将残饵清理干净。每天08:00和15:00各投喂1次,并记录蜕壳情况。试验期间对角充氧,各组试验水体每天换水量为30%(废水收集由专人处理)。盐度维持在22~23,平均水温为20~25℃,溶解氧高于6.0 mg·L-1,pH值为7.0~7.5,氨氮含量低于0.10 mg·L-1,亚硝酸盐氮含量低于0.01 mg·L-1。试验结束后,每只个体均先测量生长指标后取血清、肌肉和肝胰腺。血清于4℃过夜24 h后,离心取得上清储存于-80℃冰箱,其余样品取得后立即放入-80℃冰箱储存,用于相关指标测定。

图1 三疣梭子蟹养殖设施Fig.1 Equipment of P.trituberculatus culture
1.3.3 生长及表观性状的测定按照高天龙等[14]的测量方法,随机挑选各组存活个体逐一用游标卡尺测量全甲宽(full carapace width,FCW)、甲宽(carapace width,CW)、体长(body length,BL)、体高(body height,BH)、大 螯 长 节 长(fixed finger length of the claw,FFLC)、大螯不动指长(meropodit length of the claw,MLC)和第一步足长节长(meropodit length of the first peraeopod,MLFP),精确到0.01 mm;用电子天平称量体重(body weight,BW),精确到0.01 g。根据测定的数据计算增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、肝胰腺指数(hepatosomatic index,HIS);根据统计的三疣梭子蟹死亡情况计算成活率(survival rate,SR)。各指标计算公式[15]如下:
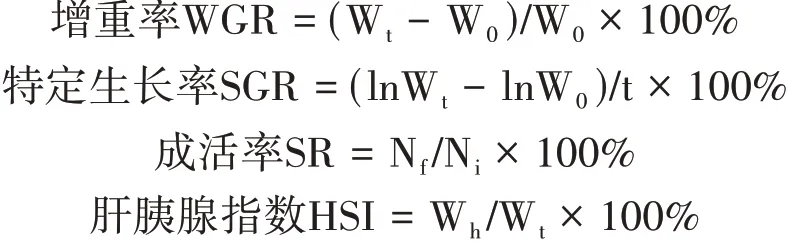
式中,W0、Wt分别为三疣梭子蟹的初始体质量和终末体质量,g;Wh为肝质量,g;Nf、Ni分别为试验开始和结束时三疣梭子蟹的尾数;t为养殖天数,d。
1.3.4 体组成含量测定肌肉和肝胰腺的水分含量按照常压干燥法测定[16];粗蛋白含量按照凯氏定氮法测定[17];粗脂肪含量采用索氏抽提法测定[18];粗灰分含量采用第一法测定[19]。
1.3.5 血清性激素含量测定采用液相色谱质谱联用仪测定梭子蟹血清中的TP、T和雌二醇(estradiol,E2)含量。移取100µL样品,加100µL乙腈溶液,涡旋,4℃、15 000 r·min-1条件下离心10 min,取上清用50µL初始流动相稀释,过膜上机测定。色谱参数:C18色谱柱(50 mm×2.1 mm,1.8 µm),柱温35℃,流动相A为0.1%甲酸-水,流动相B为乙腈,梯度洗脱条件为0~0.5 mm,70% A,3% B;0.5~3.5 min,40% A,60% B;3.5~4.5 min,10% A,90% B;4.5~6.5 min,10% A,90% B;6.5~6.6 min,70% A,30% B。进样量5 µL,流速0.3 mL·min-1。
1.3.6 氨基酸含量测定氨基酸含量测定参考《GB/T 5009.124-2016食品安全国家标准食品中氨基酸含量的测定》[20],在水解管中放入适当质量的样品,加入20 mL 6 mol·L-1的HCl溶 液,采 用 高 效 液 相 色 谱 仪测定。
1.3.7 脂肪酸含量测定脂肪酸含量测定参考刘磊等[21]的方法,称取适当质量的样品,以十九烷酸甲酯为内标,通过气相色谱-质谱仪测定。
1.4 数据分析
使用SPSS 19.0软件进行数据处理,采用Levene法对所有数据进行方差齐性检验,当不满足齐性方差时对百分比数据进行反正弦或平方根处理。采用单因素方差分析(One-Way ANOVA)检验方法比较不同处理组的差异,P<0.05表示差异显著。试验数据以平均值±标准差(mean±SD)表示。采用Graphpad Prism 8软件绘图。
2 结果与分析
2.1 血清激素含量变化
由表1可知,对照组和试验组血清中均未检测出TP,且对照组血清中未检出T和E2。试验组T和E2含量均随饲料中TP添加水平的提高而升高,且T含量高于E2含量。

表1 不同丙酸睾酮水平下三疣梭子蟹血清中激素含量Table 1 Serum hormoneof P.trituberculatus at different testosterone propionate levels /(μg·L-1)
2.2 三疣梭子蟹生长、存活指标和蜕壳间期比较
由表2可知,TP饲料投喂对三疣梭子蟹的生长和成活均产生显著影响(P<0.05)。TP 200组WGR和SGR显著高于对照组,TP 400组显著低于对照组。蜕壳间期分析结果表明(表3),TP 200组蜕壳间期最短,仅TP 200组与TP 400组在Ⅵ~Ⅶ期蜕壳间期有显著差异(P<0.05),其余各时期不同处理间的蜕壳间期均无显著差异。由表4可知,TP对三疣梭子蟹各形态性状产生了不同影响,TP 200组多项生长指标显著高于对照组及TP 400组。
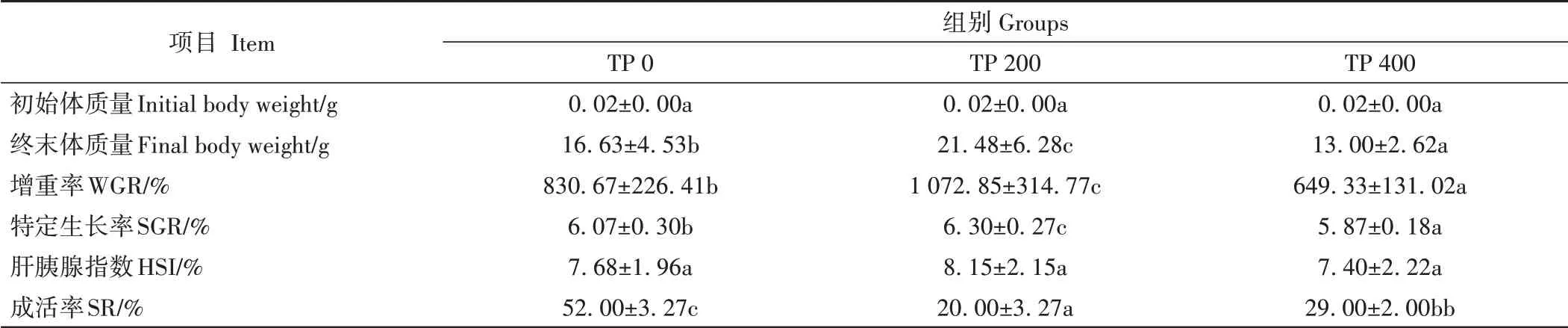
表2 不同丙酸睾酮水平下三疣梭子蟹生长和成活比较Table 2 Comparison of growth and survival of P.trituberculatus at different testosterone propionate levels
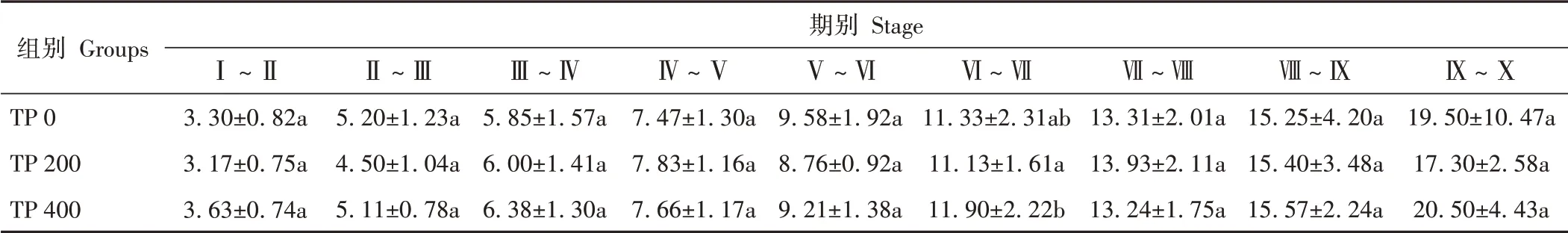
表3 不同丙酸睾酮水平下三疣梭子蟹蜕壳间期Table 3 Molting interphase of P.trituberculatus at different testosterone propionate levels /d
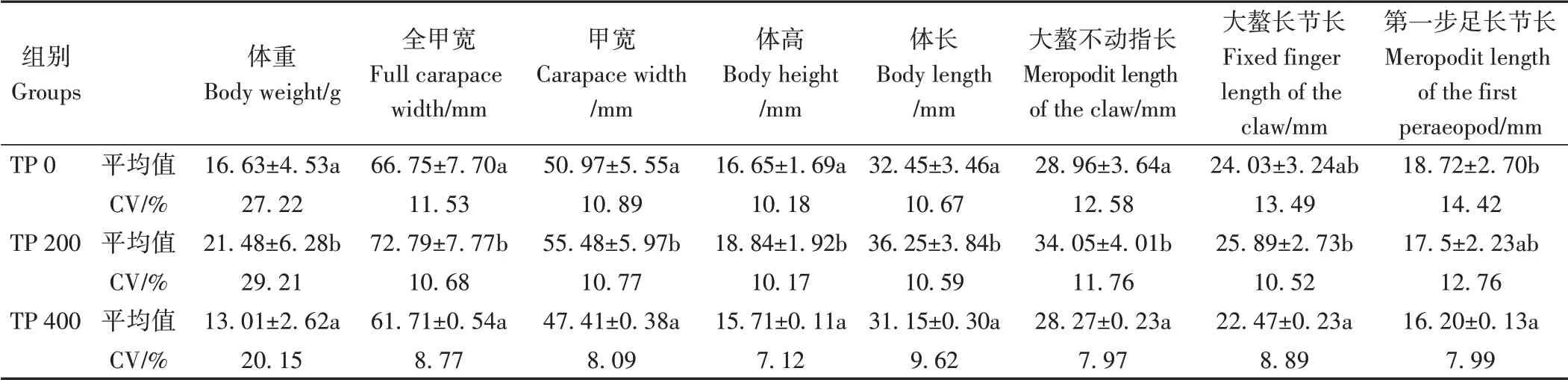
表4 不同丙酸睾酮水平下三疣梭子蟹形态性状的比较Table 4 Comparison of morphological characters of P.trituberculatus at different testosterone propionate levels
2.3 丙酸睾酮对三疣梭子蟹体组成的影响
三疣梭子蟹肌肉和肝胰腺营养组成分析结果显示(图2),仅TP0和TP 400组间肝胰腺粗脂肪含量呈现显著差异,TP 0组的粗脂肪含量最高,TP 400组最低。
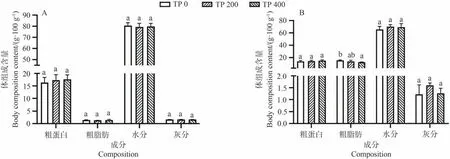
图2 不同丙酸睾酮水平下三疣梭子蟹肌肉和肝胰腺的体组成fig.2 Proximate composition in the muscle and hepatopancreas of P.trituberculatus at different testosterone propionate levels
2.4 丙酸睾酮对肌肉和肝胰腺中的氨基酸含量的影响
由表5可知,三疣梭子蟹肌肉中共检测到17种氨基酸。仅TP0组精氨酸(Arg)含量分别与TP 200和TP 400组存在显著差异。随着饲料中丙酸睾酮水平的提高,三疣梭子蟹肌肉Arg和总氨基酸含量呈下降趋势。肝胰腺中共检测到17种氨基酸(表6)。有4种氨基酸(丙氨酸、赖氨酸、组氨酸及精氨酸)含量在各处理间整体存在显著差异,其中TP 200组丙氨酸(Ala)和组氨酸(His)含量显著高于TP 0组;TP 400组赖氨酸(Lys)含量显著低于其余组;TP 0组精氨酸(Arg)含量显著高于TP 200组。

表5 不同丙酸睾酮水平下三疣梭子蟹肌肉氨基酸含量Table 5 Amino acid in muscle of P.trituberculatusat different testosterone propionate levels/(g·100 g-1)

表6 不同丙酸睾酮水平下三疣梭子蟹肝胰腺氨基酸含量Table 6 Amino acid in hepatopancreas of P.trituberculatus at different testosterone propionate levels/(g·100 g-1)
2.5 丙酸睾酮对肌肉和肝胰腺脂肪酸含量的影响
三疣梭子蟹肌肉中共检测到18种脂肪酸(表7),其中饱和脂肪酸有6种,单不饱和脂肪酸有4种,多不饱和脂肪酸有8种。各组间脂肪酸的组成和含量均无显著差异。肝胰腺中共检测到21种脂肪酸(表8),其中饱和脂肪酸有7种,单不饱和脂肪酸有6种,多不饱和脂肪酸有8种。在饱和脂肪酸(saturated fatty acid,SFA)中,TP 0组的C16:0、C18:0和C20:0显著高于其余组。在单不饱和脂肪酸(monounsaturated fatty acid,MUFA)中,TP 0组的C18:1n9c、C20:1和C22:1N9显著高于其余组(P<0.05)。在多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)中,TP 0组的C18:2n6c显著高于其余组;TP 0组的C20:2、C20∶5n3和C22∶6n3显著高于TP 400组;TP 0组的C20∶4n6显著高于TP 200组。多不饱和脂肪酸和高度不饱和脂肪酸总量均随丙酸睾酮添加量的提高呈下降趋势,但无显著差异。
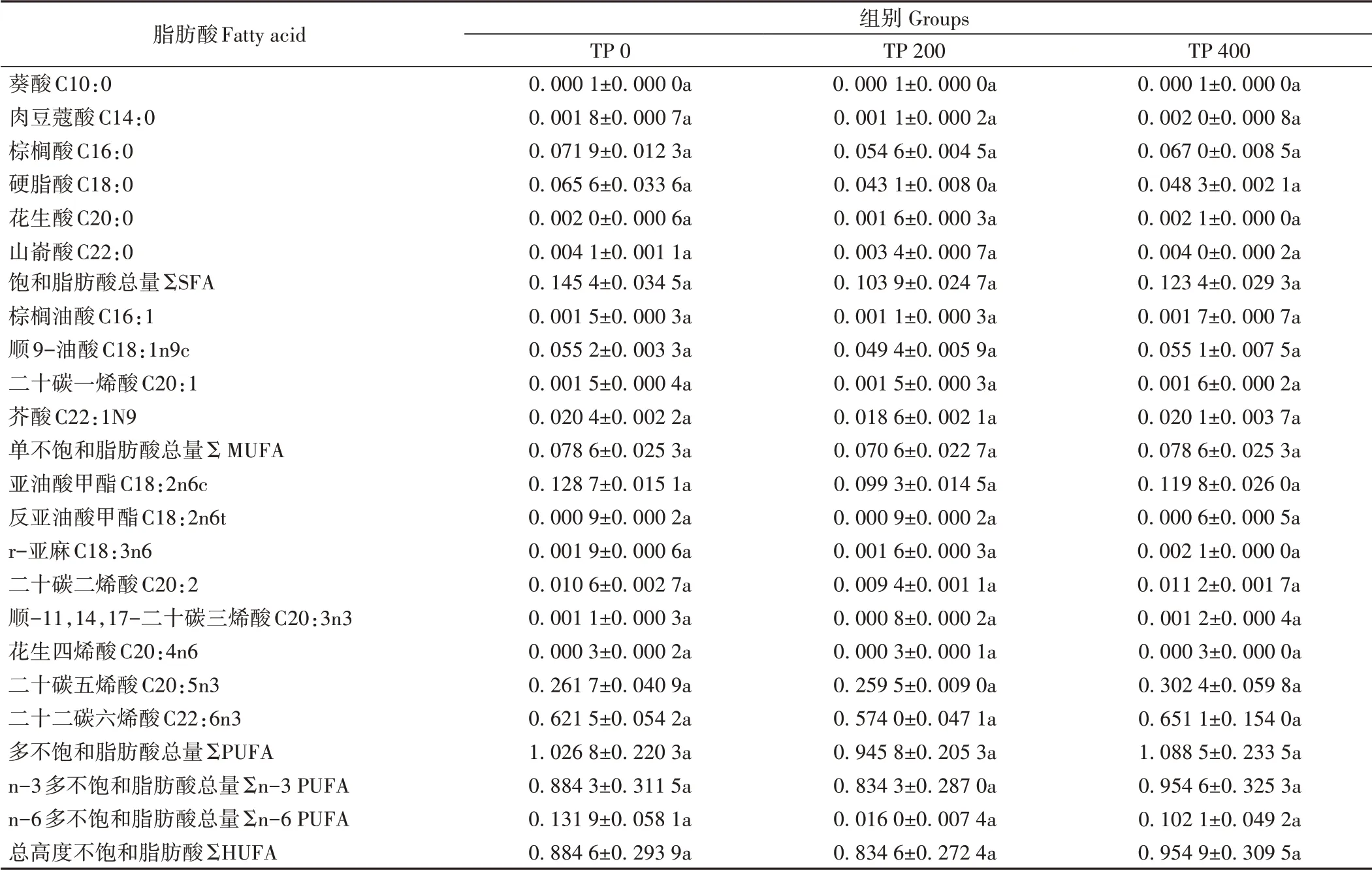
表7 不同丙酸睾酮水平下三疣梭子蟹肌肉脂肪酸含量Table 7 Fatty acid in muscle of P.trituberculatus at different testosterone propionate levels /(g·100 g-1)
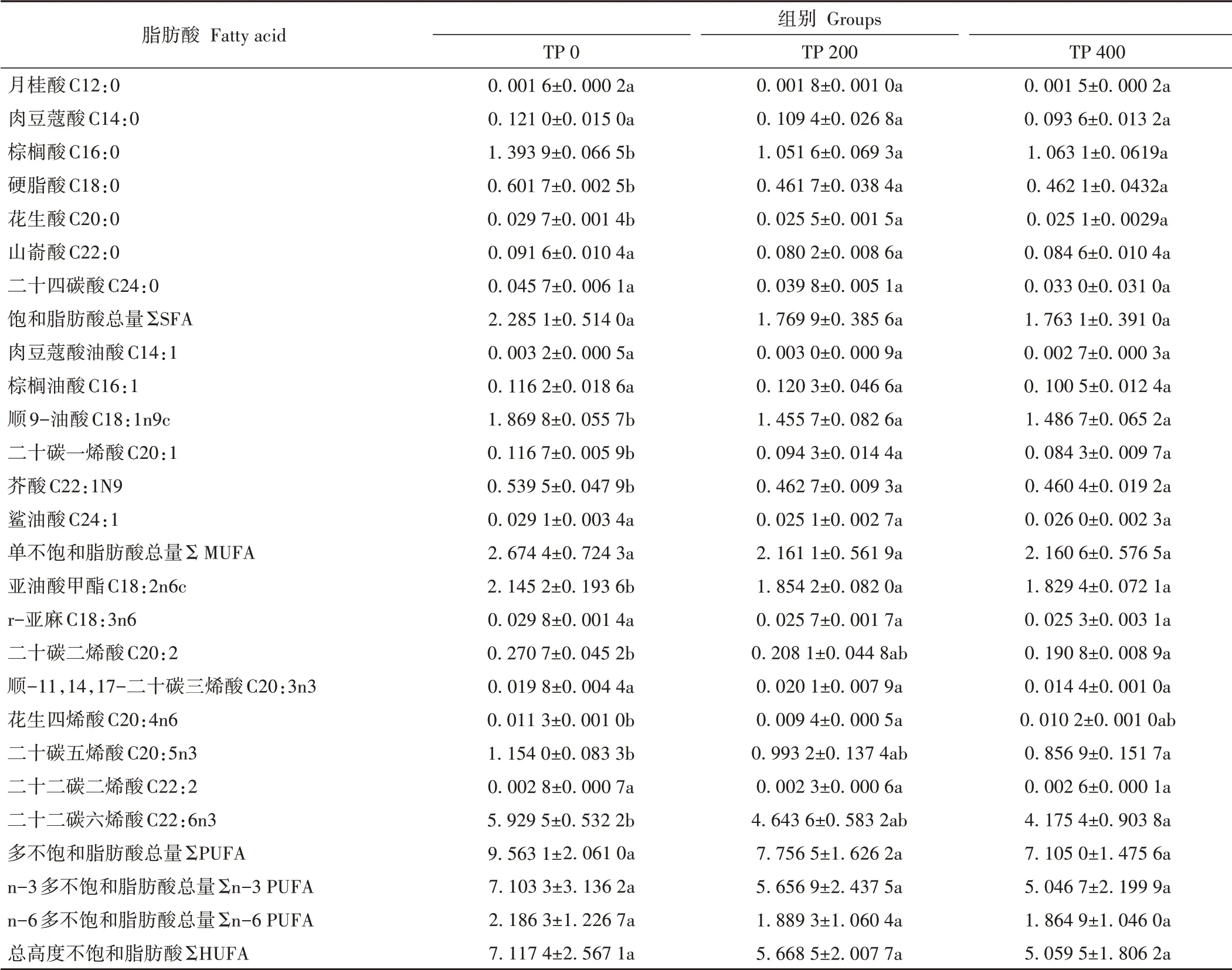
表8 不同丙酸睾酮水平下三疣梭子蟹肝胰腺脂肪酸含量Table 8 Fatty acid in hepatopancreas of P.trituberculatus at different testosterone propionate levels/(g·100 g-1)
3 讨论
3.1 丙酸睾酮对三疣梭子蟹血清性激素的影响
甲壳动物体内具有微量的E2和T,已在多种蟹类体内检测出。Huang等[11]研究发现雌性拟穴青蟹(Scylla paramamosain)血淋巴中E2浓度在发育早期最低(18.48 pg·mL-1),随着生长发育进程的推进,E2浓度开始增加,接近成熟阶段时达到峰值(75.42 pg·mL-1),雄性拟穴青蟹在成熟阶段的血淋巴T浓度达到峰值(607 pg·mL-1)。Dvoretsky等[12]研究发现巴伦支海红帝王蟹(Paralithodes camtschaticus)血淋巴中同时存在T和E2,T和E2含量范围分别在0.08~1.39 g·mL-1和217.70~100.10 pg·mL-1之间。在中华绒螯蟹(Eriocheir sinensis)中也有相关的研究报道,血淋巴的E2含量范围为31.91~180.74 pg·mL-1[13]。本研究中,对照组未检测到性激素,可能与试验蟹处于性腺发育早期、体内的性激素含量较少有关,但试验组检测到较高的性激素含量,表明三疣梭子蟹具有较强的性激素富集能力。
对脊椎动物的研究表明,性激素及其衍生物在体内存在转化途径,如TP作为一种睾酮酯,在血浆中可迅速被水解成游离T[22],从而促使血清睾酮含量增高;同时,T经芳香化酶催化可以转化为E2[23-24]。本研究试验组血清中未检测到饲料添加物TP,但存在较高的T含量,同时,试验组中检测到较高的E2含量,可能也与雄激素及其衍生物在体内的转化及代谢通路有关。在岸蟹(Carcinus maenas)的睾丸和输精管中存在一种17-β羟基类固醇还原酶,可将雄烯二酮还原成T,将E1还原成E2,但该过程不可逆[25]。本研究试验组三疣梭子蟹血清中雌雄性激素含量检测结果表明,三疣梭子蟹中可能存在与脊椎动物类似的激素转换机制,但其性激素合成与代谢的具体途径还需进一步深入研究。
3.2 丙酸睾酮对三疣梭子蟹生长性能的影响
在对鱼类的研究中发现,一定量的雄激素可通过调节生长激素(growth hormone,GH)和胰岛素样生长因子(insulin-like growth factors,IGFs)的表达等途径促进鱼类生长[26]。本研究结果表明,添加不同浓度的TP对三疣梭子蟹的生长产生了不同的影响,低浓度组(TP 200)三疣梭子蟹生长指标显著提高,但高浓度组(TP 400)生长指标显著降低,形态测量结果也表明,TP 200组多项生长指标显著高于对照组及TP 400组。Alam等[27]在对非洲鲶的研究中发现,高浓度(100 mg·kg-1)TP饲料投喂试验鱼,40 d增重显著高于对照组;但高浓度(125 mg·kg-1)TP饲料投喂试验鱼却在体重上与对照组无显著差异,表明激素对生长的调控作用存在剂量依赖效应。有研究表明,性类固醇激素对不同物种生长性能的影响具有性别差异。例如,在尼罗罗非鱼(Oreochromis niloticus)中,长期注射E2明显促进雌鱼生长,但对雄鱼的生长无显著影响[26];麦穗鱼(Pseudorasboraparva)暴露于100和200 ng·L-1浓度的17α-甲基睾酮21 d后,可以显著抑制雄鱼的生长,但对雌鱼无显著影响[28]。而在本试验中,各组三疣梭子蟹雌雄个体在生长上并无显著差异,因此在生长数据统计中合并进行分析。蜕壳是甲壳动物生长的关键,本研究中,TP对蜕壳间期无显著性影响,但有研究表明在高浓度E2(500 µg·L-1)中暴露14 d的糠虾(Americamysis bahia)累计蜕皮周期总数显著减少,且总长度和体重显著下降[29],表明外源性激素也会对甲壳类动物蜕皮过程产生影响,具体调控机制可能与激素的种类和剂量有关。
3.3 丙酸睾酮对三疣梭子蟹氨基酸和脂肪酸组成的影响
雄激素可调控骨骼肌蛋白质代谢,促进骨骼肌蛋白质合成[30]。有研究指出,T可以激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号途径的细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2),而被激活的ERK1/2可引起细胞生长相关转录因子的磷酸化,从而调节骨骼肌生理代谢过程[30]。大鼠细胞试验发现,雌激素也促进了肌细胞的增殖分化,抑制蛋白质分解[31]。在本试验中,含有较高雄激素及雌激素的试验组肌肉的粗蛋白含量高于对照组,但差异不显著。虽然试验组和对照组肌肉及肝胰腺的总氨基酸含量无显著差异,但试验组肌肉和肝胰腺中的Arg含量均显著低于对照组。Arg是目前发现的动物细胞内功能最多的氨基酸[32],具有调控蛋白质合成与动态平衡及生长发育、调节动物机体消化吸收脂溶性物质、降低动物机体血糖水平、刺激生长激素分泌和协同平衡脂肪代谢等功能[32-33]。Arg作为一氧化氮(nitric oxide,NO)的底物,通过产生NO来调节脂肪酸和氨基酸的代谢,而NO作为一种信号分子,可刺激肝脏中的脂肪酸氧化,抑制脂质合成[34]。本研究中,肝胰腺Arg和脂肪酸同时下降可能是由于Arg作为底物不断被催化成NO,从而抑制了脂肪酸的合成。但有关性激素与Arg代谢、蛋白质调控的机制还有待进一步的深入研究。
肝脏是动物脂质代谢的主要场所。研究表明,在脊椎动物中,雄激素有抑制脂肪形成和脂质合成的作用[6],雄激素通过提高肉碱棕榈酰转移酶(carnitine palmitoyltransferase-I,CPT1)的mRNA表达水平,增加脂肪酸在线粒体中的氧化,提供能量,从而降低脂肪水平[35];雌激素也在脂肪代谢中起到重要调控作用,Jones等[36]建立了一种雌激素缺乏小鼠模型,研究表明雌激素缺乏的小鼠肝脏脂肪积累增加。本试验结果发现,试验组血清检出了较高的雌雄性激素含量,同时试验组肝胰腺多种脂肪酸(如C16:0、C18:0、C18:1n9c、C20:1等)与对照组相比显著降低,表明饲料中添加丙酸睾酮在一定程度上抑制了三疣梭子蟹肝胰腺中脂肪酸的合成以及体组成中粗脂肪的积累,性激素在无脊椎动物中可能具有与脊椎动物相似的调控脂肪代谢机制。
4 结论
本试验结果表明,TP投喂提高了三疣梭子蟹体内的T和E2含量,外源性激素对三疣梭子蟹的生长、氨基酸及脂肪酸代谢产生不同影响。与对照组相比,TP 200组成活率显著降低,增重率显著提高;TP 200和TP 400组三疣梭子蟹肌肉和肝胰腺中总氨基酸含量无显著差异,但精氨酸含量均显著降低;试验组肌肉脂肪酸的组成和含量无显著差异,但肝胰腺中多种脂肪酸含量显著降低,粗脂肪含量也呈下降趋势。表明饲料中添加TP在一定程度上抑制了三疣梭子蟹肝胰腺中脂肪酸的合成以及体组成中粗脂肪的积累,性激素在无脊椎动物中可能具有与脊椎动物相似的转换代谢机制,但具体的转换机制以及激素对肝胰腺脂肪酸合成的影响机制均有待进一步深入研究。
