脂联素及其受体在T2DM大鼠心肌I/R损伤中的作用及其机制
2023-01-15岑运光王太昊崔晓燕田徐露胡安全
岑运光,王太昊,崔晓燕,田徐露,胡安全
(海南省人民医院,海南医学院附属海南医院保健中心,海口 570311;*通讯作者,E-mail:cenyunguang007@163.com)
糖尿病(diabetes mellitus,DM)是一种慢性疾病。2型糖尿病(type 2 diabetes mellitus,T2DM)是DM的主要类型,占DM病例的90%以上,胰岛素功能抵抗和不正常的补偿性胰岛素分泌反应可能是T2DM的主要病理机制[1,2]。在中国T2DM已成为继肿瘤和心血管疾病之后对人们健康构成威胁的第三大疾病[3]。急性心肌梗死(acute myocardial infarction, AMI)是世界范围内威胁人类生命的一种常见的致命性心脏病[4]。及时再灌注是抢救缺血心肌的关键。然而,再灌注虽然可以保护缺血心肌避免死亡,但仍能造成心肌损伤[5]。相关研究表明,T2DM能够加重患者缺血/再灌注(ischemia/reperfusion,I/R)损伤的发生率,其概率大约是非糖尿病个体的5倍[6]。因此,近年来的研究集中在对T2DM心肌I/R损伤保护的机制上。
脂联素(adiponectin,APN)是一种脂肪细胞衍生的循环细胞因子,可调节胰岛素敏感性和能量稳态,对T2DM等多种疾病均有保护作用[7]。APN通过结合两种特定的受体—脂联素受体1(adiponectin receptor 1,AdipoR1)和脂联素受体2(adiponectin receptor 2,AdipoR2)发挥功能[8],AdipoR1主要在心肌中存在。已有研究表明,APN能够与AdipoR1相互作用改善糖尿病大鼠肺I/R中的心肌损伤[9]。然而,将天然APN蛋白转化为可行的常规治疗药物较为困难且成本高昂。因此,人们开发出一种脂联素受体激动剂(AdipoRon),其能够发挥APN作用,且多项研究表明AdipoRon在动脉粥样硬化和肝纤维化中可发挥APN的保护作用[10,11]。其中,ADP355作为一种人工合成的10个氨基酸残基肽的AdipoRon相似物,其具有APN性质,可在体内激活APN的AdipoR1受体[12]。
AdipoRon可以激活腺苷单磷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)[13,14]。而后者激活又可通过抑制自噬过程中关键途径-哺乳动物雷帕霉素靶点(mammalian target of rapamycin, mTOR)信号通路而上调自噬水平[15]。众所周知,自噬在I/R中可以改善组织损伤。然而,迄今为止,ADP355在T2DM大鼠心肌I/R损伤中对自噬的影响及相关的机制研究较少。因此,本研究旨在探讨ADP355预处理对T2DM大鼠心肌I/R损伤中APN及其AdipoR1水平的影响,以及与自噬相关的分子机制,从而为疾病的治疗提供新方向。
1 材料与方法
1.1 实验材料
清洁级雄性Sprague-Dawleyo(SD)大鼠60只,7~8周龄,体质量200~220 g(南京君科生物工程有限公司);链脲佐菌素(streptozocin,STZ)(美国Sigma公司);APD355(苏州泓迅生物科技股份有限公司);苏木精-伊红(H-E)染色试剂盒(江苏碧云天生物技术有限公司);伊文氏蓝(Evan)和三苯基氯化四氮唑(TTC)试剂(上海阿拉丁生化科技股份有限公司);胰岛素和脂联素的ELISA试剂盒(江苏碧云天生物技术有限公司);RT Super Mix和SYBR Green Master Mix试剂盒(日本TaKaRa公司);兔抗大鼠p-AMPK、AMPK、p-mTOR、mTOR、LC3 Ⅰ、LC3 Ⅱ、p62、β-actin(美国Cell Sigaling公司);RT-PCR引物(上海吉玛生物制药有限公司设计与合成)。
1.2 糖尿病模型的建立与分组处理
将大鼠饲养在温度(24±2)℃,湿度40%~50%的清洁动物房环境中,12 h/12 h昼夜交替,提供足量的食物和水。将大鼠适应性饲养1周后,给所有大鼠喂食高脂高糖饲料。50 d后,大鼠腹腔注射STZ 30 mg/kg(现配现用,溶解在pH 4.5的0.1 mmol/L柠檬酸缓冲液中)。连续注射4周,每周通过尾静脉检测1次空腹血糖,大鼠的空腹血糖≥16.7 mmol/L,并伴有多尿、多饮,则认为2型糖尿病大鼠造模成功。
按随机数字表法将造模成功的大鼠分为3组(每组20只):糖尿病假手术组(sham组)、糖尿病心肌缺血再灌注模型组(I/R组)、ADP355+I/R组。ADP355+I/R组大鼠每周腹腔注射2 ml ADP355多肽溶液(1 mg/kg)连续4周[12],sham组和IR组注射等体积PBS溶液。连续4周后,IR组与ADP355+IR组大鼠用10%水合氯醛(300 mg/kg)麻醉后,沿着第三或第四肋骨的上边缘切开胸腔将心脏暴露,探查冠状动脉左前降支,并用6-0丝线穿线结扎;结扎缺血30 min后,释放结扎线再灌注恢复血流4 h。sham组大鼠除不进行结扎外,其余操作均相同。手术结束后,脱颈处死各组大鼠,称量各组大鼠体质量,取相关组织样本进行后续实验。
1.3 HE染色检测心肌损伤
再灌注结束时,取左心室心肌组织进行组织学检查。用4%多聚甲醛固定心肌组织,用乙醇脱水,石蜡包埋。心肌组织连续切片(5 μm),苏木精-伊红(HE)染色切片,处理后观察结果。
1.4 Evan/TTC染色检测心肌梗死面积
采用伊文氏蓝(Evan)/三苯基氯化四氮唑(TTC)双染色方案测定心肌梗死面积。再灌注结束后静脉注射2% Evan,速冻后切片(2 μm)用1% TTC染色。正常组织为蓝色,缺血组织为红色,梗死组织为白色。用Image J软件计算梗死面积百分比(心肌梗死面积/心肌总面积。
1.5 ELISA检测胰岛素、APN水平
再灌注结束后,采集各组大鼠尾静脉血液,4 ℃离心后收集血清用于后续实验。按照试剂盒说明检测胰岛素、APN水平。
1.6 qRT-PCR检测APN及AdipoR1 mRNA表达水平
从心脏组织中提取总RNA,用RT Super Mix合成脂联素及受体的cDNA。采用SYBR Green Master Mix扩增引物,采用RT-PCR检测APN及受体AdipoR1的mRNA表达。GAPDH作为内参,各引物序列如下:①APN正向序列:5′-GCCTACCACATCACAGTC-3′,反向序列:5′-GCATTACCTGAGATACGACT-3′;②AdipoR1正向序列:5′-AAGTGGATTATTCAGGAA-3′,反向序列:5′-AATGGAGAGGTAGATGAG-3′;③GAPDH正向序列:5′-TGGACTCCACGACGTACTCAG-3′,反向序列:5′-CGGGAAGCTTGTCATCAATGGAA-3′。相对表达量通过2-ΔΔCt法计算。上述实验重复3次。
1.7 Western blot检测蛋白表达
AMPK及mTOR蛋白的磷酸化水平与大鼠软骨细胞的自噬息息相关,LC3 Ⅱ、LC3 Ⅰ与P62是自噬发生的重要标记物。本实验将心肌组织用裂解液均质匀浆,在4 ℃离心10 min提取上清。用Bradford法测定上清液中的总蛋白浓度。从每个样品中提取等量蛋白质在10%的SDS-PAGE凝胶上分离,并转移在PVDF膜上。一抗(兔抗大鼠p-AMPK、AMPK、p-mTOR、mTOR、LC3 Ⅰ、LC3 Ⅱ、p62、β-actin,1 ∶1 000稀释)4 ℃下孵育过夜。用二抗(HRP标记的羊抗兔IgG,1 ∶5 000稀释)在室温下作用1 h。根据试剂盒的说明,使用增强化学发光检测系统观察免疫反应蛋白条带。用Image J对蛋白条带灰度进行分析。
1.8 统计学分析
2 结果
2.1 ADP355对T2DM心肌I/R大鼠体质量、血清中血糖、胰岛素和APN含量的影响
与sham组相比,I/R组和ADP355+I/R组大鼠的体质量、血糖含量差异均无统计学意义(P>0.05),APN含量降低(P<0.05),I/R组中血清胰岛素无明显变化(P>0.05),ADP355+I/R组胰岛素含量降低(P<0.05);与I/R组相比较,ADP355+I/R组大鼠体质量、血糖、APN含量均无变化(P>0.05),胰岛素下降,差异有统计学意义(P<0.01,见表1)。
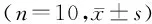
表1 T2DM心肌I/R大鼠体质量、血糖、胰岛素和APN含量水平Table 1 Body weight, blood glucose, insulin and APN levels in T2DM rats with myocardial
2.2 ADP355对T2DM心肌I/R大鼠心肌组织损伤的影响
用HE法检测各组心肌组织损伤的情况,结果显示,与sham组相比较,I/R组和ADP355+I/R组心肌组织损伤严重,心肌纤维排列紊乱、肌原纤维中断、细胞间隙扩大等;与I/R组相比,ADP355+I/R组的心肌组织损伤减轻,肌原纤维断裂减少,细胞间隙缩小(见图1)。

图1 ADP355改善T2DM I/R大鼠心肌组织损伤 (×200)Figure 1 ADP355 improves myocardial tissue injury in T2DM I/R rats (×200)
2.3 ADP355对T2DM心肌I/R大鼠心肌梗死面积的影响
双染色法检测心肌梗死面积,与sham组比较,I/R组和ADP355+I/R组的白色区域均增多,心肌梗死面积增加(P<0.01);与I/R组相比,ADP355+I/R组心肌梗死的面积减小(P<0.01,见图2)。
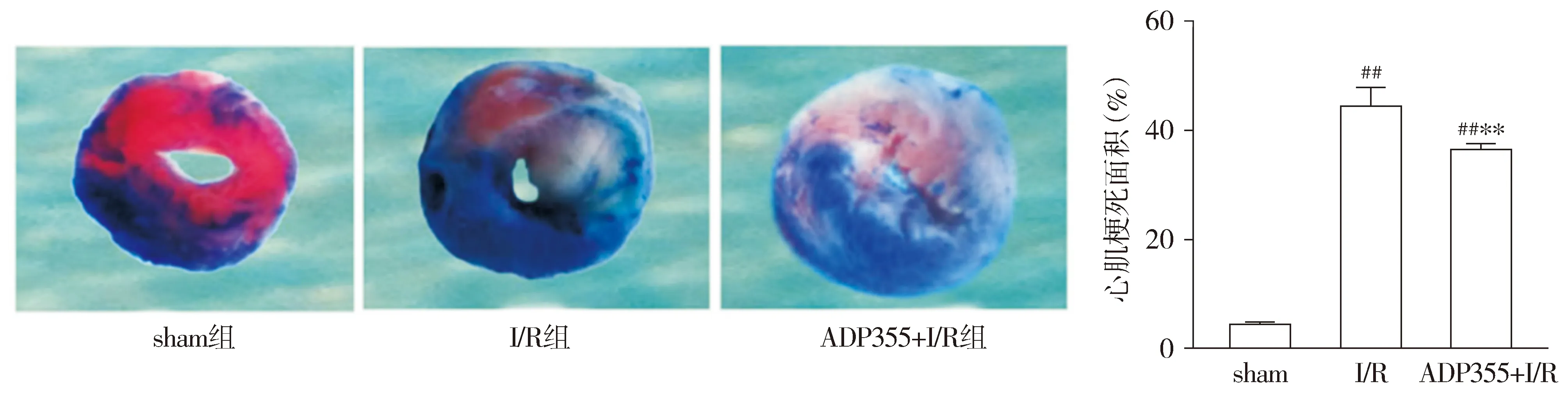
与sham组相比,##P<0.01;与I/R组相比,**P<0.01图2 ADP355减少T2DM I/R大鼠心肌梗死面积Figure 2 ADP355 reduces myocardial infarction size in T2DM I/R rats
2.4 ADP355对T2DM心肌I/R大鼠APN及APN受体水平的影响
qRT-PCR检测大鼠心肌组织中APN及受体AdipoR1的mRNA水平,与sham组相比,I/R组和ADP355+I/R组中APN及AdipoR1的mRNA表达水平均下降(P<0.05);与I/R组相比较,ADP355+I/R组中AdipoR1的mRNA水平上升(P<0.05),APN的mRNA水平无变化(P>0.05,见图3)。

与sham组相比,#P<0.05,##P<0.01;与I/R组相比,*P<0.05图3 ADP355提高T2DM I/R大鼠心肌组织APN及APN受体水平Figure 3 ADP355 increases the levels of APN and APN receptor in myocardial tissue of T2DM I/R rats
2.5 ADP355对T2DM心肌I/R大鼠心肌自噬的影响
与sham组相比,I/R组和ADP355+I/R组大鼠心肌组织中AMPK磷酸化水平(p-AMPK/AMPK)、LC3 Ⅱ/Ⅰ蛋白比值均上调,差异有统计学意义(P<0.01),而P62蛋白的表达水平下调(P<0.01);与sham组相比,I/R组mTOR磷酸化水平(p-mTOR/mTOR)上调(P<0.01),而ADP355+I/R组该蛋白磷酸化水平下调(P<0.05);与I/R组相比,ADP355+I/R组AMPK磷酸化水平(p-AMPK/AMPK)、LC3 Ⅱ/Ⅰ蛋白比值、P62蛋白的表达水平均上调(P<0.01),而mTOR磷酸化水平(p-mTOR/mTOR)下调(P<0.01,见图4)。

与sham组相比,#P<0.05,##P<0.01;与IR组相比,**P<0.01图4 ADP355促进T2DM I/R大鼠心肌自噬Figure 4 ADP355 promotes myocardial autophagy in T2DM I/R rats
3 讨论
治疗AMI中,再灌注是一个重要的措施。为了治疗可能会发生的再灌注损伤,现存的许多研究都以药物后处理为主。但是在T2DM中,心肌缺血再灌注损伤的发生率极高,所以预处理的治疗措施是研究热点。本研究用一种能够促进APN受体活性的衍生肽,探究其预处理对T2DM心肌I/R损伤的保护作用。
APN是一种具有生物活性的蛋白质因子,主要由脂肪细胞分泌,在糖尿病个体中其水平降低[16]。以往的研究已经证实APN具有抗肥厚、抗纤维化、抗炎症、抗凋亡和调节代谢等作用,而上述功能均有助于心脏保护[17]。ADP355具有APN的性质并能激活APN的受体,更重要的是,这种多肽在动物模型的血液中具有良好的稳定性和极低的毒性,可显示出APN的多种效应[18]。本研究用ADP355预处理T2DM大鼠4周后,进行缺血再灌注手术,之后对各项指标进行检测。结果表明,I/R组大鼠的体质量、血糖和胰岛素水平均没有明显的改变,而血清APN含量、心肌组织中APN和AdipoR1 mRNA水平却降低,而在ADP355+I/R组中,ADP355的应用可降低胰岛素水平,并提高心肌组织中AdipoR1的mRNA表达水平。说明机体内APN及AdipoR1的水平受到T2DM心肌I/R损伤的影响,这与Pieiro等[19]的研究结果一致,这也提示了ADP355预处理可能通过促进心肌分泌具有生物活性的AdipoR1发挥保护心肌的潜能。
染色结果可以看出I/R对T2DM的心肌组织造成严重的损伤和大面积的心肌梗死,但是ADP355预处理减轻了心肌损伤和梗死,这个结果与上述AdipoR1 mRNA的上调相符合,也与Otvos等[20]的研究结果相符合。这些结果均支持了ADP355作为一种直接的心肌保护分子对T2DM心肌I/R损伤的作用。
为了进一步探究心肌损伤与心肌梗死缓减的内在机制,我们又研究了相关的自噬通路。自噬是机体的一种独特保护形式,可以导致心肌代谢功能障碍[21]。自噬受到AMPK信号的调控,抑制AMPK将导致心肌自噬水平降低[22]。研究证明,APN以调控AMPK的方式刺激肌肉细胞和大鼠软骨细胞的自噬[23],与APN缺乏类似,骨骼肌中AdipoR1的缺失也能够抑制AMPK活化蛋白激酶的信号轴[24]。本研究结果显示受损的心肌组织中,APN、AdipoR1的mRNA水平与AMPK的磷酸化水平均较低。mTOR是AMPK的下游靶点之一,是自噬过程中的关键抑制分子[25]。有研究表明,AMPK的激活可抑制mTOR信号[26]。本研究用ADP355预处理T2DM心肌I/R促进了AMPK的磷酸化,从而抑制mTOR的活化水平,这导致了自噬水平的上调,最终减轻了心肌损伤。LC3与P62是自噬发生的重要标记物,其中LC3 Ⅰ与磷脂酰乙醇胺结合形成LC3 Ⅱ,然后进入自噬体的内外膜,直到被降解或循环进入胞质液。这种LC3 Ⅰ到LC3 Ⅱ的转化被认为是促进自噬的有力证据[27],而P62是一种自噬底物,能够报告自噬的活性[25]。在我们的研究中,I/R组心肌组织损伤严重,P62的表达降低提示自噬活性下降,进一步说明T2DM心肌I/R大鼠的损伤可能是通过抑制自噬来实现的。而且,结果中LC3 Ⅱ/Ⅰ比值与P62水平的上调也证明了ADP355预处理促进了自噬,保护了T2DM心肌I/R损伤。
综上所述,我们的结果表明ADP355预处理可以模拟APN的作用,对T2DM心肌I/R损伤发挥治疗作用。ADP355通过上调心肌中APN受体的表达,减轻心肌损伤和减少心肌梗死面积,这可能与其激活自噬信号通路相关。因此,ADP355有望作为一种治疗T2DM心肌I/R损伤候选药物。
