一株同步糖化发酵纤维素产乙醇的尖孢 镰刀菌的筛选
2023-01-15湛佳佳张志旭
周 泉,湛佳佳,2,李 璧,张志旭,秦 丹,曾 璐*
(1.湖南农业大学 食品科学技术学院,湖南长沙 410128;2.遵义医科大学医学与科技学院 医养健康学院, 贵州遵义 563000;3.湖南农业大学 园艺学院,湖南长沙 410128; 4.湖南农业大学园艺作物种质创新与新品种选育教育部工程研究中心,湖南长沙 410128)
甘蔗是我国主要的制糖原料,由此每年会产生约3000万t的副产物,若将这类木质纤维素资源合理利用,将会产生巨大的经济价值[1]。甘蔗渣作为一类富含纤维素、半纤维素以及大量残糖的原料,成为了生产纤维素乙醇的理想材料[2]。现阶段大多数的纤维素乙醇研究,都需经过水解、糖化、发酵等多个步骤处理,工序费时费力,不仅无法实现资源的充分利用,甚至因化学试剂使用过多导致环境污染,成本过高等问题。如果能得到一株具备纤维素乙醇转化能力的菌株,将多个发酵步骤置于同一个发酵体系中进行,即采用单菌株进行甘蔗渣纤维素的同步糖化发酵(Simultaneous Sacchrification and Fermentation,SSF),便能很好地解决上述问题。此外,在水解液中约有30%以木糖为代表的五碳糖难以被微生物利用,这也成为制约纤维素乙醇提高的瓶颈,因此对微生物的选择就显得至关重要。目前已知少数尖孢镰刀菌菌株能够附着在木质纤维素底物上产生纤维素酶和半纤维素酶使其降解,也有部分菌株能够使单糖转化生成乙醇。若能获得一株具备纤维素降解、发酵单糖生成乙醇,同时能够利用五碳糖的菌株材料,对于利用单菌株进行同步糖化发酵生产乙醇的研究,具有重要意义。
1 材料与方法
1.1 菌株
本实验室从国内外收集保藏的10株尖孢镰刀菌菌株,均已完成菌种鉴定,具体信息见表1。

表1 尖孢镰刀菌菌株信息
1.2 主要试剂与仪器
1.2.1 主要试剂
木质素标准品:西格玛奥德里奇(上海)贸易有限公司;纤维素标准品:湖南国伦美生物科技有限公司;木聚糖标准品:上海源叶生物科技有限公司。
1.2.2 主要仪器
IRAきnity-1型傅里叶红外光谱仪:日本岛津公司;UV-1800型紫外可见光分光光度计:上海美谱达仪器有限公司;SBA-40E型生物传感分析仪:山东省科学院生物研究所。
1.3 培养基配制
羧甲基纤维素钠(CMC-Na)培养基:羧甲基纤维素钠2 g,琼脂18 g,pH值6.0,蒸馏水溶解并定容至1 L,121 ℃灭菌20 min,待培养基凝固后,在培养皿中心打一个直径0.5 cm的圆孔,备用。
滤纸崩解培养基:磷酸二氢钾2 g、硫酸铵4 g、硫酸镁0.1 g、蛋白胨1 g和酵母膏10 g,加入蒸馏水1 L搅拌至完全溶解。每瓶50 mL分装至250 mL三角瓶中,并加入6条1 cm×3 cm滤纸条,灭菌备用。
发酵产酶培养基:甘蔗渣30 g,羧甲基纤维素钠5 g,蛋白胨10 g,磷酸二氢钾1 g·L-1,硫酸镁 0.2 g,硫酸铵3 g,蒸馏水溶解并定容至1 L,121 ℃灭菌20 min。
木糖发酵培养基:木糖50 g,(NH4)2SO41 g,KH2PO41 g,MgSO4·7H2O 0.5 g、CaCl2·2H2O 1 g、蒸馏水溶解并定容至1 L,分装后灭菌。
甘蔗渣发酵培养基:已预处理的甘蔗渣50 g、硫酸铵1 g、磷酸二氢钾1 g、硫酸镁0.5 g、氯化钙1 g,加入蒸馏水1 L搅拌至完全溶解,分装后灭菌。
1.4 试验方法
1.4.1 菌株筛选
菌种初筛,参考王玮[3]的刚果红平板染色法,复筛参考吴庆珊[4]的滤纸片崩解法。
1.4.2 酶活力测定
接种2 mL种子液于100 mL发酵培养基中,28 ℃、 150 r·min-1摇瓶培养,每天测定几种主要纤维素酶的酶活。取发酵样液5000 r·min-1离心5 min,取上清液为待测液,每株菌设3个平行。内切葡聚糖酶(CMCA)酶活测定参照QB 2583—2003[5]附录B的方法;外切葡聚糖酶(CBH)酶活测定参照孔芹等[6]的研究方法;β-葡聚糖酶酶活测定参照 QB/T 4481—2013的方法[7];木聚糖酶酶活测定参照GB/T 23874—2009的方法[8]。
1.4.3 发酵五碳糖产乙醇性能测定
分别接种2 mL待测菌株种子液至100 mL木糖发酵液体培养基、PDB培养基,28 ℃、150 r·min-1摇瓶培养7 d,参考冯东等[9]的生物传感法测定乙醇含量。
1.4.4 同步糖化发酵甘蔗渣产乙醇性能测定
(1)发酵底物预处理。甘蔗渣原料预处理:将甘蔗渣自然风干后粉碎,过100~200目筛,使粒径在0.15~0.75 mm,于80 ℃烘干至恒重;底物去糖处理:参考陈桢[10]的甘油-过碳酸钠预处理法。
(2)甘蔗渣同步糖化发酵。将5 mL新鲜种子液分别接种至经去糖、未去糖处理的甘蔗渣发酵培养基中,28 ℃、150 r·min-1摇瓶培养7 d。每日跟踪监测残糖及乙醇含量。发酵结束后,测定降解率。乙醇转化率和降解率的计算公式分别为

式中:c为乙醇浓度,g·L-1;v为酶解液的体积,L;m为甘蔗渣的质量,kg。

式中:m1为发酵前甘蔗渣重量,g;m2为发酵后剩余甘蔗渣的重量,g。
1.5 底物成分分析
取发酵残渣,用蒸馏水洗涤至中性,80 ℃烘干至恒重。取发酵前后的甘蔗渣样品及纤维素、半纤维素、木质素标准品各0.6 mg,与59.4 mg的溴化钾粉末混匀,在研钵中充分研磨至粒径 ≤2 μm,用傅里叶红外光谱仪(Fourier Transform Infrared Spectroscopy,FTIR)在1.2 Ton压力下作用30 s, 压制出均匀透明无裂痕的压片,光谱波数扫描范 围为4000~400 cm-1,分辨率为4 cm-1,扫描次数64次。
1.6 数据分析
采用Excel和SPSS软件进行数据分析,Origin 2018进行图表制作。
2 结果分析
2.1 菌株筛选
2.1.1 刚果红平板染色初筛
刚果红与CMC-Na反应可生成红色复合物,但不与降解后的单糖发生反应,根据水解圈的大小可初步判断菌株的纤维素水解能力,水解能力越强,水解圈直径越大。结果见图1。
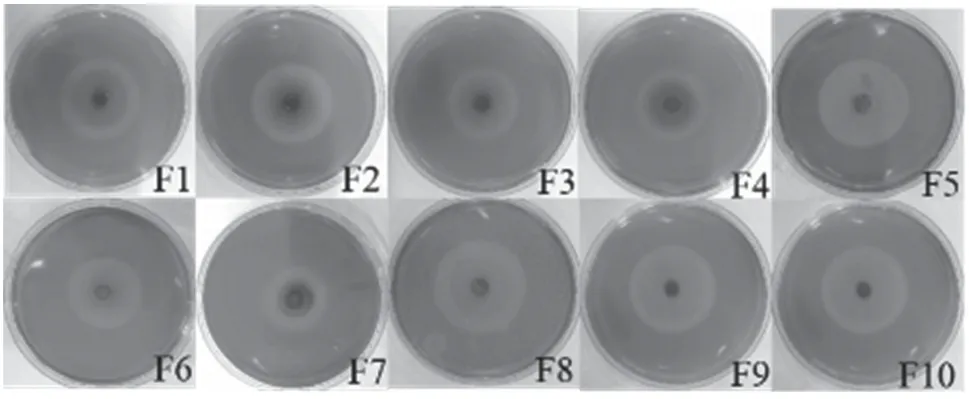
图1 刚果红平板染色结果图
由图1可知,各菌株均出现明显的水解圈,且F1、F5、F6、F7、F8、F9和F10菌水解圈直径均大于4.00 cm,其中F10效果最佳,达到4.5 cm。
2.1.2 滤纸崩解试验复筛
为保证试验结果的准确性,对初筛菌株F1、F5、F6、F7、F8、F9和F10进行滤纸片崩解的复筛,结果如图2所示。

图2 滤纸崩解试验结果图
由图2可知,10个菌株三角瓶中的滤纸条都不同程度被降解,其中F2、F4、F6和F9菌株的降解效果不明显,滤纸无明显变化;F1、F5、F7菌株使滤纸边缘轻微降解;F3、F8菌株有一定的降解效果,可使滤纸降解成小圆片;F10菌效果最明显,可使滤纸片降解成糊状。由此表明,F10菌的纤维素降解能力最佳,可用于后续试验的同步糖化发酵试验 研究。
2.2 菌株产酶性能
微生物酶活力大小决定着纤维素的降解效果,木质纤维素的水解由纤维素酶和半纤维素酶起主要作用,其中,纤维素酶主要包括内切葡萄糖酶、外切葡萄糖酶和β-葡萄糖苷酶,半纤维素酶主要以木聚糖酶为主。如图3所示,F10酶系统较为完全,内切酶、外切酶、β-葡聚糖酶的酶活力分别为15.32 U·mL-1、23.56 U·mL-1、10.65 U·mL-1,与同类型的纤维素降解菌株酶活力效果类似;而F10的木聚糖酶活力值达到249.05 U·mL-1,显著高于其他酶的活力值。
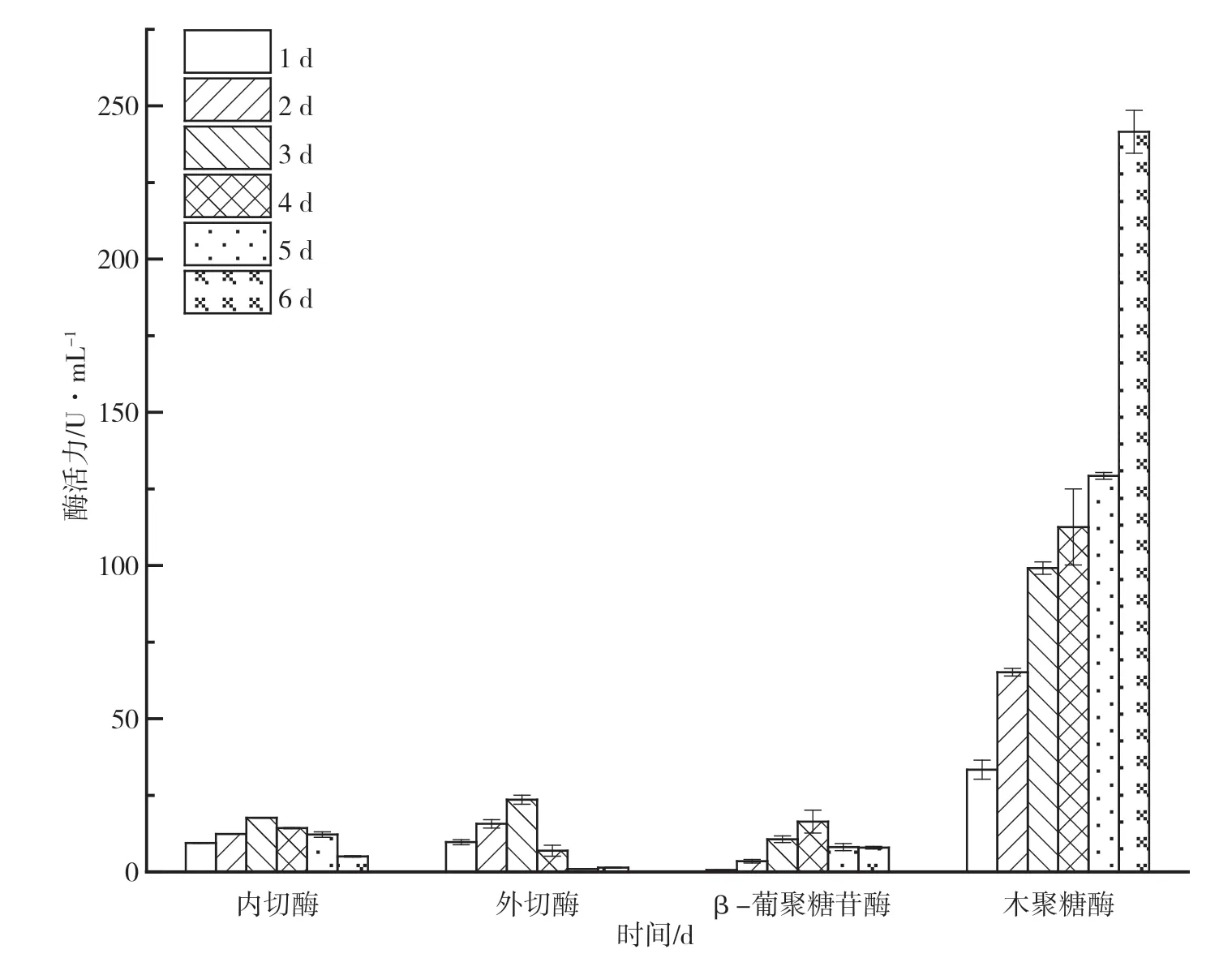
图3 F10酶活力情况图
2.3 发酵五碳糖产醇性能
木质纤维素水解产物中约有30%的五碳糖(主要由半纤维素水解而得)。而自然界中仅有少数的微生物能利用木糖生成乙醇,这也成为了纤维素乙醇产量高低的决定因素。本试验以木糖为底物,测定F10对五碳糖的产醇性能。结果如图4所示,F10菌在PDB中生长状况良好,使木糖培养基出现明显浑浊,表明F10可在木糖为唯一碳源的培养基中生长代谢,其乙醇产量可达16.84 g·L-1。该试验结果明显高于范金霞等[11]的研究,在纤维素转化方面具有良好前景。由此表明F10具备良好的同步糖化发酵 潜力。?

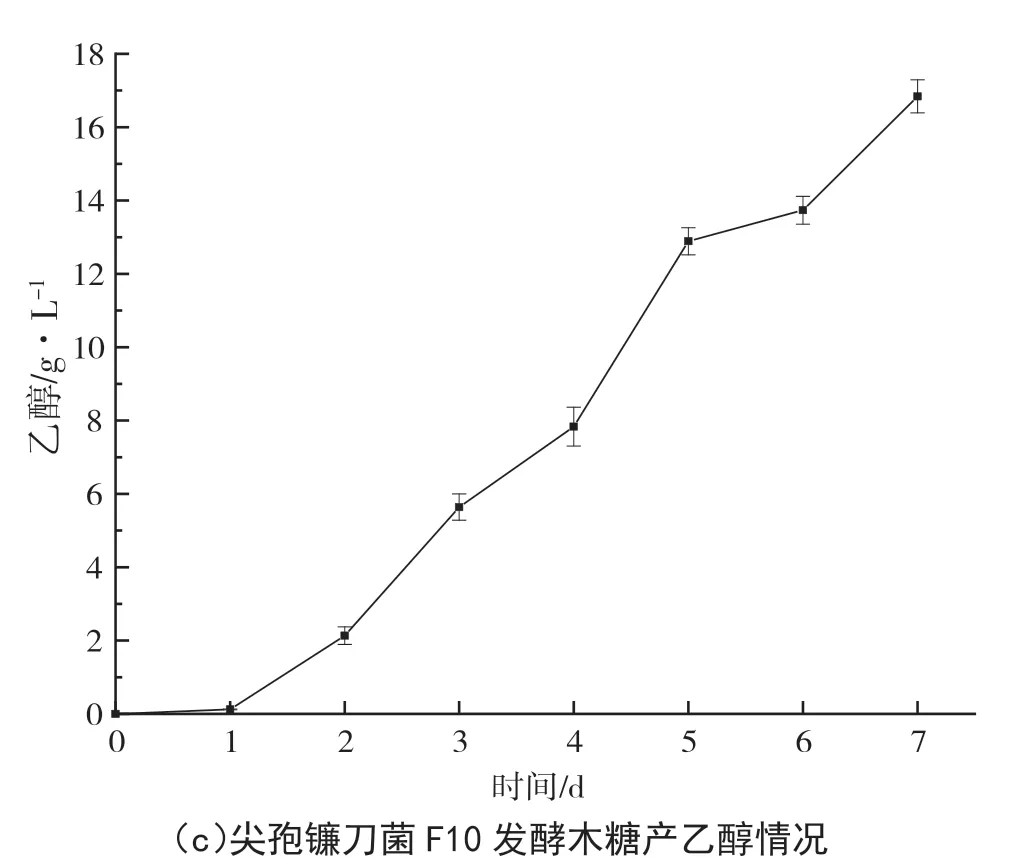
图4 F10不同培养基生长情况及发酵木糖产醇情况图
2.4 尖孢镰刀菌同步糖化发酵甘蔗渣的产醇性能
以甘蔗渣为底物,用F10进行同步糖化发酵试验,并以去糖甘蔗渣作为对照,以验证在无残糖的影响下,对甘蔗渣具有同步糖化发酵的效能。如图5所示,在未经去糖处理的甘蔗渣中,葡萄糖起始含量为 2.89 g·L-1,呈先增长后下降的趋势,第2天以后趋近于0 g·L-1,但乙醇含量仍逐步增长,第4天时达到峰值9.5 g·L-1,转化率为19.0 g·kg-1,降解率可达28%,表明菌株F10对甘蔗渣的降解和糖醇转化效果良好。此外,在无初始糖的情况下,乙醇的含量逐步增长,转化率可达8.4 g·kg-1,但葡萄糖的含量却在整个发酵过程中均无明显的增减变化,表明菌株F10在发酵过程中,在对甘蔗渣纤维素进行降解的同时,将发酵体系中的单糖同步转化生成乙醇,这也进一步验证了F10具备同步糖化发酵的能力。
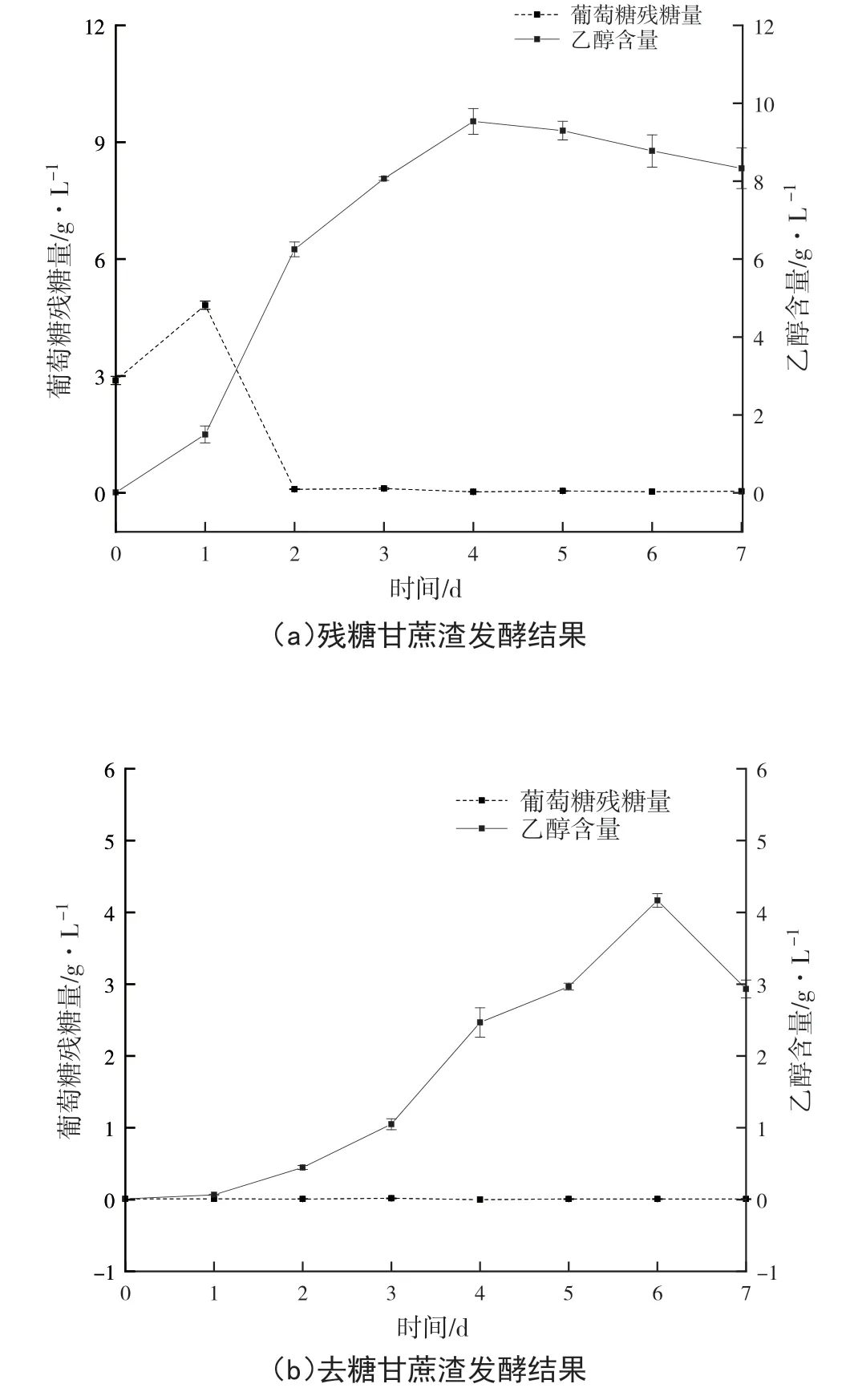
图5 甘蔗渣发酵过程中葡萄糖和乙醇的含量变化图
2.5 FTIR分析同步糖化发酵对甘蔗渣成分的影响
FTIR谱图根据特征吸收峰的位置、强度和形状表征化合物官能团的振动与转动,不仅可用于鉴别分子结构的归属还可进行定量分析。甘蔗渣是复杂的生物质材料,为消除多种化合物基团相互作用的干扰,对甘蔗渣的3种主要成分纤维素、半纤维素和木质素标准品的谱图位置、峰形进行认定。在 4000~400 cm-1波数段进行FTIR扫描测定,并根据参考文献[12]检索峰谷,进行特征峰的归属分析,同时对发酵前后的甘蔗渣样品进行测定。结果如图6、表2所示。
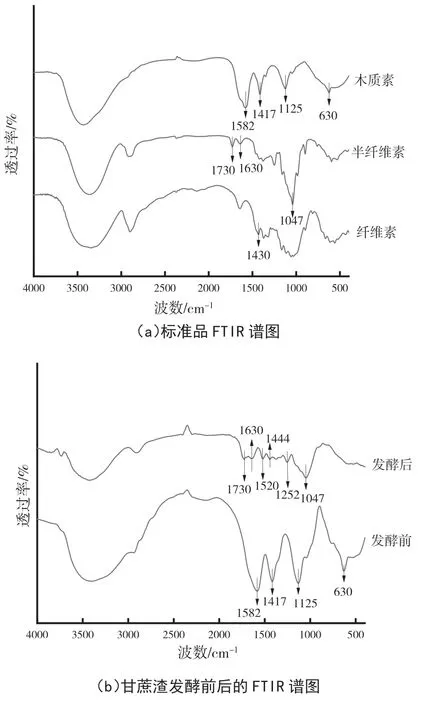
图6 甘蔗渣发酵前后的傅里叶红外光谱图
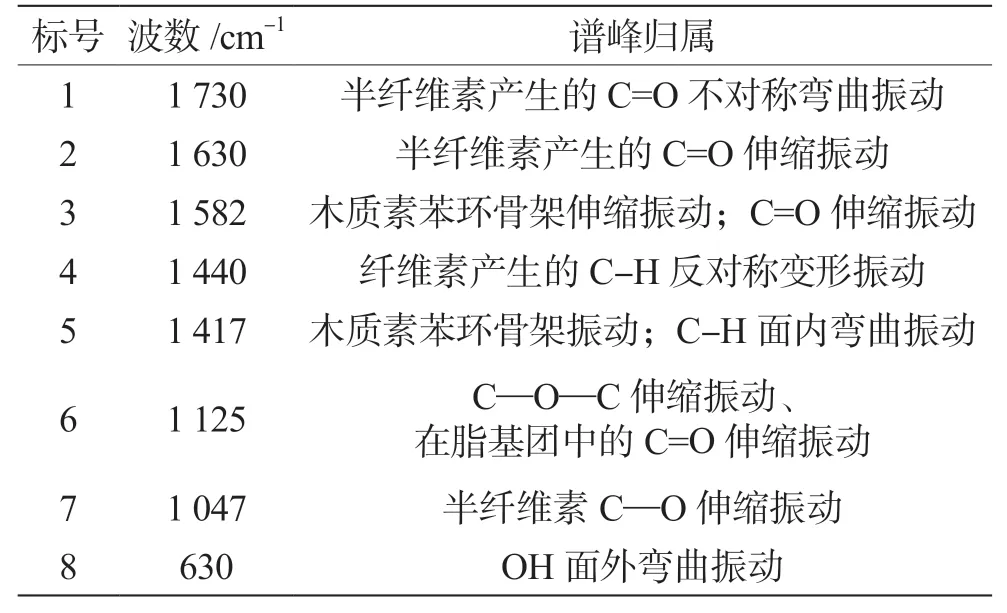
表2 FTIR谱图的相关峰谷归属分析
甘蔗渣样品中包含了OH、CH、C=O和C-O-C等一系列化学基团结构,发酵前的甘蔗渣在木质素特征峰1582 cm-1、1417 cm-1、1125 cm-1和630 cm-1处波谷突出振动能力强,而纤维素与半纤维素不明显,根据FTIR光谱振动强弱与化学标定数据一致性可知[13],木质素在未发酵的甘蔗渣中占比较大。而在发酵后的样品谱图中,3种组分的吸收峰发生了显著变化,木质素的特征峰在1582 cm-1、 1417 cm-1处的振动消失,同时630 cm-1、1130 cm-1吸收峰振动强度明显降低,说明木质素在同步糖化发酵过程中苯环骨架的C=O、C-H面内弯曲发生了氧化裂解,OH面外弯曲,C—O—C伸缩结构减少,表明木质素在发酵后含量降低。而发酵后出现振动增强的吸收峰归结为半纤维素C—O伸缩、C=O不对称弯曲和C=O伸缩振动,以及以1047 cm-1、 1730 cm-1、1630 cm-1为半纤维素特征的吸收峰增多。3种组分发酵前后的变化趋势表明,甘蔗渣中的木质素在同步糖化发酵过程中被大量降解但仍有一定残留,推测F10在同步糖化发酵的过程中,对木质素有较好的降解优势,与木质素形成的高分子抗性屏障被解聚后,纤维素和半纤维素的空间结构暴露出来,为菌株的同步糖化发酵提供了良好的底物条件。
3 结论
本研究通过刚果红染色、滤纸片崩解试验筛选获得一株具有较强纤维素水解能力菌株FOCmh2-2,水解圈直径达到4.5 cm,可使滤纸完全水解成糊状。其纤维素酶系统完全,酶活力良好,具备良好的五碳糖转化能力。随着发酵的进行,各纤维素酶与乙醇的生成量呈正相关增长,其中木聚糖酶的酶活最高,达到249.05 U·mL-1,可使半纤维素快速水解为五碳糖,且FOC-mh2-2能代谢普通菌株无法利用的五碳糖,可使纯木糖的产醇量达16.84 g·L-1。 且能在底物残糖近乎为0的条件下进行木质纤维素发酵,具备同步糖化发酵效能。经FTIR分析,在同步糖化发酵过程中木质素在发酵后含量降低,推测菌株在发酵过程中使木质素降解,改变了原料难以利用的特殊结构,使发酵快速进行。本试验筛选所得菌株FOC-mh2-2可同步实现木质纤维素的高效水解与糖化,可作为“一步法”乙醇发酵工艺的改良野生型菌株,为纤维素乙醇生产降低成本、提质、增效提供参考。
