小麦胁迫相关蛋白基因TaSAP12-D的耐盐性分析
2023-01-14王亦学郝曜山张欢欢董艳辉王晓清吴慎杰
王亦学 郝曜山 张欢欢 董艳辉 王晓清 吴慎杰
(山西农业大学生命科学学院,山西 太原 030031)
盐胁迫是影响作物生长发育和产量的主要非生物胁迫。随着全球气候变化以及不合理的灌溉,盐渍化土壤面积不断扩大,盐渍化程度不断加剧,严重制约作物的生长,造成经济产量的下降。培育耐盐作物是抵御盐胁迫的一种可行途径[1-2]。小麦(Triticum aestivumL.)是我国重要的粮食作物之一,但在生产过程中,盐胁迫会造成小麦产量和品质的下降,制约着小麦的安全生产[3]。因此,提高小麦对盐胁迫的适应性,对于小麦的高产稳产至关重要,其中发掘和利用小麦耐盐基因是改良小麦适应盐胁迫的前提和基础。
胁迫相关蛋白(stress associated proteins,SAPs)是一类具有A20/AN1 锌指结构域的蛋白,在植物中主要参与逆境胁迫的响应[4]。近年来,已对许多植物中的胁迫相关蛋白基因进行了分离与功能验证。最早研究的胁迫相关蛋白基因是水稻(Oryza sativaL.)的OsiSAP1基因,在高盐、干旱及低温条件下,过量表达该基因的烟草具有较高的萌发率和幼苗鲜重[5]。玉米(Zea maysL.)ZmAN13表达一个具有A20/AN1 锌指结构域的蛋白,该基因的表达受低温胁迫诱导,转该基因(ZmAM3)拟南芥对低温胁迫的耐受能力增强,却对高盐和干旱胁迫更加敏感[6]。拟南芥(Arabidopsis thaliana)AtSAP5参与调控高温胁迫相关基因的表达,该基因敲除突变体在高温胁迫条件下,幼苗的存活率显著降低[7]。AtSAP10可以增强拟南芥对镍、锰、锌等重金属以及高温胁迫的耐受性,表现为转基因拟南芥具有较高的幼苗鲜重与根长[8]。另外,在高粱[9]、番茄[10]、苜蓿[11-12]、香蕉[13]、苹果[14]、獐毛[15-16]等植物中均有关于SAP基因的报道,且这些基因都参与了逆境胁迫的响应。
目前已有小麦SAP基因功能研究的相关报道,包括TaSAP1、TaSAP2、TaSAP5、TaSAP7-A和TaSAP17-D。其中,TaSAP1可以提高拟南芥幼苗对渗透胁迫和高盐胁迫的耐受能力;TaSAP2可以提高拟南芥幼苗的抗渗透胁迫能力,进一步研究发现,转TaSAP1和TaSAP2基因的拟南芥苗中参与逆境调控的多个胁迫应答基因上调表达[17];TaSAP5可以增强拟南芥及小麦的抗旱性,且正常条件下转TaSAP5的拟南芥和小麦与对照植株相比,无显著形态和生长差异[18];TaSAP7-A可以增强拟南芥对渗透胁迫和高盐胁迫的敏感性,而且加速了离体叶片的叶绿素降解[19];TaSAP17-D通过上调渗透胁迫相关基因表达,提高了拟南芥幼苗的耐盐性[20]。中国农业科学院作物科学研究所景蕊莲课题组先前运用HMMER软件搜索到小麦基因组中包含A20/AN1 结构域的SAP 基因家族候选成员共23 个,利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测候选基因的表达模式,筛选出响应高盐胁迫的候选基因TaSAP12-D。基于此,本研究通过在拟南芥中过量表达TaSAP12-D基因来验证其生物学功能,同时检测部分盐胁迫响应基因的表达,旨在为小麦耐盐性方面的遗传改良提供理论依据和基因资源。
1 材料与方法
1.1 植物材料及其培养
使用小麦品种旱选10 号(来自中国农业科学院作物科学研究所景蕊莲课题组)进行基因克隆及表达模式分析。挑选籽粒饱满的小麦种子置于培养皿中,加去离子水后置于光照培养箱中水培,温度为23℃,光周期为12 h 光照/12 h 黑暗。在萌发期和幼苗期取样,包括胚芽、叶和根,用于基因的组织表达分析。待幼苗长至一心一叶期进行NaCl 处理,先将培养皿中的去离子水倾倒干净,后将250 mmol·L-1的NaCl 溶液加入培养皿中并浸没幼苗的根部,分别于加入溶液后0、0.5、1、3、6、9和12 h取幼苗的叶片用于盐胁迫条件下的基因表达分析。上述样品取样后迅速放入液氮中速冻,贮于-80 ℃备用。使用拟南芥哥伦比亚0 型(Arabidopsis thaliana,ecotype Columbia 0)进行基因的遗传转化,使用烟草(Nicotiana benthamiana)进行基因编码蛋白的亚细胞定位,培养条件为23 ℃,光周期为16 h光照/8 h黑暗。
1.2 目的基因的克隆与序列分析
根据HMMER软件搜索到的TaSAP12-D参考序列设计特异性引物TaSAP12-D-F和TaSAP12-D-R,以小麦cDNA为模板,用TransStart Fast PfuDNA Polymerase进行目的基因的克隆。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃终延伸10 min。使用在线分析软件ProtParam tool(https://web.expasy.org/protparam/)预测目的基因编码蛋白的分子量及等电点。目的基因编码的氨基酸序列提交到NCBI 数据库中进行BLASTP 比对,获得其他物种的同源序列,使用DNAMAN 和MEGA6软件分别进行多重序列比对和同源性分析。
1.3 目的基因的表达模式分析
设计qRT-PCR引物TaSAP12-D-RT-F和TaSAP12-D-RT-R,以小麦Actin基因为内参,分析目的基因在不同组织及盐胁迫条件下的表达模式。按照SYBRPremix Ex TaqII试剂盒(TaKaRa,日本)的说明进行操作。反应体系为15µL:cDNA 1.5µL、2×SYBRPremix Ex Taq7.5µL、ROX Reference Dye 0.3µL、5µmol·L-1正反向引物各0.3 µL,ddH2O 补至15 µL。使用ABI 7500 实时荧光定量PCR 仪(ABI,美国)进行扩增,反应条件为:95 ℃预变性120 s;95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s,45个循环。采用2-△△CT法计算目的基因的相对表达量[21]。
1.4 亚细胞定位
利用重组载体pCAMBIA1300-TaSAP12-D-GFP在烟草叶片中进行亚细胞定位。利用引物TaSAP12x-D-F 和TaSAP12k-D-R,以1.2 中克隆的目的基因为模版进行PCR 反应,反应条件同1.2,将目的基因引入XbaI 和KpnI 酶切位点,双酶切后将目的基因(不含终止子)构建到植物表达载体pCAMBIA1300的多克隆位点内,采用热激法将其转化到GV3101 农杆菌中,震荡培养至OD 值为1 时收集菌体,重悬后注射烟草叶片,培养2 d后观察荧光信号。
1.5 转基因拟南芥的耐盐性分析
利用1.4 中包含目的基因的农杆菌进行拟南芥的转化。采用蘸花法[22]对盛花期的拟南芥进行侵染,经潮霉素筛选和qRT-PCR 检测,获得T3代转基因纯合株系,选取目的基因表达量相对较高的3 个株系用于耐盐性分析。将野生型(wild type,WT)、转空载体植株(vector control,VC)和转基因植株(L1、L2 和L3)的拟南芥种子用10%的NaClO 溶液消毒处理15 min,再用无菌水冲洗7~8 次,播种于MS 培养基(Murashige and skoog culture medium)及添加150 mmol·L-1NaCl 的MS培养基上,4 ℃春化处理2 d,随后在光照培养箱中培养14 d后观察植株生长情况,计算植株存活率,每个处理设3次生物学重复。
1.6 转基因拟南芥盐胁迫响应基因的表达分析
为揭示目的基因在盐胁迫条件下的作用机制,以拟南芥Actin基因为内参,将正常条件培养10 d 和盐胁迫处理10 d的转基因拟南芥叶片和对照植株叶片作为试验材料,采用qRT-PCR 对盐胁迫相关应答基因AtP5CS1、AtRD29A、AtLEA、AtSOS1、AtNHX1和AtHKT等的表达模式进行分析。

表1 试验中使用的引物Table 1 Primers used in the experiments
2 结果与分析
2.1 TaSAP12-D的克隆及序列分析
根据HMMER 软件搜索小麦D 基因组数据库得到目的基因的参考序列,设计特异性引物,从小麦品种旱选10 号中扩增目的基因。序列分析表明,该基因序列全长519 bp,编码172 个氨基酸,命名为TaSAP12-D,其编码的蛋白在N 端有1 个A20 结构域,在C 端有1 个AN1结构域,属于SAP蛋白最常见的组合类型,预测其蛋白分子量为18.41 kDa,等电点为9.21。
将TaSAP12-D 的氨基酸序列提交到NCBI 数据库中进行BLASTP 比对,获得其他物种的同源序列。利用DNAMAN 进行多重序列比对,结果显示TaSAP12-D与其他植物中的A20结构域和AN1结构域的氨基酸序列高度相似(图1-A)。利用MEGA6进行同源性分析,TaSAP12-D 可与其他单子叶植物的SAP 划分为一类,包括大麦(Hordeum vulgare)、谷子(Setaria italica)、水稻和高粱(Sorghum bicolor),其他双子叶植物的SAP 划分为另一类(图1-B)。
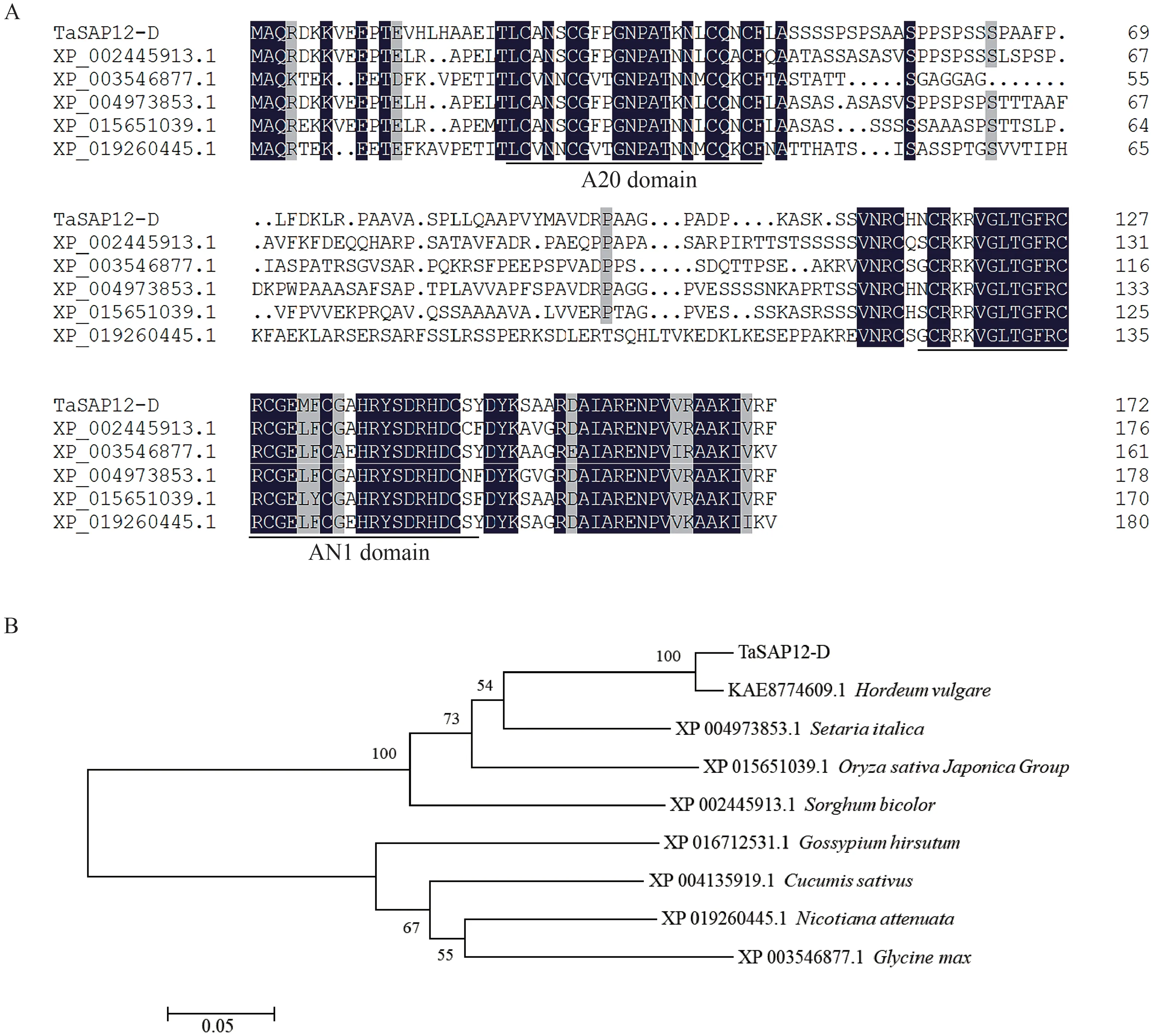
图1 TaSAP12-D的多重序列比对(A)与同源性分析(B)Fig.1 Multiple alignments(A)and homology analysis(B)of TaSAP12-D
2.2 TaSAP12-D的亚细胞定位
为了解TaSAP12-D 在细胞中的表达部位,将TaSAP12-D 与GFP 进行融合。构建融合表达载体pCAMBIA1300-TaSAP12-D-GFP,将其转入农杆菌中并注射烟草叶片,以空载体pCAMBIA1300-GFP 作为对照,在激光共聚焦显微镜下观察荧光信号。结果表明TaSAP12-D在细胞核和细胞质中均有表达(图2)。
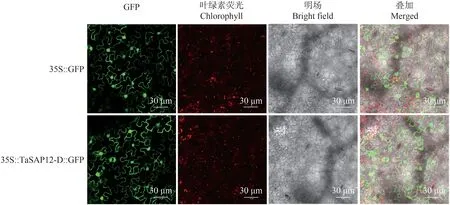
图2 TaSAP12-D的亚细胞定位Fig.2 Subcellular localization of TaSAP12-D
2.3 TaSAP12-D的表达模式分析
为揭示TaSAP12-D在小麦不同组织的表达模式,分别选取了萌发期的胚芽、根,以及幼苗期的叶、根进行qRT-PCR。结果显示,TaSAP12-D在萌发期和幼苗期的胚芽、叶、根中均有表达,但在幼苗期的叶中表达量最高,其表达量是幼苗期根部表达量的3.7 倍;在萌发期的根部表达量最低,胚芽的表达量是根部的2.4 倍(图3-A)。用NaCl 对小麦幼苗进行盐胁迫处理,发现TaSAP12-D的表达水平随时间呈现先升高后降低的趋势,在处理1 h 时达到高峰,约为对照的4.1 倍,表明TaSAP12-D参与了高盐胁迫响应(图3-B)。
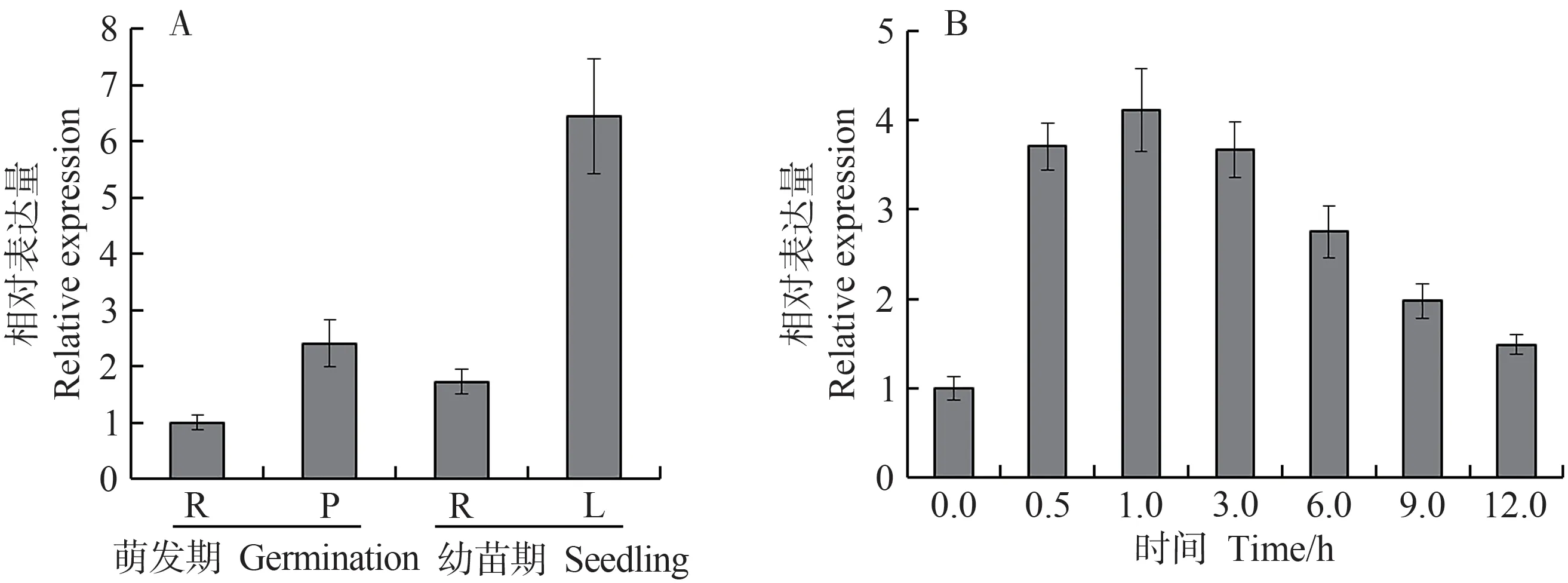
图3 TaSAP12-D在不同组织(A)和盐胁迫下(B)的表达Fig.3 Expression of TaSAP12-D in different tissues(A)and under salt stress treatment(B)
2.4 过表达TaSAP12-D增强拟南芥的耐盐性
对转TaSAP12-D拟南芥进行正常条件培养和盐胁迫处理14 d,在MS培养基上野生型、转空载体植株(VC)和转基因拟南芥(L1、L2和L3)均能正常生长,且长势基本一致,说明TaSAP12-D并未对拟南芥的生长产生影响;在添加150 mmol·L-1NaCl的MS培养基上,野生型和转空载体植株的叶片发黄,甚至变白死亡,而转基因拟南芥的叶片仅少部分发黄和变白死亡(图4-A)。利用qRT-PCR检测T3代转基因拟南芥纯系中TaSAP12-D的表达量,测得3 个转基因拟南芥纯系中TaSAP12-D的表达量依次是野生型(WT)的36、50 和42 倍(图4-B)。存活率统计显示,野生型和转空载体植株的存活率分别为34.2%和37.5%,两者无显著差异;而3 个转基因拟南芥的存活率依次为81.7%、86.7%和83.3%,极显著高于野生型植株(图4-C),并且与转基因拟南芥中TaSAP12-D的表达量变化趋势一致,说明过表达TaSAP12-D增强了拟南芥的耐盐性。

图4 转TaSAP12-D拟南芥的耐盐性分析Fig.4 Analysis of Salt-tolerance in TaSAP12-D transgenic Arabidopsis
2.5 转TaSAP12-D 拟南芥盐胁迫响应基因的表达分析
为揭示TaSAP12-D在盐胁迫条件下的作用机制,采用qRT-PCR 检测与盐胁迫相关应答基因的表达情况。结果表明,在盐胁迫下,渗透调节基因,如脯氨酸合成的关键基因(Δ1-吡咯啉-5-羧酸合成酶基因P5CS1)、脱水诱导基因(RD29A)、胚胎发育晚期丰富蛋白基因(LEA)的表达量极显著增高,是WT 的3.1~13.3 倍;离子转运基因,如盐超敏感基因(SOS1)、Na+/H+转运蛋白基因(NHX1)、高亲和性钾离子转运蛋白基因(HKT)的表达量同样显著或极显著增高,是WT 的1.5~3.2 倍(图5)。由此推测,TaSAP12-D在盐胁迫条件下,可能通过调控上述两类基因的表达,一方面缓解渗透胁迫,另一方面调节离子平衡,从而增强转基因拟南芥的耐盐性。

图5 转TaSAP12-D拟南芥盐胁迫相关基因的表达Fig.5 Expression of salt-stress relative genes in TaSAP12-D transgenic Arabidopsis
3 讨论
为抵御外界不良环境,植物在长期进化过程中,从形态建成以及生理代谢途径等方面形成了一系列复杂的防御机制,以保证其正常的生长和繁衍[23-24]。当植物遇到逆境时,外界的胁迫信号会传递到植物体内,从而改变遗传调控网络,启动胁迫相关基因的表达,来缓解胁迫带来的伤害[25-26]。本研究从小麦D基因组中克隆得到胁迫相关蛋白基因TaSAP12-D,其编码的蛋白在N 端和C 端分别含有1 个A20 结构域和1 个AN1 结构域,属于SAP 蛋白最常见的组合类型,先前报道的TaSAP1、TaSAP2和TaSAP5也属于此组合类型[17-18]。
蛋白质在细胞中的定位反映了其在细胞中行使功能的部位。TaSAP12-D 的亚细胞定位显示,其在细胞核和细胞质中均有分布,这与TaSAP5、TaSAP7-A 和TaSAP17-D 的亚细胞定位结果相一致[18-20]。有文献报道,部分A20/AN1型的SAP蛋白具有E3泛素连接酶功能[18,27-28],因此推测TaSAP12-D 可能作为转录因子在细胞核内发挥功能,或者泛素化降解某类蛋白,在细胞质中进行蛋白质翻译后的修饰。基因的时空表达与其生物学功能密切相关。已有报道发现,TaSAP17-D的表达水平受盐胁迫诱导[20]。本研究中,组织表达分析显示,TaSAP12-D在幼苗期的叶中表达量高,因此选择在幼苗期进行盐胁迫处理,对叶片中TaSAP12-D的表达水平进行分析,结果表明其在盐胁迫条件下表达量同样上调,暗示其在应对盐胁迫中发挥功能。
土壤中过多的盐离子常常会导致植物生长发育缓慢,植株矮小甚至死亡,即盐胁迫是影响植物生长发育的重要环境因素之一[29]。高浓度的盐离子一方面影响植物根系对水分的吸收,产生渗透胁迫;另一方面会破坏植物细胞中的离子平衡,产生离子毒害。在盐渍化的土壤中,作物难以正常生长,利用盐渍化土地资源的有效措施之一就是挖掘作物中的耐盐基因资源,从而提高作物的耐盐性,培育出耐盐新品种[30]。耐盐基因资源一般包括调节基因和功能基因两大类[31]。调节基因在早期表达,可以通过调控和启动下游的多个代谢途径来行使生物学功能,因而得到广泛的关注。本研究将TaSAP12-D基因转入拟南芥中,并未发现该基因对拟南芥的生长产生影响;但在盐胁迫条件下,转基因拟南芥叶片仅少部分发黄和变白死亡,存活率显著高于野生型和转空载体植株,说明过表达TaSAP12-D增强了拟南芥的耐盐性。前人研究表明,TaSAP1可以提高拟南芥幼苗的耐盐能力,同时参与逆境调控网络的多个重要胁迫应答基因上调表达[17]。TaSAP17-D同样可以增强拟南芥的耐盐性,且渗透调节相关基因上调表达,推测其耐盐性的增强与渗透调节能力的提高有关[20]。本研究中,转TaSAP12-D拟南芥中盐胁迫相关应答基因AtP5CS1、AtRD29A、AtLEA、AtSOS1、AtNHX1和AtHKT的表达量均显著或极显著上调,推测TaSAP12-D可能通过调控上述两类基因的表达来调节细胞的渗透势和维持离子平衡,从而提高转基因拟南芥的耐盐性。
4 结论
本研究从小麦品种旱选10号中克隆得到TaSAP12-D基因,其编码的蛋白在N 端和C 端分别含有1 个A20结构域和1 个AN1 结构域,亚细胞定位显示其在细胞核和细胞质中均有表达。TaSAP12-D在小麦萌发期和幼苗期的胚芽、叶、根中均有表达,但在幼苗期的叶中表达量最高,且该基因在盐胁迫条件下表达量上调。过表达TaSAP12-D增强转基因拟南芥的耐盐性,在转基因拟南芥中盐胁迫相关应答基因AtP5CS1、AtRD29A、AtLEA、AtSOS1、AtNHX1和AtHKT的表达量均显著或极显著上调,推测TaSAP12-D可能通过调控上述基因的表达来增强转基因拟南芥的耐盐性。综上所述,TaSAP12-D在应答盐胁迫的遗传调控网络中具有比较重要的作用,是改良作物耐盐性的重要候选基因。
