番茄SlPSY1基因转录调控因子筛选及互作验证
2023-01-14李松文孟凡亮刘丽红李园园汪俏梅
李松文 孟凡亮 刘丽红 简 越 李园园 汪俏梅
(浙江大学园艺系/农业农村部园艺植物生长发育与品质控制重点开放实验室,浙江 杭州 310058)
番茄(Solanum lycopersicum)是茄科番茄属一年生草本植物,起源于南美洲,具有悠久的栽培史,是我国乃至世界范围内种植最广泛的蔬菜之一。番茄果实风味独特,营养丰富,富含多种生物活性物质,深受消费者的青睐[1]。番茄因具有较小的基因组、较短的生长发育周期、其转基因技术已经成熟等优点,成为分子研究领域的模式植物。2012年番茄全基因组序列得到解析,在很大程度上推动了以番茄为模式植物的分子生物学研究[1]。番茄果实的成熟是其生长发育的重要过程,因此成为研究的重点,其成熟过程主要包括外观品质、风味品质和营养品质的形成。其中类胡萝卜素的组分和含量变化是番茄果实成熟过程中的重要变化之一,也是番茄品质形成的重要基础。
类胡萝卜素是普遍存在于自然界的脂溶性天然色素,存在于所有光合生物(植物、光合藻类和光合细菌)[2-3]、部分非光合细菌和真菌中[4],在光合生物中的主要生物学功能是光合作用和光保护[5];在哺乳动物中,部分类胡萝卜素作为维生素A(视黄醇)的前体,对视力和细胞生长分化等多个生理过程起着关键作用[6],同时在抗氧化[7-8]、预防心血管疾病[9]、抗癌[10]等方面也具有重要功效,在食品[11]、化工[12]、医药[13-14]等领域应用广泛。
类胡萝卜素在成熟番茄果实中的含量丰富,是番茄果实品质的重要组成部分。目前番茄中类胡萝卜素的合成途径已经得到充分解析。类胡萝卜素的合成在质体中完成,从来自2-甲基赤藓糖醇-4-磷酸(2-Cmethyl-D-erythritol-4-phosphate,MEP)途径产生的异戊烯焦磷酸(isopentenyl diphosphate,IPP)和二甲基丙烯基焦磷酸(dimethylallyl diphosphate,DMAPP)[15]开始,经牻牛儿牻牛儿焦磷酸合成酶(geranylgeranyl pyrophosphate synthase,GGPPS)催化合成牻牛儿牻牛儿焦磷酸(geranylgeranyl diphosphate,GGPP),再由八氢番茄红素合成酶1(phytoene synthase 1,PSY1)催化两分子GGPP 缩合形成15-顺式-八氢番茄红素[16-17],进而通过八氢番茄红素脱氢酶(phytoene desaturase,PDS)、ζ-胡萝卜素异构酶(ζ-carotene isomerase,ZISO)和ζ-胡萝卜素去饱和酶(ζ-carotene desaturase,ZDS)催化的连续生物反应产生顺式番茄红素,然后由类胡萝卜素异构酶(carotene isomerase,CrtISO)转化为反式番茄红素,进一步合成α-和β-胡萝卜素[18-19]。在这一途径中,PSY1 是关键的限速酶,该酶的缺失将阻碍果实成熟期间类胡萝卜素的合成,使果实呈现出黄色[20],而过表达将提高果实中类胡萝卜素的积累[21]。茄科不同番茄属中的同源PSY1基因具有高度保守的活性位点和催化位点,PSY1基因的表达与番茄果实中类胡萝卜素含量直接相关[17,22]。
在拟南芥中,光敏色素互作因子PIF1(phytochrome interacting factor 1)可直接结合AtPSY1启动子上的Gbox 负调控AtPSY1的表达;在pif突变体中,AtPSY1具有更高的表达量,且植株中类胡萝卜素含量更高[23];bZIP 家族转录因子HY5(long hypocotyl 5)同样结合AtPSY1启动子上的G-box 区域,正向调控AtPSY1的表达[24]。在番茄中,HY5 可结合SlPSY1启动子区域的G-box 和ACE-box,正向调控其表达,hy5突变体果实成熟延迟,类胡萝卜素含量明显降低[25];MADS家族转录因子TAGL1(tomato agamous-like 1)、RIN(ripening inhibitor)和FUL1(fruitfull 1)可直接结合SlPSY1的启动子,正向调控SlPSY1的表达[26];PIF1a可结合SlPSY1启动子区域的PBE-box,负调控其表达;NAC家族转录因子NAC1 也可结合SlPSY1启动子而抑制其表达;Bbox 家族蛋白BBX20 可结合SlPSY1启动子区域的Gbox 调控SlPSY1的表达,过表达BBX20 可使SlPSY1表达量上升,且果实中类胡萝卜素含量升高[26-27];STAYGREEN(SlSGR)基因编码的SlSGR1 蛋白与SlPSY1 蛋白可聚合为二聚体形式抑制SlPSY1 蛋白活性,抑制SlSGR1的表达可以促进果实番茄红素和β-胡萝卜素的积累[28]。为深入探索番茄类胡萝卜素代谢的转录调控网络,本研究利用酵母单杂交筛库技术筛选直接结合SlPSY1基因启动子的转录因子,研究转录因子在番茄果实发育和品质形成中的关键作用及其分子机制,以期为进一步解析番茄类胡萝卜素的代谢调控网络提供理论基础。
1 材料与方法
1.1 试验材料及试剂
番茄样品为浙江大学农业与生物技术学院汪俏梅教授实验室种植的野生型Solanum lycopersicumL.Mill.cv.Ailsa Craig(AC);限制性内切酶购自赛默飞世尔公司(上海);KOD Fx酶购于硕盟生物科技有限公司(杭州);入门载体pEASY Blunt Zero cloning vector 和Trans1-T1感受态细胞购于创试生物科技有限公司(杭州);大肠杆菌E.coliDH5α、Y1H Gold 感受态细胞、PEG/LiAc 和Carrier DNA 购于唯地生物技术有限公司(上海);Solution ⅠDNA 连接酶购于宝生物工程(大连)有限公司;金担子素(aureobasidin A,AbA)购于翊圣生物科技有限公司(上海);Easy Yeast Plasmid Isolation Kit酵母质粒提取试剂盒(Cat.No.630467)购于柏赞生物科技有限公司(杭州);引物序列均由擎科生物科技有限公司合成(杭州)。
1.2 试验方法
1.2.1 基因表达模式的分析 根据基因号,在Tomato eFP Browser(http://bar.utoronto.ca/efp_tomato/cgi-bin/efpWeb.cgi)网站上搜索SlPSY1及其同源基因的表达量数据,基于检索得到的表达量数据,利用TBtools 软件进行不同基因的表达热图分析,使用Origin 9软件对不同基因的表达量进行柱状图分析。
1.2.2 构建酵母诱饵表达载体
1.2.2.1 目的基因启动子序列的克隆 在植物基因组资源网站(https://phytozome-next.jgi.doe.gov/)中搜索SlPSY1基因启动子序列(SlPSY1pro),设计启动子的引物F1:5′-CGACGATAACAAGGATTAGGCAAC-3′和R1:5′-CTCTTTCAACAATGGCCACTCTG-3′进行PCR扩增(体系和程序参照KOD FX酶说明书),将扩增的片段(启动子序列见附录)连接至入门载体pEASY Blunt Zero cloning vector 上,获得重组质粒SlPSY1pro-pEASY,转化至Trans1-T1 感受态细胞中,在含卡那霉素的LB(Luria-Bertani medium)固体培养基上37 ℃培养过夜,挑选单菌落用引物F1 和R1 进行阳性检测,选择阳性菌落进行摇菌并送至北京擎科生物科技有限公司测序,对测序正确的菌株用70%的甘油进行保存,液氮速冻并放入-80 ℃冰箱备用。
1.2.2.2 目的基因启动子序列连接pAbAi 载体 设计带有KpnⅠ和SalⅠ酶切位点和保护碱基的引物F2:5′-GGggtaccCGACGATAACAAGGATTAGGCAAC-3′和R2:5′-GCgtcgacCTCTTTCAACAATGGCCACTCTG-3′,以测序正确的重组质粒SlPSY1pro-pEASY 为模板用KOD 高保真酶进行PCR 扩增(体系和程序见KOD FX酶说明书),将PCR产物和pAbAi载体用限制性内切酶KpnⅠ和SalⅠ酶切,酶切后的PCR 产物和载体采用solution ⅠDNA 连接酶进行连接,转化至大肠杆菌E.coliDH5α 中,涂板至氨苄霉素LB 固体培养基,37 ℃培养过夜,挑选单菌落使用载体引物pAbAi-F:5′-GTTCCTTATATGTAGCTTTCGACA-3′和片段引物R2进行阳性检测,挑取阳性菌落摇菌测序,将测序正确的菌株用70%的甘油进行保存,液氮速冻并放入-80 ℃冰箱保存,即得到pSlPSY1pro-AbAi重组质粒。
1.2.2.3 诱饵报告酵母菌株的构建 使用BstB I 限制性内切酶在65 ℃条件下将pSlPSY1pro-AbAi 重组质粒酶切3 h,使其在URA3 基团处断开而处于线性化状态。以未酶切的重组质粒为对照,将酶切产物进行琼脂糖凝胶电泳检测,并纯化回收酶切产物。取100µL冰上融化的Y1H Gold 感受态细胞,依次加入冰上预冷的线性化pSlPSY1pro-AbAi 重组质粒2~5 µg,Carrier DNA(95~100 ℃,5 min,快速冰浴,重复2 次)10 µL,PEG/LiAc 500µL并吸打混匀,30 ℃水浴30 min,42 ℃水浴15 min,5 000 r·min-1离心40 s,弃上清;加入400µL ddH2O 重悬,离心30 s 弃上清;加入50µL ddH2O 重悬,涂板于预先配制的SD/-Ura 固体培养基中,30 ℃培养48~96 h。挑选部分酵母单一菌落,用Matchmaker Insert Check PCR Mix 1 体系进行菌落PCR(体系和程序参照2×Taq 酶说明书),以验证pSlPSY1pro-AbAi 重组质粒是否转化至酵母细胞中。分别挑取PCR 检测呈阳性的诱饵克隆,在SD/-Ura 平板上划线培养。30 ℃条件下孵育3 d 后,将平板置于4 ℃保存,即为新构建的pSlPSY1pro-AbAi 酵母菌株。挑取单克隆在YPDA 液体培养基(yeast extract peptone dextrose adenine medium)中过夜培养,离心收集菌体,用1 mL预冷培养基[100 mL 灭菌的YPDA 与50 mL 灭菌的75%甘油混合],重悬菌体,液氮速冻后置于-80 ℃条件下保存。
1.2.3 酵母单杂筛库
1.2.3.1 cDNA 文库的构建 取野生型番茄(AC)的叶片以及绿熟期和红熟期果实的鲜样,送至TaKaRa公司(杭州)构建番茄混合组织酵母杂交cDNA文库。
1.2.3.2 酵母感受态细胞的制备 吸取10 µL 保存于-80 ℃的pSlPSY1pro-AbAi 酵母菌株至10 mL YPDA液体培养基中,30 ℃、200 r·min-1摇菌2 d,待酵母摇至OD600为1.0 左右即可;取10 mL 酵母菌液转移到含有200 mL YPDA 液体培养基的1 L 锥形瓶中,摇菌至OD600为0.4~0.6,将酵母菌液分装到5个50 mL离心管,室温下4 000 r·min-1离心5 min;弃上清,向每个离心管中加入25 mL ddH2O,震荡重悬,室温下4 000 r·min-1离心5 min;弃上清,向每个离心管中加入200 µL 现配的LiAc/TE 溶液,重悬酵母菌液并立即置于冰上备用。
1.2.3.3 酵母转化 吸取100µL 冰上制备的酵母感受态,依次加入预冷的cDNA 文库2~5µg,Carrier DNA 10 µL(95 ℃,5 min,快速冰浴,重复2 次),PEG/LiAc 500 µL 并用枪头吸打混匀,30 ℃水浴30 min;42 ℃水浴15 min,室温下5 000 r·min-1离心40 s 弃上清;加入400 µL ddH2O 重悬,离心30 s 弃上清;加入150 µL ddH2O 重悬,吸取100 µL 涂板于预先配制的SD/-Leu/AbA150固体培养基,30 ℃条件下培养4~6 d。
1.2.3.4 阳性克隆的鉴定 将阳性克隆在SD/-Leu/AbA150固体培养基上重新划线,产生新的单克隆,2~4 d后,选择能够正常生长的单克隆,加入3~5 mL SD/-URA的液体培养基,30 ℃、200 r·min-1条件下过夜摇菌;为了鉴定阳性互作的基因,用酵母质粒提取试剂盒提取酵母质粒;将提取的酵母质粒转化至大肠杆菌中,并用含有100µg·mL-1氨苄青霉素的LB 固体培养基中进行筛选,挑选能正常生长的大肠杆菌,使用2×Taqmix 50µL体 系,以T7:5′-TAATACGACTCACTATAGGG-3′和3′AD:5′-AGATGGTGCACGATGCACAG-3′为引物,对插入到pGADT7 载体中的cDNA 片段进行PCR 扩增(体系和程序参照2×Taq 酶说明书),取10 µL PCR 产物在1%的琼脂糖凝胶上进行电泳分析,挑选阳性产物送至北京擎科生物科技有限公司利用T7引物测序。然后将测序结果在JGI网站上(https://phytozome-next.jgi.doe.gov/)进行在线比对,确认未产生移码突变,即作为候选基因继续酵母单杂点对点验证试验。
1.2.4 酵母单杂点对点验证 根据JGI 网站数据库中SlJERF1基因序列设计PCR 引物,以番茄叶片的总RNA经反转录得到番茄cDNA,用KOD Fx酶进行PCR扩增,连接至入门载体pEASY Blunt Zero cloning vector 上,得到SlJERF1-pEASY 重组质粒。用分别带有EcoR Ⅰ和BamH Ⅰ酶切位点和保护碱基的SlJERF1特异性引物F3:5′-GgaattcATGTGTGGTGGTGCAATTATCTC-3′和R3:5′-CGggatccTTAGTAGGCACCTCCCATTAAAG-3′,以SlJERF1-pEASY 重组质粒为模板,进行PCR 扩增(体系和程序参照KOD FX 酶说明书),得到带有酶切位点的SlJERF1特异性片段。将产物进行切胶回收并纯化,用限制性内切酶EcoR Ⅰ和BamH Ⅰ对SlJERF1特异性片段和pGADT7-AD 载体进行双酶切,回收目的片段和酶切后的载体,用Solution ⅠDNA 连接酶进行连接,得到pGADT7-SlJERF1重组质粒,将其转化pSlPSY1pro-AbAi 菌株感受态细胞,涂布于SD/-Leu 和SD/-Leu/AbA150培养基,30 ℃条件下培养3 d,以pGADT7-AD 空载转化到pSlPSY1pro-AbAi 酵母作为阴性对照,观察菌斑生长情况。
2 结果与分析
2.1 SlPSY1及其同源基因表达模式的分析
对番茄PSY的3 个同源基因SlPSY1(Solyc03g0318 60)、SlPSY2(Solyc02g081330)和SlPSY3(Solyc01g0059 40)进行分析,结果显示SlPSY1在番茄果实成熟过程中发挥着至关重要的作用。由图1可以看出,SlPSY2和SlPSY3在番茄生长发育的整个过程中表达量较低或不表达,而SlPSY1基因在果实成熟,特别是破色期之后表达量急剧升高。为深入探索番茄果实类胡萝卜素代谢的转录调控机制,利用酵母单杂交筛库技术筛选直接结合SlPSY1基因启动子的转录因子。
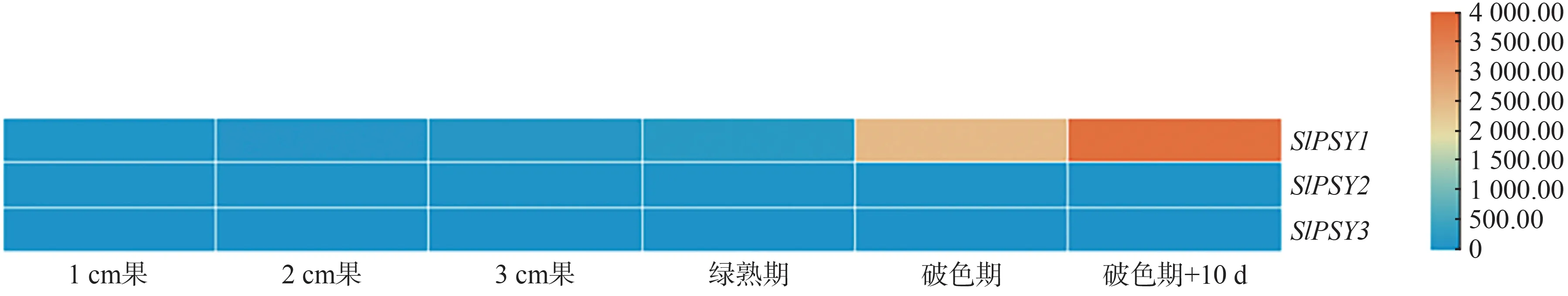
图1 SlPSY1及其同源基因在不同时期表达量Fig.1 Expression of SlPSY1 and its homologous genes in different periods
2.2 pSlPSY1pro-AbAi酵母诱饵表达载体的构建
根据SlPSY1基因启动子序列,使用特异性引物F1和R1进行PCR扩增,结果如图2-A所示,扩增条带大小为1 016 bp,将目的片段转入至入门载体pEASY Blunt Zero cloning vector上,获得重组质粒SlPSY1pro-pEASY。以重组质粒SlPSY1pro-pEASY 为模板,使用带有KpnⅠ和SalⅠ酶切位点和保护碱基的引物F2 和R2进行PCR 扩增,并将PCR 产物和pAbAi 载体用限制性内切酶KpnⅠ和SalⅠ酶切,连接,并转入大肠杆菌,使用引物pAbAi-F 和引物R2 进行PCR 检测,如图2-B 所示,阳性pSlPSY1pro-AbAi载体的扩增条带大小为1 270 bp。将阳性pSlPSY1pro-AbAi 线性化,结果如图2-C 所示,为环状和线性化的pSlPSY1pro-AbAi载体,将线性化的pSlPSY1pro-AbAi 载体转入Y1H Gold 感受态细胞,用Matchmaker Insert Check PCR Mix1 对Y1H Gold 酵母感受态细胞进行琼脂糖凝胶电泳检测,如图2-D所示,阳性诱饵载体电泳条带大小为2 350 bp,表明pSlPSY1pro-AbAi 酵母诱饵表达载体构建成功。
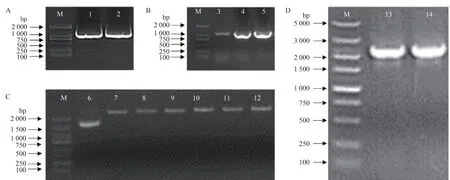
图2 pSlPSY1pro-AbAi酵母诱饵表达载体构建Fig.2 Construction of pSlPSY1pro-AbAi yeast bait vector
2.3 AbA背景浓度的筛选
以SlPSY1pro-pEASY质粒为模板进行PCR获得目的启动子序列并构建到诱饵载体上,将获得的pSlPSY1pro-AbAi 重组质粒经线性化并转化Y1H Gold酵母感受态细胞,得到阳性诱饵菌株,经摇菌并涂布于SD/-Ura固体培养基上筛选,观察酵母生长情况。结果显示,抑制酵母生长的AbA 最小浓度为100 ng·mL-1,在后续试验中采用150 ng·mL-1的AbA 浓度以充分抑制酵母的生长。
2.4 酵母单杂筛库
通过酵母单杂交技术筛选出与番茄PSY1启动子结合的蛋白。转化后的酵母在SD/-Leu/AbA150固体培养基上生长3~5 d,为减少假阳性,将长出的酵母菌斑在SD/-Leu/AbA150固体培养基上重新划线培养,初步排除假阳性后,利用T7 和3′AD 引物进行PCR,对插入到pGADT7 载体中的cDNA 片段进行扩增,如图3所示,电泳结果表明条带长度大部分在500~1 500 bp 之间。经测序并在JGI 网站进行蛋白预测分析,结果如表1所示,初步获得SlJERF1转录因子和多个未知功能的蛋白,选择ERF 家族转录因子SlJERF1 进行酵母单杂点对点验证。

图3 酵母单杂交筛库部分菌落PCR鉴定Fig.3 PCR identification of selected colonies in yeast-one-hybrid screening library

表1 SlPSY1启动子DNA结合蛋白筛选Table 1 The binding protein screening of SlPSY1 promoter sequence
2.5 酵母单杂点对点互作验证
利用特异性引物克隆获得SlJERF1基因大小为11.9 bp(如图4-A 所示)。图4-B 为成功构建的pGADT7-SlJERF1重组质粒电泳图,将重组质粒和pGADT7-AD 空载分别转化至pSlPSY1pro-AbAi 酵母感受态细胞,涂布于SD/-Leu 和SD/-Leu/AbA150固体培养基上,如图4-C 所示,pGADT7-AD 空载对应的酵母细胞在SD/-Leu 培养基上正常生长,而在SD/-Leu/AbA150培养基上不能正常生长;pGADT7-SlJERF1重组质粒对应的酵母细胞在SD/-Leu和SD/-Leu/AbA150培养基上均能正常生长,表明SlJERF1 与SlPSY1基因启动子之间的相互作用激活了报告基因AbAr的表达,进而证明转录因子SlJERF1与SlPSY1基因启动子间存在互作。为进一步验证其互作关系,取0、10-1、10-2和10-3四种稀释倍数的pGADT7-SlJERF1重组质粒对应的酵母感受态细胞和pGADT7-AD 空载对应的酵母感受态细胞滴板于SD/-Leu 和SD/-Leu/AbA150固体培养基上,如图4-D 所示,在SD/-Leu 培养基上,pGADT7-AD 和pGADT7-SlJERF1在四种稀释倍数下均能正常生长;而在SD/-Leu/AbA150培养基上,pGADT7-AD 在不稀释的情况下只有微弱的生长,在10-1、10-2和10-3三种稀释倍数下均不能正常生长,pGADT7-SlJERF1在0、10-1、10-2和10-3四种稀释倍数下均能正常生长,由此进一步证明了SlJERF1与SlPSY1基因启动子存在互作。
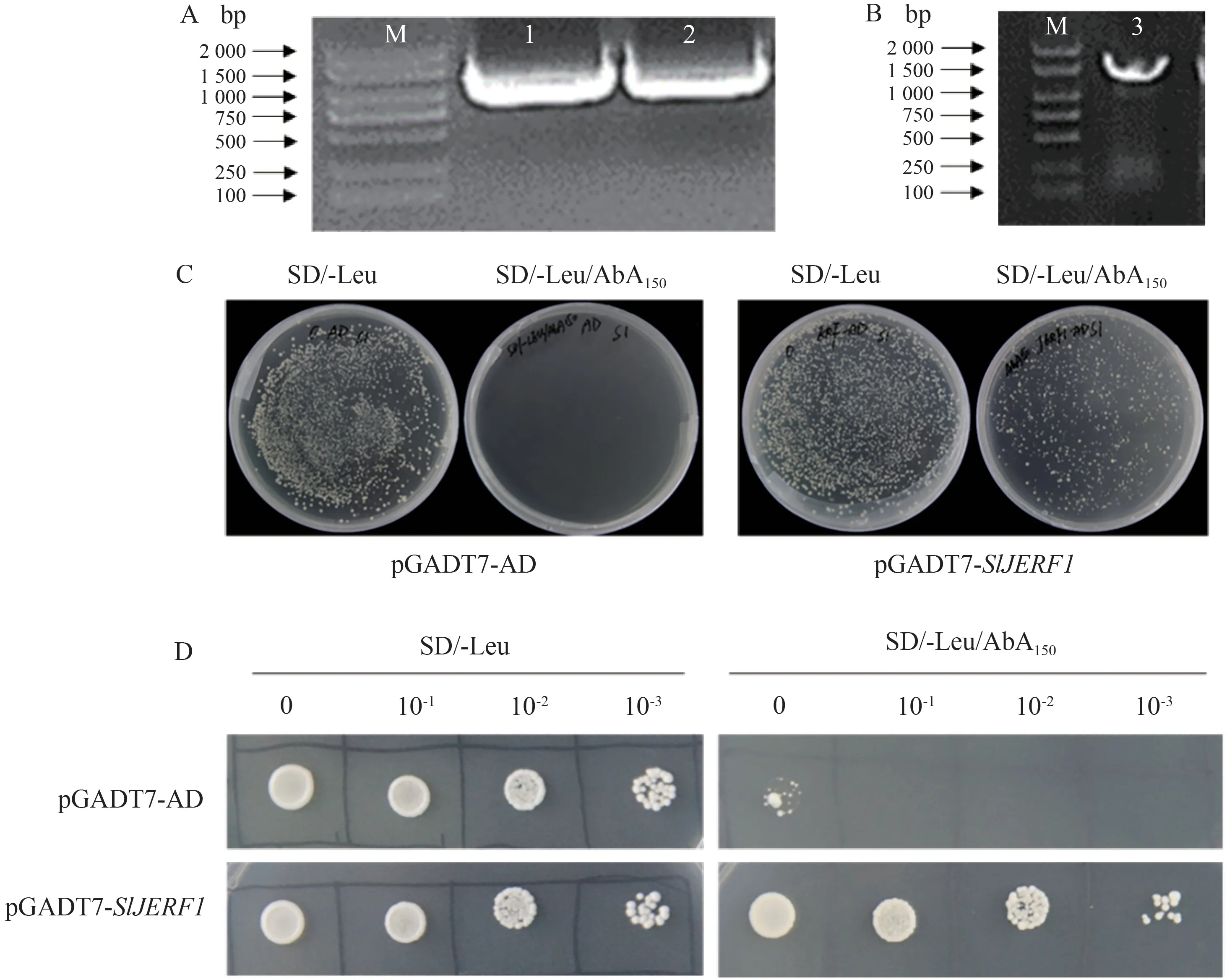
图4 SlJERF1酵母点对点验证Fig.4 SlJERF1 yeast point-to-point validation
2.6 SlPSY1及SlJERF1的共表达分析
利用Tomato eFP Browser 网站检索SlPSY1(Solyc03g031860)和SlJERF1(Solyc06g063070)基因不同时期的表达量数据,结果如图5所示。从1 cm 果开始,SlPSY1和SlJERF1的表达量均逐渐提高,其中SlJERF1的表达量在破色期达到峰值,而SlPSY1的表达量在破色期后继续增高,表明SlJERF1的表达量峰值提前于SlPSY1的表达量峰值,符合转录因子调控功能蛋白的表达模式,从侧面反映了SlJERF1 可能调控SlPSY1的表达。
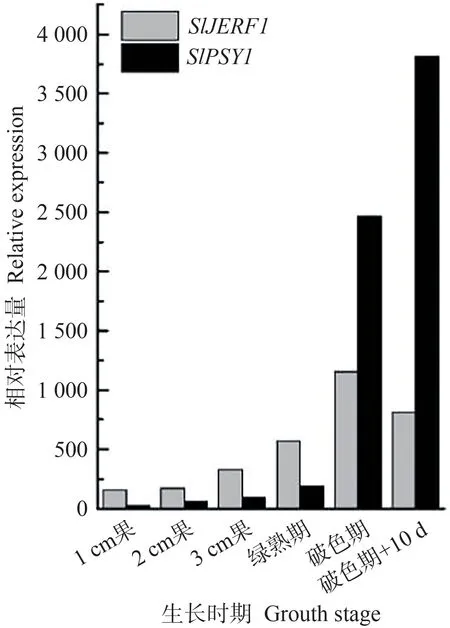
图5 SlPSY1和SlJERF1在番茄果实不同生长时期的相对表达量Fig.5 Relative expression of SlPSY1 and SlJERF1 in tomato fruit at different growth stages
3 讨论
酵母单杂交技术是利用目的基因上游的启动子诱饵序列,与cDNA 文库之间的猎物转录因子进行相互作用,启动诱饵序列下游报告基因的表达,通过筛选得到与诱饵序列互作的转录因子,是筛选转录因子的有效方法[29]。本研究利用酵母单杂交技术,以SlPSY1基因启动子序列为诱饵,筛选出调控SlPSY1基因的转录因子SlJERF1,并通过酵母单杂点对点验证试验证明了SlJERF1与SlPSY1基因启动子存在互作。
SlJERF1属于AP2/ERF(APETALA2/ethylene responsive element binding factors)大家族,ERF亚族的转录因子。已有研究表明,AP2/ERF 转录因子包含大约由60个氨基酸组成的AP2 DNA 结合域,可直接与顺式作用元件相互作用[30],包括脱水反应元件(dehydration responsive element,DRE)、C 重复元件(C-repeat element,CRT)和GCC 盒元件(GCC-box)等[31]。AP2/ERF转录因子可以调节植物发育的各个过程,在激素调节和应激反应中发挥着重要的作用。在本研究中,SlJERF1 与SlPSY1基因启动子存在互作,对启动子序列进行顺式作用元件分析时,存在多个ARE、CAATbox、CAT-box、ERE、G-box、TATA-box、W-box、CArGbox 以及负责SlPSY1启动子活性的ATCTA 序列等元件。且在序列中未找到可以与AP2/ERF家族转录因子直接作用的DRE/CRT/GCC-box 元件。表明AP2/ERF家族转录因子可能通过结合SlPSY1启动子的ATCTA序列从而发挥作用,进而调控SlPSY1的表达,这为AP2/ERF家族转录因子的研究提供了新思路。
前人研究表明,JERF1的过表达可以激活胁迫相关和脱落酸(abscisic acid,ABA)合成相关的基因表达,进而增强烟草对高盐[32]和低温[33]的耐受性;在水稻中,过表达JERF1激活ABA 合成和其他胁迫响应基因的表达,增强转基因水稻的耐旱性[34]。在分子和生理水平上,JERF1可以上调信号和防御相关基因的表达,增加脂氧合酶(lipoxygenase,LOX)和苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)的活性,从而提高转基因水稻对纹枯病的抗性[35];在番茄中,盐、乙烯、茉莉酸甲酯(methyl jasmonate,MeJA)和ABA 处理均可诱导JERF1基因的表达,表明JERF1 在不同的信号转导途径起着核心作用[32]。在果实的成熟过程中,ERF家族成员发挥着不可忽视的作用。番茄基因组中有77 个ERF 转录因子,对野生型和成熟受损的番茄突变体(rin,nor,Nr)进行ERFs综合表达分析,发现27 个ERFs在成熟开始时表达增强,28 个ERFs在成熟过程中表达减少,表明不同的ERF在果实成熟过程中可能发挥着相反的作用[36],其中SlJERF1在成熟突变体中表现出显著的下调,说明SlJERF1 可能有助于番茄果实的成熟[36]。本研究证明SlJERF1与SlPSY1基因启动子存在相互作用,结合前人的研究,可以推测SlJERF1可能通过调控SlPSY1的表达,进而对番茄果实类胡萝卜素的合成和果实成熟发挥作用,这为进一步丰富类胡萝卜素合成和果实成熟调控网络提供了新的思路。
4 结论
本研究首先对SlPSY1及其同源基因SlPSY2、SlPSY3的表达量进行分析,表明SlPSY1在果实转色过程中表达量急剧升高,而SlPSY2、SlPSY3基本不表达。SlPSY1 是类胡萝卜素合成的关键酶,后续选择SlPSY1为目的基因,克隆其启动子序列,构建pSlPSY1pro-AbAi 酵母诱饵表达载体,利用以野生型番茄叶片及绿熟期和红熟期果实的鲜样构建的番茄混合组织酵母杂交cDNA 文库进行酵母单杂交验证,筛选得到AP2/ERF 家族转录因子SlJERF1,并通过酵母单杂点对点验证进行验证。结果表明,SlJERF1 可以与SlPSY1基因启动子相互作用,可能对SlPSY1基因的表达产生影响。
附录 SlPSY1启动子序列(5′→3′)
CGACGATAACAAGGATTAGGCAACAATTAGAGTT GTGAATTGTGAGTATTAACTATACTTTTACTATATTAG GCAGAATTTTTGCACTCAATGAGTAACTTGATTTATT TATTTTTTATTTCGCCCTAAATTATTGGACAAGTCATAT ATTTGTTTTGAAAACATTCTTTTATTGGCTAAATCGAA AATTGAATCGTTAAAGATCAAAAATCAATAACAAAT ATCTTATTGGTTTAACATATTTAAAAATAAAAAACCA ATAAATCTAACTAATAATATTTAATACGAAAACGAAA TGGACTGACACACATTCCTAAATTTTTGGTCAAAATT TTTTCATAATTTCCCTAAAATCTAAAATATTAAATAT TTGACGGAAACAAAAAATTCACTTTTAATAAATTATT TGAAGGACTAAAACAGTGGAAGAATATATTTAAGAA GCTAATTTGAACCTAGTGCCAAATATAAAGGGACCA TTTTTGTCATTTTTCAACTTGAAAATCTACGTGTCTTA ATATAACACCAAAGAATTAATATTTACTGAAAAAAT GTAAAAATGAGGATATGGATTCTGAATCACTCAATT CCAATCAGCAAAAATAAAATAAAATAAAATAAAATA AAATTTAAAAAATAATAATAAATGCTATAAAATGAC CAAAATGTGTGGAGCAAAAAGTGCAGAAAAAACCA ACAAATTGCATTCTCCATTCTTGGAAGTGGCCATTCT TGATTTCTTGAAACAAAGGTTTGTTTCCCTTCACTTCT TGATATGTAAAGTTGCAATCTTTATAACTTTCTATTG CTTTGCTAGTGTTTTTGTTATATACAGGGGGTGGAGT TAGAGGGTAAGTTACGCATTTAGTCGTAACTTTAGTC AAACTTCGTAATAATTTAGTAAGTTAAAATATATTAG AAATTTTCAGAATTCATAAACTTTAAATTTTAAATTTT GACTTCGCTTTGTGTGACTATACAATTACAGAAATTC AGAGTGGCCATTGTTGAAAGAG
