16SrRNA高通量测序研究持续性高危型HPV感染患者阴道菌群特征
2023-01-14林妙东马占忠何剑芬庄晓丹朱慧乐胡红波粤北人民医院广东韶关512026
林妙东 周 洁 马占忠 何剑芬 庄晓丹 朱慧乐 刘 贞 胡红波粤北人民医院,广东韶关 512026
宫颈癌(cervical cancer,CC)是女性第四大常见癌症,全世界每年新发病例超过500 000例,新增死亡病例约311 000例[1]。持续性的人乳头瘤病毒(human papillonavirvs,HPV)感染在CC和宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)的发病机制中起重要作用[2-3]。尽管持续性的宫颈HPV感染是宫颈癌前病变和CC发生的一个重要原因,但HPV的清除、持续感染与宫颈发生癌前病变并进展到癌变这一过程的驱动和协同致病因素还知之甚少。因此,研究协同或抑制从HPV感染向宫颈癌前病变和宫颈癌变发展的其他相关因素是至关重要的。越来越多的证据表明,阴道微生物群是这种转变的关键因素。本研究基于Illumina高通量测序平台和BIPES序列研究方法,检测分析持续性HR-HPV感染者阴道菌群的特征,为揭示HR-HPV持续感染及其引起宫颈病变的机制提供线索和理论依据。
1 资料与方法
1.1 一般资料
选取2020年6月至2021年7月在粤北人民医院(我院)妇科门诊就诊的女性,1年内曾接受两次HPV检查,且间隔时间超过6个月。将两次检测到相同亚型的HR-HPV纳入持续HPV阳性组,共36例。两次检测HR-HPV均阴性者纳入持续HPV阴性,共10例。纳入标准:21~75岁女性;取样前3 d内无性接触和阴道给药;1个月内未系统性使用抗生素或抗真菌药。排除标准:妊娠期和产褥期女性;免疫缺陷疾病的女性。本研究已通过粤北人民医院医学伦理委员会批准(KY-2020-011)。全部入组患者已经签署知情同意书。
1.2 分组
1.2.1 按HR-HPV型别分组 HR-HPV阴性组有10例,年龄43~46岁,中位年龄43岁;单一HRHPV阳性组有22例,年龄44~52岁,中位年龄48岁;多重HR-HPV阳性组有14例,年龄38~51岁,中位年龄46岁。三组间年龄比较,差异无统计学意义(P> 0.05)。
1.2.2 按宫颈病变程度分组 HR-HPV阳性组中共有23例接受宫颈活检,其中慢性炎症组7例,年龄30~45岁,中位年龄39岁;低级别鳞状上皮内病变(LSIL)组6例,年龄35~49岁,中位年龄42岁;高级别鳞状上皮内病变(HSIL)组10例,年龄31~59岁,中位年龄43岁。三组年龄比较,差异无统计学意义(P> 0.05)。
1.3 方法
1.3.1 阴道菌群检测 ①样本采集:受试者需要在月经干净后采样,并在取样前3 d禁止性生活及阴道局部用药,用两个无菌阴道棉签收集阴道穹窿或阴道中侧的分泌物,之后立即置于-80℃冰箱保存;②16SrRNA高通量测序:阴道菌群基因组提取、16SrRNA-V4区域基因片段的扩增、16SrRNA-V4区域基因高通量测序、生物信息学分析均外送至华大基因(武汉)完成。
1.3.2 HPV基因分型检测 采用PCR-反向点杂交技术对宫颈脱落细胞标本进行14种高危型HPV基因分型检测。
1.3.3 病理 对病变可疑的部位行宫颈活检术和/或宫颈管搔刮术。组织标本由两名以上的资深病理学专家分别进行病理诊断,诊断依据为2020年美国国立综合癌症网络(National comprehensive cancer network,NCCN)宫颈癌临床实践指南[4-5]。
1.4 统计学方法
采用SPSS 26.0统计学软件分析数据,计量资料不符合正态分布以中位数[M(P25,P75)]表示,采用非参数检验的秩和检验,两组间比较采用曼-惠特尼(Man-whttey)检验(Z值),多组间采用Kruskal Wallis(H值)秩和检验,P< 0.05为差异有统计学意义。
2 结果
2.1 不同HR-HPV感染型别亚组间阴道菌群分析
图1A,β多样性分析显示HR-HPV阴性组、单一HR-HPV阳性组、多重HR-HPV阳性组的阴道菌群结构比较,差异有统计学意义(H=12.872,P< 0.001);图1B显示在HR-HPV阳性亚组中,单一HR-HPV阳性组和多重HR-HPV阳性组的阴道菌群结构比较,差异有统计学意义(Z=3.214,P< 0.001)。图1C关键物种分析,在属水平上,Lactobacillus菌属、Prevotella菌属、Anaerococcus菌属和Dialister菌属的占比存在差异,Lactobacillus菌属在多重HR-HPV阳性组出现了明显的丰度下调,差异有统计学意义(Z=4.647,P< 0.05)。Dialister菌属在在多重HR-HPV阳性组出现了丰度上调,差异有统计学意义(Z=3.479,P< 0.05)。图1D显示单一HR-HPV阳性组和多重HR-HPV阳性组之间存在丰度差异的关键阴道菌属是Lactobacillus菌属、Prevotella菌属和Anaerococcus菌属。
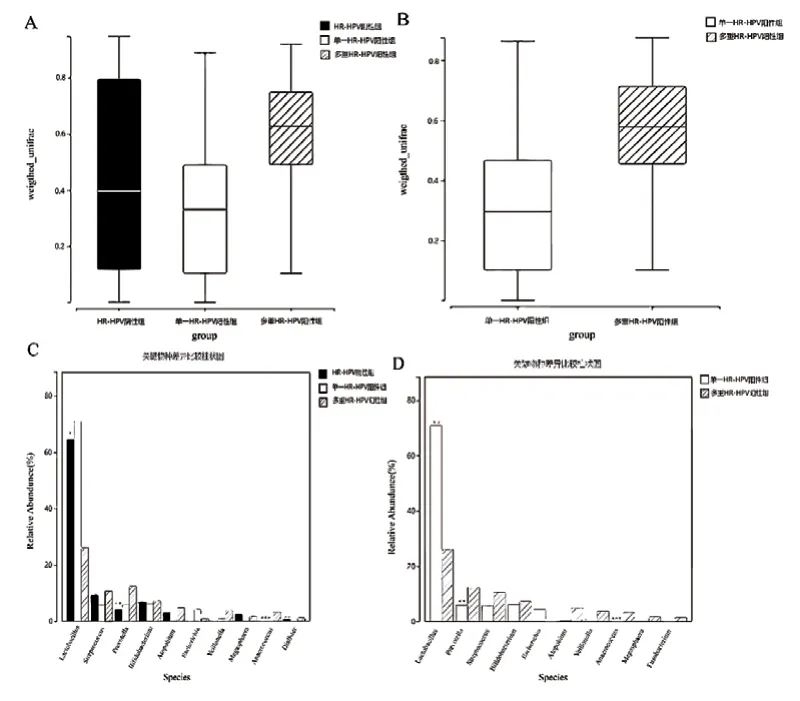
图1 不同HR-HPV感染型别亚组间阴道菌群分析结果
2.2 不同级别宫颈病变组间阴道菌群分析
2.2.1 不同级别宫颈病变组间阴道菌群的β多样性分析、PLS-DA分析 图2A中所示,慢性炎症组、LSIL组和HSIL组的阴道菌群结构比较,差异有统计学意义(H=11.653,P< 0.05)。图2B和2C显示,组间两两分析比对,慢性炎症组与LSIL组、LSIL组与HSIL组的阴道菌群结构比较,差异有统计学意义(Z=2.782,2.649,P< 0.05)。图2D是PLS-DA分析图,显示不同级别病变组阴道菌群的物种组成存在不同。
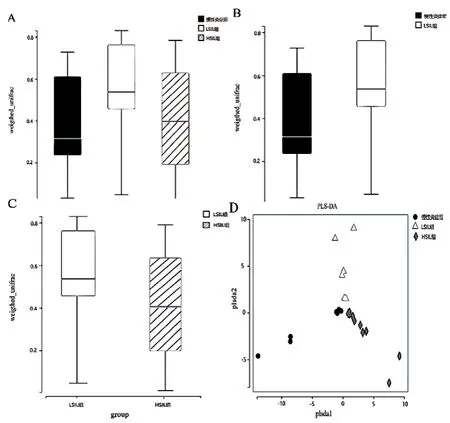
图2 不同级别宫颈病变组间阴道菌群的β多样性分析、PLS-DA分析
2.2.2 不同级别宫颈病变组间阴道菌群的微生物物种组成分析 分析不同级别宫颈组织病变组中阴道菌群占比前10的关键细菌属,图3A显示慢性炎症组和LSIL组间,Ureaplasma菌属占比,差异有统计学意义(Z=2.816,P< 0.05)。图3B显示慢性炎症组和HSIL组间,Enterococcus菌属占比差异有统计学意义(Z=3.673,P< 0.05)。
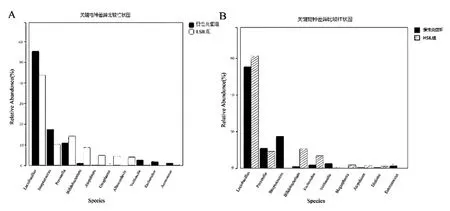
图3 不同级别宫颈病变组间阴道菌群的微生物物种组成分析
3 讨论
3.1 持续HR-HPV感染的阴道菌群特征
本研究发现,单一型别和多重HR-HPV阳性组之间,存在乳酸杆菌属(Lactobacillus)、普雷沃氏菌属(Prevotella)和Anaerococcus菌属的占比差异,说明这些菌属的丰度变化可能对HR-HPV的持续性感染或者清除产生了影响。HR-HPV阳性组中,普遍出现了Lactobacillus属丰度下调。正常情况下,处于优势地位的乳酸杆菌属能产生多种抑制物质,如乳酸和细菌素等以防止致病性感染,维持生殖器上皮表面的完整性,这一特征对于维持宫颈上皮屏障功能防止HPV进入基底层细胞很重要[6],它们还能调节宿主的免疫功能,影响疾病的易感性[7]。因此,乳酸杆菌属的减少引起的病原菌增殖、阴道微生物平衡破坏,增加了HR-HPV的易感性和持续感染状态,最后导致宫颈病变的发生。
普雷沃氏菌属(Prevotella)丰度在HR-HPV阳性的各亚组中均出现了不同程度的上调。普雷沃氏菌属被证实与细菌性阴道病显著相关,而细菌性阴道病已被证实与HR-HPV感染显著相关,有研究证实普雷沃氏菌属在CIN的发生发展中可作为生物标志物[8]。此外,普雷沃氏菌属会产生胶原酶和纤溶酶,它们可以降解黏膜表面,促进阴道上皮细胞的脱落,以及唾液酸酶和脯氨酸酶,导致阴道上皮损伤,从而引起HR-HPV整合至鳞状上皮细胞中,进而引起进一步病变[9]。
本研究发现,小杆菌属(Dialister)的丰度在多重HR-HPV阳性组中出现上调。与既往研究结果相符合,小杆菌属同样是HR-HPV感染人群中出现的关键阴道菌群。阴道菌群存在小杆菌属的女性,清除HPV更加困难,也更容易产生HPV的持续性感染[10]。但尚无研究探明小杆菌属如何在抑制HPV清除的过程中发挥作用,这个菌属同样需要更进一步的研究。
3.2 不同级别的宫颈病变组的阴道菌群特征
本研究结果显示HSIL组的阴道菌群物种多样性表现出更加明显的增加。既往有研究表明阴道菌群发生变化可能是HSIL发生发展的危险因素[11]。另一项支持这一结论的是HSIL女性手术切除前后的阴道菌群研究,该研究发现,HSIL患者乳杆菌属的多样性降低,同时伴有促炎细胞因子和抗菌肽浓度升高。锥切手术可以降低抗菌肽水平,但无法改变阴道微生物的组成或细胞因子水平。这意味着HSIL更倾向于发生在菌群多样性减少的阴道环境中,而这种环境并不能通过手术切除病灶和清除HPV来纠正[12]。未能重建富含乳酸杆菌的阴道环境可能是HSIL患者术后出现HPV持续感染和HSIL复发的原因。
本研究发现解脲支原体(Ureaplasma)在LSIL组中出现上调,提示LSIL的发生可能与解脲支原体相关,有研究表明,解脲支原体增加了HPV感染风险[13],可能作为辅助因素影响HPV促进癌前病变导致CC[14],同样的,一项针对182名宫颈鳞状上皮内病变女性的研究证实,宫颈鳞状上皮内病变患者有显著更高的解脲支原体感染率[15]。解脲支原体和宫颈病变致病机制的研究中发现,该菌属可能参与了几种复杂的感染相关的炎症反应,包括产生一系列的反应性氧化代谢产物,促进趋化因子、细胞因子表达增加,抑制细胞介导的免疫反应,促使自由基的产生等[16]。有研究证实从LSIL组到宫颈癌组,肠球菌属的丰度持续增加,宫颈癌组的丰度最高[17]。本研究HSIL组的肠球菌属(Enterococcus)较慢性炎症组出现了下调,与其结论不相符,需扩大样本进一步证实肠球菌属在宫颈疾病进程中的作用。
综上所述,HR-HPV的持续性感染与阴道菌群的失衡密切相关。而本研究中发现HR-HPV感染相关的菌群包括乳酸杆、普雷沃氏等,尚无法完全明确这些菌属在HPV持续感染抑或清除过程中发挥的具体作用,这也为下一步研究阴道菌群的变化与HPV持续感染并导致宫颈病变的机制提供了新方向。
