盐浓度对冷藏即食中华管鞭虾肌肉品质的影响
2023-01-13吴盈茹廖月琴水珊珊
吴盈茹,廖月琴,杜 琪,周 婷,水珊珊,2, ,张 宾,
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江省海洋开发研究院,浙江舟山 316021)
中华管鞭虾(Solenocera crassicornis)俗称红虾,是我国重要的经济海捕虾类之一,其肉质鲜美,深受消费者喜爱。中华管鞭虾肌肉中必需氨基酸含量高且种类齐全,是一种较为理想的蛋白质摄入源[1]。除此之外,中华管鞭虾中含有大量的不饱和脂肪酸,在预防心脑血管病、抗癌、促进人体发育等方面具有一定的功效[2]。近年来,随着人们生活节奏的加快,即食虾类食品因其方便携带、开袋即食的特点,越来越受到人们的青睐[3]。目前,市面上消费较多的即食虾类制品,多数为风干虾仁、烤虾或者其它方式加工的低水分虾仁制品,而高水分含量的即食虾仁制品在市面上还鲜有见到。
罐藏即食中华管鞭虾的加工主要包含清洗、水煮、制备虾仁、罐装、煮沸杀菌及密封等。其中,高温蒸煮会造成虾仁肌肉中蛋白质变性,致使虾仁肌肉中部分水溶性成分流失。同时可以使虾仁中微生物含量降至可接受水平,从而保障即食虾仁食用安全[4-5]。NaCl在即食虾类食品生产中是提供咸味的主要来源,同时其具有良好的提鲜作用[6]。有研究表明,在肉制品中添加一定量NaCl,可以有效改善肉制品的肌肉品质[7]。除此之外,由于NaCl具有抑菌作用,其在食品保鲜过程中也具有一定的效果[8]。关睿等[9]研究发现,在草鱼中添加NaCl可以抑制微生物的生长,同时降低鱼肌肉pH和TVB-N含量的快速增加,还可以减缓草鱼肌肉蛋白质的氧化作用,减少肌肉中丙二醛的生成。瞿丞等[10]分析了不同NaCl添加量腌制对于鸡肉质构特性的影响。结果表明,随着NaCl添加量的增加,造成肌肉收缩和水分流失,进而促使鸡肉的硬度、弹性显著上升。目前,关于NaCl浓度对即食虾类产品品质的影响,在贮藏期间是否会降低肌肉品质、延长贮藏货架期等方面还存在较多不明确的地方,关于盐水轻微加工高水分即食中华管鞭虾类产品的开发还未见报道。
本研究以蒸馏水处理为对照组,研究了NaCl浓度(2%,4%和6%)对冷藏即食中华管鞭虾理化特性、脂肪氧化及肌肉品质特性的影响,结果将为高水分即食中华管鞭虾虾仁的产品开发及品质保障提供理论依据。
1 材料与方法
1.1 材料与仪器
中华管鞭虾 购于舟山市国际水产城,平均体质量为(13±2)g。购买后将其放入带有冰袋的泡沫箱内,30 min内运送至实验室;冰醋酸、氧化镁、无水乙醇、硼酸、甲基红-溴甲酚绿指示剂等 分析纯,国药集团化学试剂有限公司;0.1 mol/L盐酸标准滴定液 广州和为医药科技有限公司;丙二醛测定试剂盒南京建成生物工程研究所。
751UVGD型紫外-可见光分光光度计 上海第三分析仪器厂;CR-10型便携式色差仪 日本柯尼卡美能达公司;MS-Pro型物性测试仪 美国FTC公司;全自动凯氏定氮仪 山东海能仪器科学仪器有限公司;CF-16RN高速冷冻离心机 日本日立公司。
1.2 实验方法
1.2.1 样品处理 选取个体大小相似的中华管鞭虾,蒸馏水清洗后,采用沸水蒸煮3 min;蒸馏水冷却至室温,去头去壳制备成虾仁;将虾仁分别置于装有0%、2%、4%和6% NaCl溶液的玻璃罐中,虾仁与溶液质量比为1:3[11],煮沸5 min,密封;待冷却至室温后,4 ℃保存。冷藏第0、10、20、30、40和50 d取样测定。
1.2.2 色差测定 色差采用手持式色差仪进行测定,测试点为中华管鞭虾第二节肌肉,记录虾仁L*、a*和b*值。
1.2.3 质构特性测定 质构测定参考刘欣荣等[12]方法,并略作修改。采用质地剖面分析模型(TPA),测定虾仁硬度、弹性。测试探头选用P/50,测试速度为60 mm/min,样品形变量为30%,测试点选取虾仁第二节肌肉。
1.2.4 水分含量和持水力测定 水分含量测定参考《食品安全国家标准—食品中水分的测定》(GB 5009.3-2016)[13];持水力测定:参照李志鹏等[14]方法,并稍作改进。选取3只虾仁的第二节肌肉,切碎混合后,准确称取2 g样品称重记作W1,使用定性滤纸包裹,1600×g离心10 min(4 ℃),样品再次称重记为W2。
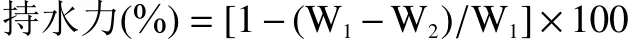
1.2.5 pH和 TVB-N含量测定 pH测定参考《食品安全国家标准—食品pH值的测定》(GB 5009.237-2016)[15];TVB-N含量测定参考《食品安全国家标准—食品中挥发性盐基氮的测定》(GB 5009.228-2016)[16]。
1.2.6 TBA值测定 采用丙二醛试剂盒测定虾仁肌肉TBA值,操作方法依据试剂盒使用说明书进行。
1.2.7 菌落总数测定 菌落总数测定参考《食品微生物学检验—菌落总数的测定》(GB 4789.2-2016)[17]。
1.2.8 苏木精-伊红染色观察分析 肌肉微观结构观察,参考祁雪儿等[18]方法。选取中华管鞭虾仁第二节肌肉,切成1 cm×1 cm×0.5 cm小块,使用4%多聚甲醛固定液浸泡固定,室温下过夜,苏木精-伊红常规染色后,显微镜下观察肌肉微观结构。
1.3 数据处理
上述指标测定进行三次平行实验。使用Excel进行数据统计,采用IBM SPSS软件进行数据分析(采用Ducan法分析差异显著性,P<0.05),Origin 2019进行图形的绘制。
2 结果与分析
2.1 NaCl浓度对中华管鞭虾肌肉色差的影响
在冷藏期间即食中华管鞭虾虾仁肌肉色差变化,会直接影响消费者的可接受性[19]。L*值反映虾仁肌肉明亮度,正数为肌肉偏白;a*值反映虾仁肌肉红绿值,正数为肌肉偏红;b*值反映虾仁肌肉黄蓝值,正数为肌肉偏黄[20]。如图1A所示,冷藏期间,各组虾仁肌肉L*值整体呈下降趋势,可能是因为虾肉在残留内源酶的作用下生成有色醌类物质,从而导致肌肉透明度降低所致[21]。随着NaCl浓度的升高,虾仁肌肉L*值增加,NaCl组虾仁肌肉L*值显著高于对照组(P<0.05)。可能是因为添加NaCl降低了虾仁肌肉中水分含量导致虾仁肌肉密度提升,从而使得虾仁肌肉L*值上升[5]。4% NaCl组和6% NaCl组虾仁肌肉L*值在冷藏期价无显著性差异。此外,在冷藏第30~40 d时,虾仁肌肉L*值出现一定的波动,可能与虾仁肌肉持水性、组织结构及肌肉色素变化等有关,从而影响虾仁肌肉表面的光反射所致[9],其发生原因有待进一步探索;如图1B所示,随着冷藏时间延长,各组虾仁肌肉a*值均呈下降趋势,这可能是因为虾仁中的虾青素在冷藏过程中逐渐氧化,导致虾仁肌肉红色逐渐减淡[22]。冷藏期间,各组虾仁肌肉a*值之间无显著性差异,表明虾仁肌肉a*值变化受NaCl浓度影响较小;图1C显示,各组虾仁肌肉b*值随冷藏时间延长呈逐渐上升趋势,可能是因为虾仁肌肉中部分蛋白质及脂质发生氧化,品质逐渐劣化,致使虾体逐渐发黄[23-24]。其中,相同冷藏时间下,随着NaCl的升高,虾仁肌肉b*值显著降低(P<0.05),可能是因为NaCl的添加抑制了肌肉中脂质氧化的发生,从而有效抑制了虾仁肌肉冷藏期间b*值的上升。Yarnpakdee等[25]在研究中也发现,肌肉b*值变化被认为与脂肪氧化产物的产生存在密切的相关性。
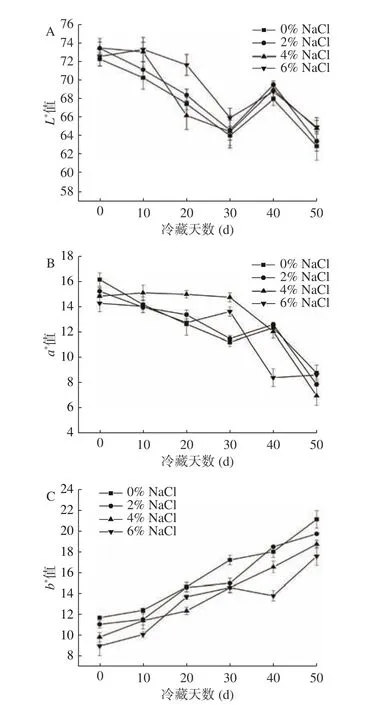
图1 NaCl浓度对冷藏中华管鞭虾肌肉L*值(A)、a*值(B)和b*值(C)的影响Fig.1 Effects of NaCl concentration on the L* (A), a* (B), and b* value (C) of Solenocera crassicornis muscle during chilled storage
2.2 NaCl浓度对中华管鞭虾肌肉质构特性的影响
硬度、弹性是影响即食中华管鞭虾虾仁质构特性的重要因素[26]。基于消费者的感官需求,即食虾仁肌肉硬度、弹性较高,其感官评分也较高[10]。由表1结果可以看出,冷藏期间各组虾仁肌肉的硬度、弹性随着冷藏时间的延长,呈先上升后下降的趋势。高浓度NaCl(4%、6% NaCl)组虾仁肌肉的硬度、弹性均显著高于对照组(P<0.05),表明添加NaCl能够提高虾仁肌肉的硬度和弹性。可能是因为NaCl可降低虾仁肌肉中自由水含量,引起虾仁肌肉的收缩,同时Na+离子诱导了肌球蛋白分子交联,从而提升了虾仁肌肉的硬度、弹性[5,27]。研究中,对照组虾仁肌肉质构特性同样呈现上升趋势,Chen等[28]在针对班节对虾肌肉质构研究中对照组同样出现相似变化趋势,其原因有待进一步探索。随着冷藏时间延长,虾仁在微生物作用下肌肉品质出现劣化,导致肌肉硬度、弹性逐渐降低,该结果与陶文斌[29]针对大黄鱼肌肉质构研究结论相似。在冷藏过程中,4%和6% NaCl组虾仁肌肉弹性、黏粘性和咀嚼性均显著高于对照组(P<0.05),该结果表明NaCl的添加在一定程度上有利于虾仁肌肉质构特性的保持。
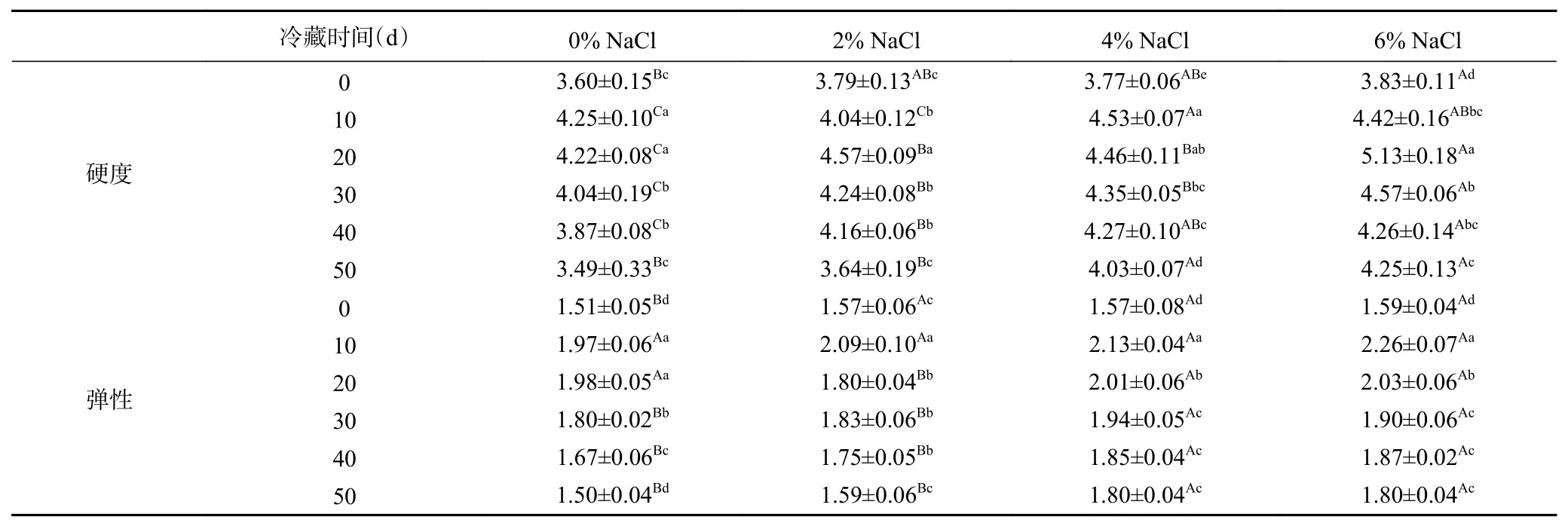
表1 NaCl浓度对冷藏中华管鞭虾肌肉质构特性的影响Table 1 Effects of NaCl concentrations on the texture characteristics of Solenocera crassicornis muscle during chilled storage
2.3 NaCl浓度对中华管鞭虾肌肉水分含量和持水力的影响
冷藏期间即食中华管鞭虾仁肌肉中水分含量变化,如图2A所示。各组虾仁肌肉中水分含量呈先上升后下降的趋势。可能是因为受加热蒸煮的影响,虾仁肌肉细胞流失部分水分。冷藏期间,浸渍液中水分在渗透压影响下又进入到虾仁肌肉细胞中,致使虾仁肌肉中水分含量有所增加。随着冷藏时间的延长,虾仁肌肉中NaCl含量增加、虾仁品质劣化,虾仁肌肉细胞中的水分被逐渐析出[10,30]。冷藏期间,随着NaCl浓度增加,虾仁肌肉中水分含量显著降低(P<0.05)。可能是因为NaCl浓度的升高引起了虾仁肌肉纤维组织的收缩以及肌原纤维结构的疏水区域的暴露。致使虾仁肌肉细胞中的部分水分被挤压出去,导致水分含量降低[5,31]。

图2 NaCl浓度对冷藏中华管鞭虾肌肉水分含量(A)和持水力(B)的影响Fig.2 Effects of NaCl concentrations on the moisture content(A) and water holding capacity (B) of Solenocera crassicornis muscle during chilled storage
持水力指虾仁肌肉冷藏过程中保持水分的能力,能够较好的反映虾仁的食用品质[32]。如图2B所示,冷藏期间,对照组虾仁肌肉持水力无明显变化,NaCl组虾仁肌肉持水力呈上升趋势,且显著高于对照组虾仁(P<0.05)。冷藏第50 d时,2%、4%和6%NaCl浸泡虾仁肌肉持水力分别上升了4.83%、7.23%和6.80%。结果表明,在冷藏期间,即食中华管鞭虾仁肌肉中NaCl含量的增加,可以提高虾仁肌肉中蛋白质的持水能力。可能是因为NaCl是一种亲水性离子物质,可使中华管鞭虾虾仁肌肉中部分自由水转化成结合水,同时不断促进盐溶性蛋白的溶出,从而导致持水力增加[33]。
2.4 NaCl浓度对中华管鞭虾肌肉pH和TVB-N含量的影响
图3A为NaCl浓度对即食中华管鞭虾虾仁肌肉pH的影响结果。在冷藏期间,各组虾仁肌肉pH随时间延长呈先下降后上升的趋势。可能是因为冷藏前期,虾仁肌肉中的糖原被分解成酸性物质,导致虾仁pH下降[11]。随着冷藏时间延长,中华管鞭虾虾仁肌肉中部分蛋白质在微生物和内源酶作用下被分解产生胺类等碱性物质[34],因此冷藏第15d,各处理组虾仁肌肉pH逐渐上升。在冷藏过程中,对照组中华管鞭虾虾仁肌肉pH>2% NaCl组>4%和6%NaCl组,而4%和6% NaCl两组肌肉pH并无显著性差异。可能是因为NaCl可通过抑制微生物的生长,影响到肌肉中碱性物质的生成。NaCl浓度升高,可以提高对微生物的抑制效果,影响虾仁肌肉中碱性物质生成量。该结果与关睿等[9]对冷藏草鱼肌肉pH的研究结果相一致。
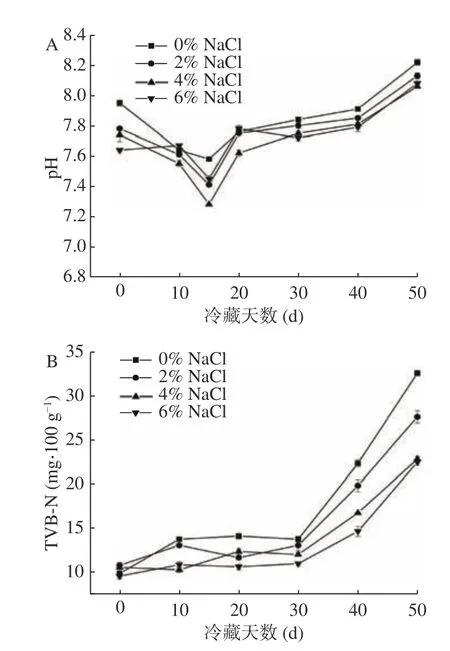
图3 NaCl浓度对冷藏中华管鞭虾肌肉pH(A)和TVB-N含量(B)的影响Fig.3 Effects of NaCl concentrations on the pH (A) and TVBN content (B) of Solenocera crassicornis muscle during chilled storage
TVB-N反映肌肉中蛋白质在冷藏期间被分解成氨和胺类物质的量,可用来反映即食中华管鞭虾虾仁的腐败情况[35]。根据国标要求,海水虾类肌肉TVBN含量不得超过30 mg/100 g[36]。由图3B可知,在贮藏期间不同NaCl浓度浸渍的虾仁肌肉TVB-N含量均呈上升趋势,冷藏30 d以后各组肌肉中TVBN含量上升较快,可能是由于贮藏后期微生物生长繁殖速度较快所致[37]。冷藏第50 d时,对照组虾仁肌肉中TVB-N含量超出国家标准,达到32.62 mg/100 g,NaCl组虾仁肌肉中TVB-N含量显著低于对照组(P<0.05)。2% NaCl浸泡虾仁肌肉中TVB-N含量为27.62 mg/100 g,已经接近国标限量标准。4%和6% NaCl浸泡虾仁肌肉中TVB-N含量分别为22.82和22.47 mg/100 g,新鲜度相对较好。以上结果表明,添加一定浓度的NaCl可以有效抑制冷藏期间即食中华管鞭虾肌肉中TVB-N含量的生成。
2.5 NaCl浓度对中华管鞭虾肌肉TBA值的影响
中华管鞭虾中含有的不饱和脂肪酸,在冷藏过程中易发生氧化,从而导致肌肉中丙二醛含量升高,因此TBA值可用来反映即食中华管鞭虾虾仁冷藏期间脂质氧化情况[38]。如图4所示,随着贮藏时间的延长,不同NaCl组虾仁肌肉中TBA值均呈上升趋势。冷藏前期,各NaCl组虾仁TBA值无显著性差异。冷藏第20 d时,对照组虾仁肌肉中TBA值显著高于NaCl组(P<0.05),表明NaCl添加量对即食中华管鞭虾虾仁丙二醛生成有较大影响。冷藏第30 d时,各组虾仁肌肉中TBA值均呈现出较快的上升趋势,可能是因为冷藏后期虾仁肌肉品质劣化加剧导致[37];冷藏至50 d时,4%和6% NaCl组虾仁肌肉中TBA值均显著低于对照组(P<0.05),表明4%和6% NaCl可以抑制脂肪的氧化,延缓TBA值的上升趋势。分析其原因可能是因为NaCl浓度的增加可以引起虾仁细胞质的浓缩,降低脂肪酶和脂肪氧化酶活性,从而抑制丙二醛的生成[39]。
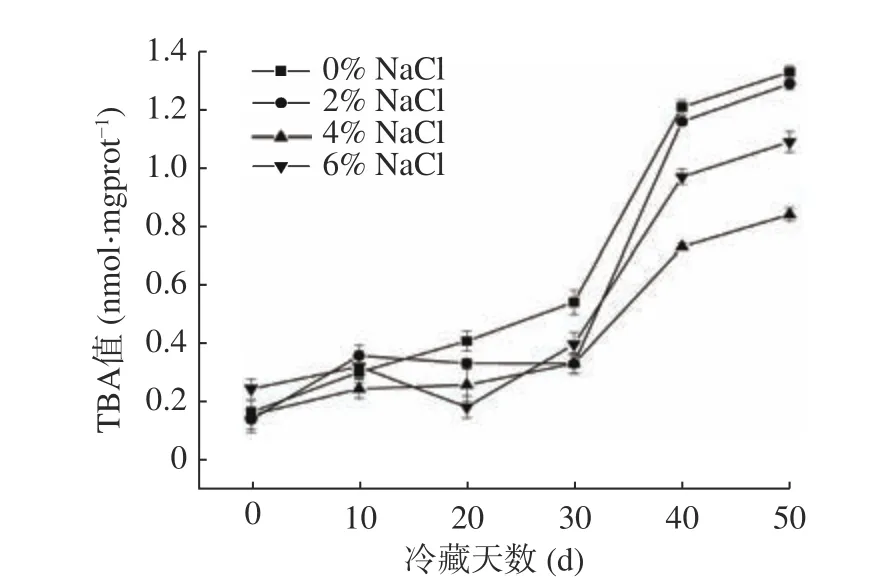
图4 NaCl浓度对冷藏中华管鞭虾肌肉TBA值的影响Fig.4 Effects of NaCl concentrations on the TBA values of Solenocera crassicornis muscle during chilled storage
2.6 NaCl浓度对中华管鞭虾菌落总数影响
冷藏期间,在微生物生长与繁殖作用下,即食中华管鞭虾肌肉会不断劣化[40]。从图5中可以看出,随着冷藏时间的延长,各组虾仁菌落总数持续上升。各测定点NaCl浓度越高,菌落总数越低,且NaCl组菌落总数显著低于对照组(P<0.05)。在冷藏第50 d时,0%、2%、4%和6% NaCl组浸泡虾仁肌肉中菌落总数分别为6.19、5.3、5.1和5.0 lg(CFU·g-1)。根据GB 10136-2015《食品安全国家标准—动物性水产品制品》限定,动物性水产品中菌落总数不得超过6 lg(CFU·g-1)[41]。冷藏第50 d时,对照组虾仁菌落总数含量已超出国标规定的最大限值,NaCl组均未超出最大限值。结果表明NaCl浸泡可抑制即食虾仁中微生物的增长速度,且NaCl浓度越高对于虾仁中微生物的抑制效果越好。
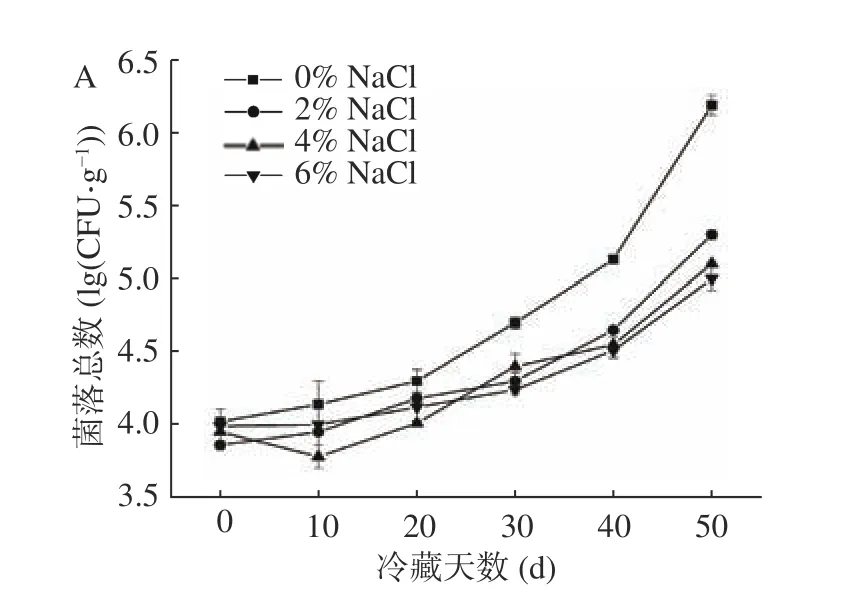
图5 NaCl浓度对冷藏中华管鞭虾肌肉菌落总数的影响Fig.5 Effects of NaCl concentrations on the total viable count of Solenocera crassicornis muscle during chilled storage
2.7 NaCl浓度对中华管鞭虾肌肉结构的影响
本研究中,冷藏第50 d时,对照组虾仁样品已经腐败,不具有食用价值和经济价值,故选取冷藏第40 d时各组虾仁肌肉进行微观结构的观察。前期研究表明,新鲜虾仁蒸煮后肌肉组织结构较完整,肌纤维排列较紧密,几乎没有白色间隙[42]。40 d时虾仁肌肉微观结构如图6所示,对照组虾仁肌肉组织明显比较松散,其肌原纤维之间的缝隙较大,部分组织出现破裂。相较于对照组,2% NaCl浸泡虾仁肌肉肌纤维间隙较小,肌肉组织完整性保持较好,4%NaCl浸泡虾仁肌肉结缔组织排列相对较为整齐、紧致,肌原纤维之间的间隙较小。在冷藏过程中,即食中华管鞭虾虾仁肌肉品质逐渐劣化,可能是因为虾仁肌肉中蛋白质降解[43]、脂质氧化以及微生物生长繁殖所致,导致虾仁肌肉结构遭到严重破坏[44]。Fulladosa等[45]研究发现,肉制品肌肉中含有一定量的NaCl,能够较好的保持肌肉结构的稳定性,在贮藏过程中NaCl含量较低,肉制品纹理结构容易发生劣化,NaCl含量增加到一定程度,肉制品的质地相对会增强。6% NaCl组虾仁肌肉纤维空隙相较于4%NaCl组增大,可能是因为NaCl浓度过高,会加速蛋白质氧化,促进蛋白质降解,导致肌肉组织完整性被破坏[46]。
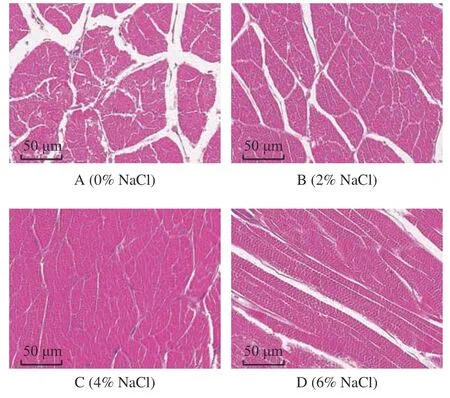
图6 NaCl浓度浸泡的中华管鞭虾虾仁肌肉(冷藏40 d时)HE染色图Fig.6 HE staining image of Solenocera crassicornis muscle soaked in NaCl concentrations after 40 days of chilled storage
3 结论
通过NaCl浸泡处理对冷藏即食中华管鞭虾虾仁肌肉品质的影响研究发现,NaCl添加量对即食中华管鞭虾虾仁肌肉品质具有显著作用。在冷藏期间,各组虾仁肌肉中的水分含量呈先上升后下降趋势,pH呈先下降后上升趋势,且NaCl处理组虾仁肌肉中水分含量和pH显著低于对照组(P<0.05)。高浓度NaCl较好的抑制了虾仁肌肉中TVB-N含量、TBA值及菌落总数的增加。在冷藏期间,4%和6% NaCl处理对于虾仁肌肉色泽、硬度、弹性及持水力的保持效果优于对照组。通过显微镜观察可以发现,冷藏40 d时与其他组相比,4% NaCl浸泡处理的虾仁肌肉结构完整性较好,肌纤维排列较为紧密。综合考虑,选用4% NaCl用于浸泡处理即食中华管鞭虾虾仁最为适合。本研究为高水分即食虾类食品的开发及探究NaCl浓度对于即食中华管鞭虾虾仁肌肉品质影响的相关研究提供了一定的理论依据。
