福建省辣椒连作土壤改良后微生物群落结构特征分析
2023-01-13马慧斐朱海生李永平蔡章棣薛珠政温庆放
马慧斐,朱海生,李永平,黄 昊,蔡章棣,薛珠政*,温庆放*
(1.福建省蔬菜遗传育种重点实验室/福建省农业科学院作物研究所/福建省蔬菜工程技术研究中心, 福建 福州 350013; 2.晋江市农业农村局, 福建 晋江 362200)
辣椒CapsicumannuumL.原产墨西哥,在我国有悠久的栽培种植历史,是重要的蔬菜和调味品。2020年我国辣椒种植面积220万hm2,成为我国第一大单品蔬菜,贵州、河南、山东、河北、内蒙古等主产区种植面积仍保持增长,辣椒需求量还在不断上升[1-2]。辣椒也是福建省重要的种植蔬菜,从沿海地区到内陆山区都有种植。福建省沿海地区多砂质土壤,且台风降雨比较多,因此大部分蔬菜种植户选择设施栽培[3-4]。设施辣椒连作障碍十分普遍,主要表现为病害加重,产量降低,品质下降[5]。研究显示辣椒连作土壤速效养分富集,出现酸化和盐渍化现象,且随连作年限增加程度加大,表现为土壤抗氧化酶活性增强,植株生长异常,并且随连作年限增加影响程度进一步加大[6]。另有研究表明连作使土壤微生物数量高于单作,土壤生态系统稳定性降低[7]。而且,连作土壤根际微生物区系发生变化,从“细菌型”高肥力土壤转变为“真菌型”低肥力土壤,使有害微生物成为优势种群,从而导致连作障碍[8-10]。
针对连作障碍,我国在20世纪90年代开始采取秸秆还田方式来增加土壤有机质含量,改善土壤理化性质,增强土壤通透性,增加有益生物活性[11]。同时,也可通过添加有机菌肥来改善土壤耕作条件。Mendes等[12]研究表明假单胞菌在土壤中对抑制甜菜植株立枯丝核菌起重要作用,但假单胞菌在单独测试时缺乏对病原体的抑制活性,当与其它微生物构成部分微生物群落时可以协同产生抑制作用,证明作物可以依靠微生物群落的特定成分来保护自身免受病原体感染。王辉等[13]研究表明黄柄曲霉ASD可以增加辣椒疫病根际土壤真菌多样性,改变土壤营养状况与优势真菌种群结构,从而降低辣椒疫病的发病率。
辣椒是福建省重要的设施蔬菜,随着种植年限的增加连作障碍问题日渐凸显,成为辣椒种植的主要障碍,探究辣椒不同生长状态下根际微生物多样性差异,对改善辣椒种植环境、减缓辣椒连作障碍、实现辣椒科学种植和合理施肥具有重要的指导意义。本研究对发生辣椒连作障碍的种植地施用牡蛎钙土壤调理剂(900 kg·hm-2)进行改良,分析改良前后土壤细菌、真菌的丰富度和多样性变化及其原因,为减缓福建省辣椒连作障碍提供技术参考。
1 材料与方法
1.1 试验地概况
试验地位于福建省福清市东张镇,南近北回归线,属南亚热带气候带,季风气候显著,年平均气温17~20℃,几乎无霜日,年降水量1 000~2 000 mm,80%以上降水量集中在4月至10月。年平均气温17~20℃,年均日照时数约1 778 h,土质为红壤土。
1.2 试验设计
2021年初,将发生连作障碍的辣椒田块翻耕,均分为两块田,其中一半田块施用牡蛎钙土壤调理颗粒剂(900 kg·hm-2)进行改良(记为GL),另一半连作障碍田块不添加土壤改良剂(记为LZ),以未发生连作障碍且不添加土壤改良剂的健康田块作为对照(记为JK)。3月初在这3个田块同时定植辣椒。试验设置GL、LZ、JK 3个处理,每个处理3次重复,小区面积为256 m2(8 m×32 m),每个小区种植辣椒844株。各处理管理方式一致。
1.3 测试项目与方法
7月份分别采集JK、LZ和GL3种土壤的样品检测微生物多样性。采用5点采样法采集10~15 cm辣椒根部土壤,去除大颗粒杂质,混匀,取大约5 g土样立即装入灭菌的10 mL离心管中,放入干冰中速冻,用于提取DNA,每种土壤取3次重复。
1.3.1土壤微生物总DNA提取 使用天根生化科技(北京)有限公司的TGuide S96基因组DNA提取试剂盒提取样品DNA。用酶标仪对提取的核酸进行浓度检测,扩增后的PCR产物使用浓度1.8%的琼脂糖进行电泳检测。
1.3.2微生物多样性测序 微生物多样性是基于IlluminaNovaseq测序平台,利用双末端测序(Paired-End)方法,构建小片段文库进行测序。测序结束后使用Trimmomatic[14](version 0.33)对原始数据进行质量过滤,然后使用Cutadapt[15](version 1.9.1)进行引物序列的识别与去除,其后使用 USEARCH[16](version 10)对双端reads 进行拼接并去除嵌合体(UCHIME[17],version 8.1),最终得到高质量的序列用于后续分析。
1.4 数据处理
借助百迈客公司云平台系统进行细菌和真菌OTU数量、α多样性、群落结构、系统进化等分析。
2 结果与分析
2.1 土壤样品测序深度评价
取辣椒种植健康土壤(JK)、改良土壤(GL)和发生连作障碍(LZ)的土壤各3份进行细菌和真菌多样性检测,9个样品分别获得731 376和718 413对 Raw Reads,经Reads 双端质控、拼接后共产生729 378 和715 844条Clean Reads,细菌检测每个样品至少产生 79 471条Clean Reads,平均81 042条;真菌检测每个样品至少产生79 270条Clean Reads,平均79 538条,有效Reads占比均在95.29%以上。对测序得到的序列进行随机抽样,将抽到的序列数和代表的物种数来构建稀释性曲线,每个样本的稀释性曲线均趋向平缓,说明供试样品取样合理,检测结果与实际土壤中的细菌、真菌群落结构相符合,能真实反映土壤样本的细菌、真菌群落,继续增加测序数量对新发掘OTU影响不大。

注:横坐标为随机抽取的测序条数,纵坐标为基于该测序条数得到的Feature数量,每条曲线代表一个样品,用不同颜色标记图1 测序样品中细菌和真菌的稀释曲线Fig.1 Dilution curve of the bacteria and fungi in the sequencing samples
2.2 3种土壤中细菌和真菌OTU数量的差别
由图2可知,3种土壤经过聚类分析发现共包含1 490个细菌和1 468个真菌OTU。其中,JK中细菌和真菌OTU数量分别为1 325和968个,GL中分别为1 058和1 062个,LZ中分别为772和1 099个。总体趋势为JK的细菌OTU数量最多而真菌的最少,LZ中细菌OTU最少而真菌的最多,与其他研究连作障碍土壤由细菌型转向真菌型的规律一致。对发生连作障碍的土壤中添加土壤调理剂后,细菌OTU数量有所增加,而真菌OTU数量有所下降,表明土壤调节剂能有效提高细菌丰富度降低带来的菌群失调,但是还不足以使连作土壤恢复到健康土壤的微生物群落水平,土壤调理剂使用时间、计量及施用土层深度还需要进一步试验明确。3种土壤共享594个细菌OTU和595个真菌OTU。GL和JK共有细菌OTU数量较多,和LZ共有真菌OTU数量较多。LZ特有的细菌OTU数量最少,真菌OTU数量最多。
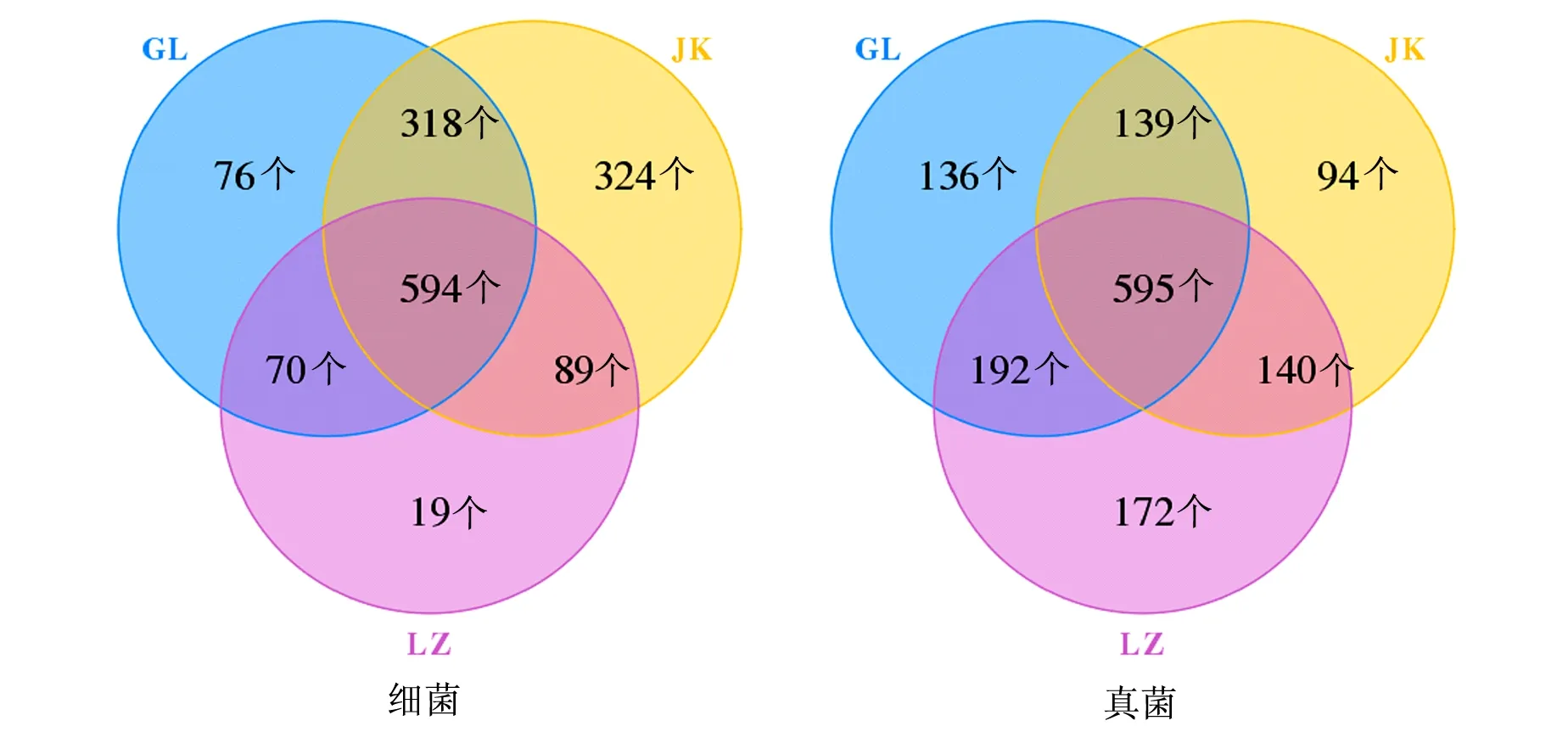
图2 辣椒不同种植年限土壤细菌和真菌在OTU水平Venn图Fig.2 Venn diagram of the bacteria and fungi at OTU levels in the soils with different planting years of pepper
2.3 3种土壤细菌和真菌的多样性指数分析
从表1可知,α多样性指数Ace和Chao1表现为细菌JK>GL>LZ,真菌为LZ>GL>JK,说明3种土壤中细菌丰富度依次是JK>GL>LZ,而真菌丰富度依次是LZ>GL>JK;且JK和LZ之间两种指数均达到了显著差异(P<0.05,下同),表明JK土壤的细菌丰富度显著高于LZ土壤,而真菌丰富度显著低于LZ土壤;3种土壤的Shannon 指数和Simpson 指数显示细菌种类多样性趋势和丰富度一致,真菌也具有相同的趋势。显著性分析结果表明3种土壤的细菌多样性不存在显著差异(P>0.05,下同),而JK土壤真菌丰富度显著低于LZ和GL土壤。说明在采集的3种试验土壤样品中JK土壤细菌丰富度和多样性最高,而LZ真菌丰富度和多样都最高,GL细菌丰富度和多样性均高于LZ,但真菌丰富度和多样性要比LZ低,从土壤微生物多样性和丰富度水平说明土壤改良剂在防治连作障碍中具有积极作用。
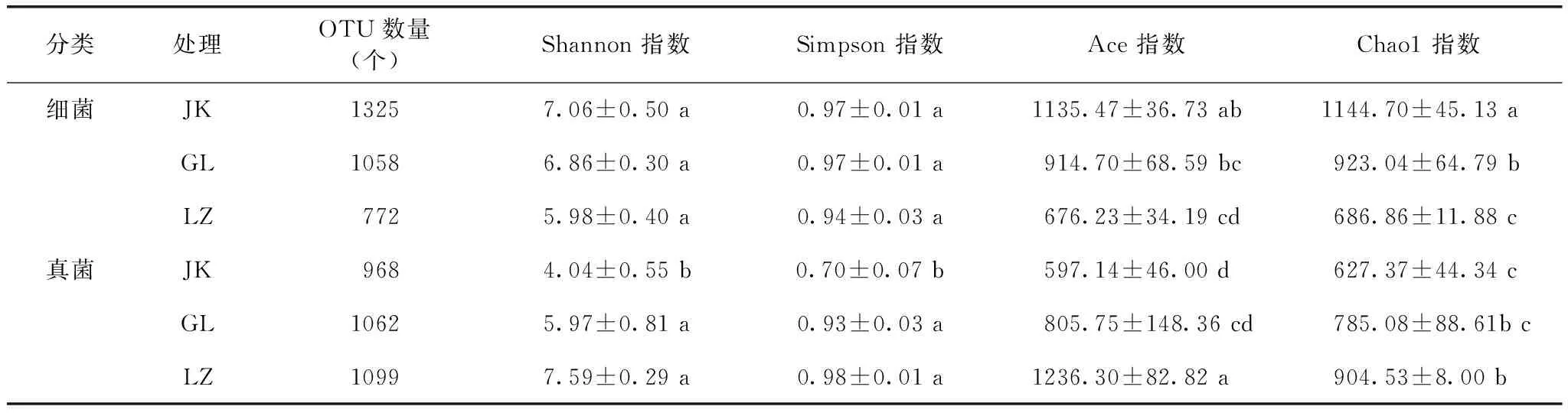
表1 辣椒种植土壤细菌、真菌α多样性指数Table 1 Alpha diversity index of bacteria and fungi in the planting soil of pepper
2.4 3种土壤细菌和真菌群落结构的差异
将聚类产生的OTU进行等级分类,由图3可知,随着分类等级递增,细菌物种数量也递增,但是没有在任何一个等级中出现物种数量陡增的样品。JK土壤细菌种类在同一级别中增加的最多(表2),其次是GL,最后是LZ;真菌的物种数量也是随着分类等级的递增而增加,也没有在任何一个等级中出现物种数量陡增的样品。LZ的真菌种类更加丰富,而GL和JK之间的等级分类物种数量则更为接近。细菌中JK各分类水平的数量最多,真菌中LZ各分类水平的数量最多,GL则介于二者之间。
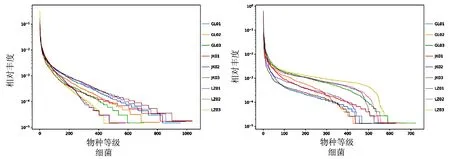
注:横坐标为按Features丰度排序的序号,纵坐标为对应的Features的相对丰度图3 3种土壤细菌和真菌物种等级丰度曲线Fig.3 Grade abundance curves of the bacterial and fungal species in the three kinds of soil
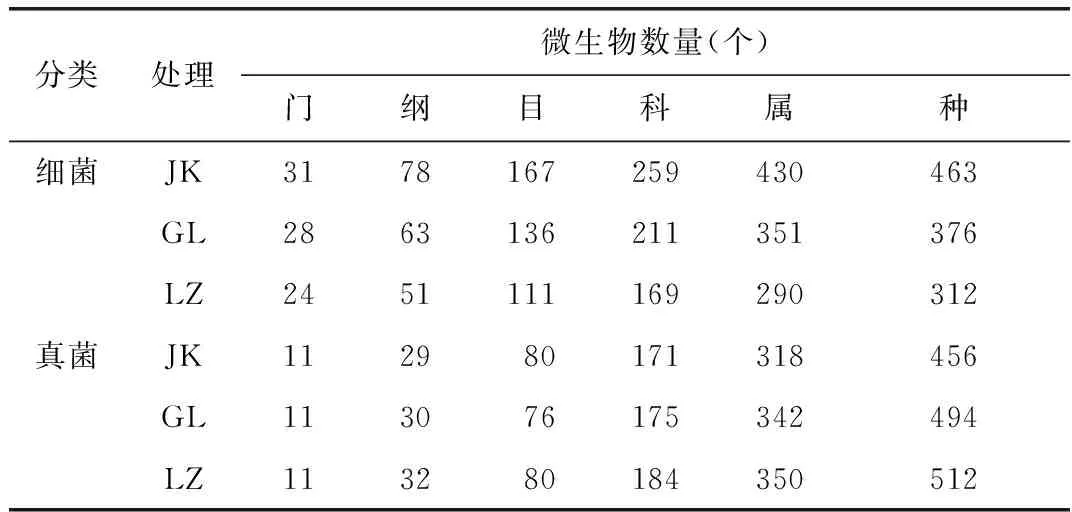
表2 不同分类水平微生物数量Table 2 Number of the microorganisms at different classification levels
2.5 UPGMA聚类树
基于UnweightedUnifrac距离矩阵,取每个样品丰富度前10的OTU做3种土壤细菌OTU水平上聚类分析,由图4可知每组的3个样品都能独立组成一个小的聚类单位,而且遗传分支清晰,组内遗传距离小于组间。GL的细菌OTU在系统发育上与JK更接近,与LZ在系统发育上距离更远些。表明3种土壤的细菌在群落组成上有各自独特的结构,而这种群落结构也赋予土壤不同的特性,与植物根部互作后最终体现出植物生长状态的差异。
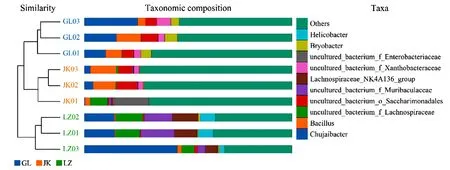
图4 不同土壤细菌群落在OTU水平的层级聚类分析Fig.4 Hierarchical clustering analysis of the bacterial communities at OTU level in different planting soils
2.6 优势细菌和真菌的类群
对3种土壤门水平的优势细菌和真菌分析发现,在分类级别门水平JK的优势菌依次为变形杆菌Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidetes、绿弯菌门Chloroflexi和巴氏杆菌Patescibacteria,GL的优势菌为变形杆菌Proteobacteria、酸杆菌Acidobacteria、厚壁菌门Firmicutes、巴氏杆菌Patescibacteria和放线菌Actinobacteria,LZ的优势菌为厚壁菌门Firmicutes、变形杆菌Proteobacteria、拟杆菌门Bacteroidetes、ε杆菌门Epsilonbacteraeota和放线菌Actinobacteria,3种土壤中优势细菌的差异较大;真菌中子囊菌门Ascomycota在3种土壤中均为第一优势菌,其次是担子菌门Basidiomycota,其他优势真菌的顺序基本一致。

图5 3种土壤物种分布图Fig.5 Species distribution in the three kinds of soil
3 结论与讨论
本研究对福建省种植辣椒的健康土壤(JK)、连作障碍土壤(LZ)和改良后土壤(GL)中微生物多样性进行了检测。结果表明有效的土壤调理剂能够调节、改变土壤微生物群落结构,有效提高连作土壤细菌的丰度和多样性,降低真菌的丰度和多样性,将连作真菌型土壤向细菌型土壤转变,从而减缓连作障碍。
土壤是丰富的资源库,为植物不同生长时期提供必需的大量营养元素和微量元素,也是植物吸收营养,地下部形态建成,与微生物进行信号传导和物质交换的主要场所。但是,作物连续耕种会导致土壤中的营养失衡、养分偏耗、pH改变,进而土壤微生物区系发生改变,加上植物有害根系分泌物积累,最终出现连作障碍,严重影响作物产量和农业可持续发展。
连作障碍产生的原因之一是土壤从细菌型转变成真菌型,而许多土传病害真菌含量也随之升高。本研究对福建省种植辣椒的健康土壤和连作土壤进行微生物多样性测序分析,得到了相似结果,说明连作障碍的发生和土壤菌群失调紧密相关。对发生连作障碍的土壤添加土壤调理剂进行改良,改良后的小油菜植株比原来健壮,发病率大幅下降[18]。本研究表明,改良土壤中真菌丰富度和多样性较连作土壤明显降低,而细菌种群明显上升,且系统进化结果显示改良后土壤中细菌种群与健康土壤的细菌种群遗传关系更近。因此,可以通过监测土壤微生物多样性的变化为土壤改良提供参考。
相关研究表明,连作土壤pH值低于同地区正常土壤[19-20]。土壤调理剂能够提高土壤pH值,改善土壤环境[18]。本研究在连作土壤中添加牡蛎钙土壤调理剂,有效缓解了连作障碍造成的辣椒长势衰弱和病害加重。改良后细菌的丰度和多样性都有明显提升,向健康土壤靠拢,但真菌更接近连作障碍土壤。因此,土壤调理剂的选择及施用方式还需进一步调整、改进。
