后肾腺瘤的CT 和MRI 表现
2023-01-13刘凯丽罗超然陈倩肖慧
刘凯丽,罗超然,陈倩,肖慧*
1.福建省妇幼保健院影像科,福建 福州 350001;2.福建省妇产医院影像科,福建 福州 350012;3.中国人民解放军联勤保障部队第九〇〇医院放射诊断科,福建 福州 350025;4.福建中医药大学福总教学医院(第九〇〇医院),福建 福州 350025;*通信作者 肖慧 xiaohui855@163.com
后肾腺瘤(metanephric adenoma,MA)是一种罕见的起源于肾上皮的肾脏良性肿瘤[1],约占成人肾上皮肿瘤的0.2%[2],大部分发生于成人,多见于中年女性[3]。MA术前影像诊断困难,常误诊为肾脏恶性肿瘤而导致过度治疗[4-5]。目前研究多探讨MA的影像特征或病理特征,较少探讨两者的相关性。本研究拟分析经手术和免疫组化病理证实的MA的CT、MRI特点及临床特征,并与病理学表现关联,提高对本病的认识。
1 资料与方法
1.1 一般资料 回顾性分析2011年1月—2017年6月在联勤保障部队第九〇〇医院住院治疗的6例经手术病理证实为MA患者的临床表现、影像及病理资料。纳入标准:①在第九〇〇医院行肾脏肿瘤切除术,并且术后标本病理为MA;②无其他肿瘤病史;③术前两周内行CT/MRI检查;④具有完整的临床资料。排除标准:①无完整的CT和(或)MRI检查资料,或图像质量不佳无法满足分析及测量要求;②无免疫组化病理结果。6例患者中,男2例,女4例,年龄13~63岁,平均(45.2±16.1)岁,其中18岁以下1例。3例临床症状包括腰腹部闷痛、不适,其余3例为体检发现肾占位。所有患者均无尿频、尿急、尿痛及肉眼血尿等表现,无真性红细胞增多症及血栓形成,实验室检查未见明显异常。本研究经本院伦理委员会批准,免除患者签署知情同意书。
1.2 影像学检查 6例患者均行CT平扫和增强扫描,其中2例通过CT血管成像(CTA)进一步评估病变血供情况,2例进一步行MRI平扫和增强检查。
1.2.1 CT及CTA检查 采用256层螺旋CT(Philips Brilliance iCT)进行检查。扫描范围自膈平面至髂前上棘,扫描参数:120 kV,200 mAs,层厚及层距5 mm,矩阵512×512,螺距1.0,增强扫描采用团注法注射非离子型对比剂优维显(370 mgI/ml)1.2 ml/kg,注射速率3.0 ml/s,注射后25、50~75、600 s分别进行肾皮质期、髓质期及排泄期扫描。
1.2.2 MRI检查 采用Siemens Trio 3.0T超导型MR扫描仪,体部相控阵表面线圈,采取常规仰卧位。平扫序列包括:①轴位脂肪抑制T2WI(TR 2 500 ms,TE 91 ms,矩阵320×256,FOV 400×400);②轴位正反相位T1WI OUT PHASE(TR 228 ms,TE 2.45 ms)、T1WI IN PHASE(TR 224 ms,TE 2.4 ms);③T1WI(TR 3.42 ms,TE 1.25 ms,矩阵320×256,FOV 400×400)、扩散加权成像(DWI)(b=800 s/mm2,TR 5 300 ms,TE 69 ms,矩阵130×130,FOV400×400),层厚均为5 mm。动态增强扫描采用脂肪抑制T1WVibe序列,层厚2.5 mm,采用高压注射器经肘静脉注入Gd-DTPA 0.15 mmol/kg,流速2.5 ml/s,分别于注射对比剂后20~25、50~60、300 s扫描,获得皮质期、髓质期、延迟期的影像,扫描时患者屏息。
1.3 病理学检查 2例行腹腔镜下根治性肾切除术,4例行腹腔镜下肾部分切除术。所有标本先进行大体观察、测量及拍照,并用10%甲醛液固定,制备成常规石蜡切片。普通病理学检查采用HE染色,最后行免疫组织化学检查,包括细胞角蛋白7(cytokeratin 7,CK7)、波形蛋白、WT-1、CD57、Ki-67。
1.4 图像分析 2名资深副主任及以上医师通过双盲法分别对所有病例的影像学资料进行回顾分析,当两者意见存在分歧时,协商达成一致。分析内容包括肿瘤的部位、大小、形态、数目、密度(信号)、边界、坏死、囊变、强化方式和程度等特征。CT增强扫描强化程度分级:①轻度强化:与平扫CT值相比,病灶实性部分增强CT值增加10~20 Hu;②中度强化:与平扫CT值相比,病灶实性部分增强CT值增加21~40 Hu;③明显强化:与平扫CT值相比,病灶实性部分增强CT值增加40 Hu以上。MRI强化程度标准:①轻度强化:病灶实性部分强化程度与腹部肌肉相近;②中度强化:病灶实性部分强化程度高于肌肉低于血管;③明显强化:病灶实性部分强化程度接近或等于血管。
2 结果
2.1 影像表现 6例MA均为单发,其中右肾3例,左肾3例;2例为完全外生性,4例为部分外生性。病灶位于肾下极1例,肾上极5例。肿瘤最大直径为2.5~12.0 cm,平均(5.6±3.3)cm。6例病灶均为类圆形或椭圆形,边界清楚。
2.1.1 CT表现 6例患者均行CT检查。1例为囊实混合性(图1),5例为实性(图2)。CT平扫实性部分1例呈稍高密度(图1A),5例呈等、稍高密度(图2A);1例病灶边缘可见点状钙化灶(图1A)。CT增强扫描中,1例囊实混合性病灶皮质期大部分坏死囊变区无强化,壁结节呈中度强化(图1B),髓质期及排泄期呈持续性强化(图1C、D)。5例实性病灶皮质期均呈轻-中度强化(图2B);髓质期及排泄期2例呈不均匀渐进性强化,内可见小斑片状无强化坏死区(图2C),另外3例呈均匀性渐进性强化。2例CTA检查病灶未见粗大供血动脉,周围可见细小分支血管(图1E)。6例患者腹腔及腹膜后均未见肿大淋巴结。
2.1.2 MRI表现 2例患者行MRI检查(图2)。T2WI上1例病灶呈低信号,另1例呈混杂稍高信号,内见少许更高信号(图2D),2例病灶于T1WI均呈等或稍低信号(图2E),DWI均呈高信号(图2F),ADC图上信号减低,ADC值分别为0.88×10-3mm2/s、1.08×10-3mm2/s,同反相位病灶信号未见明显改变。增强扫描方式与CT相同(图2G、H)。
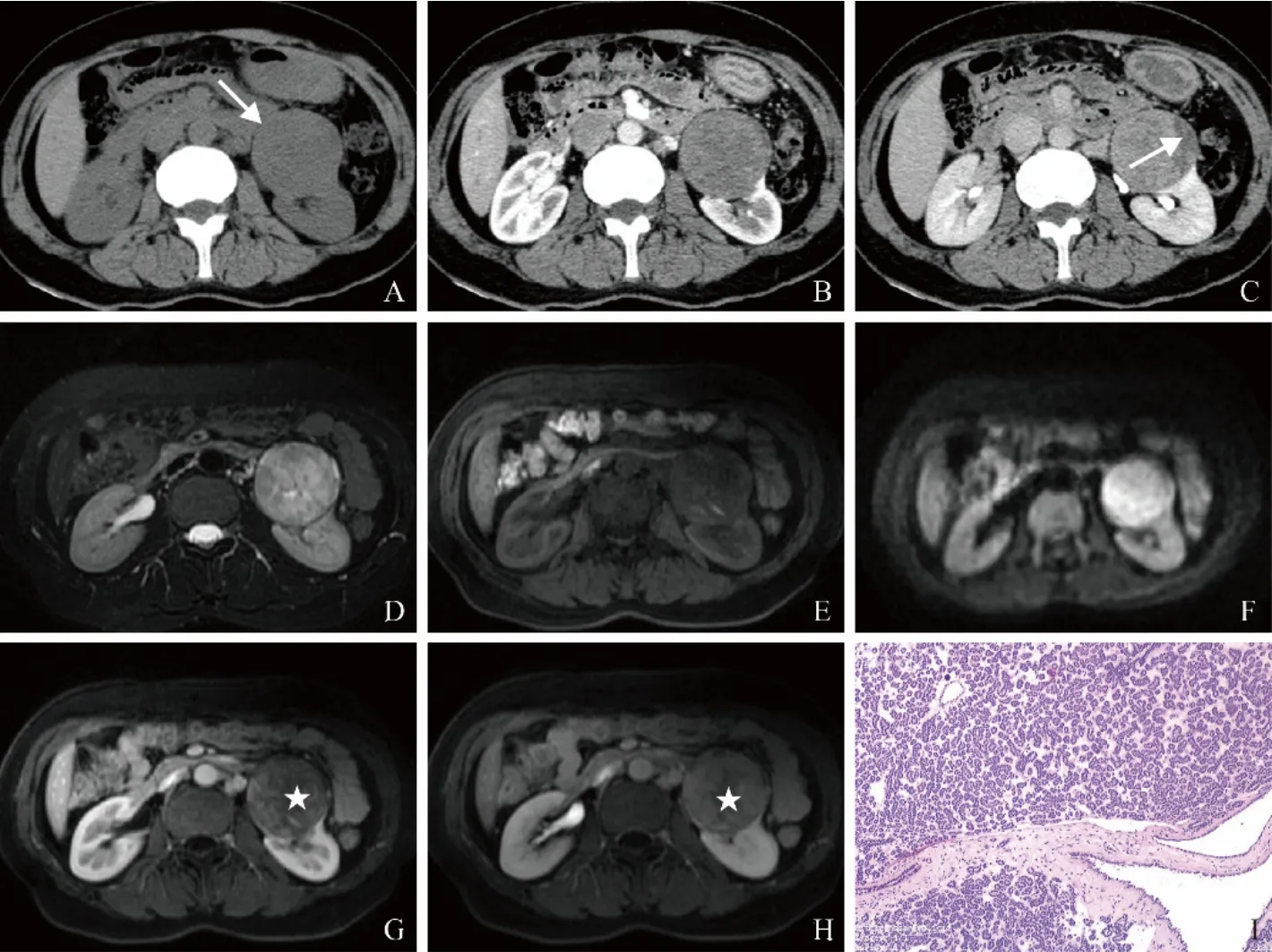
图2 女,43岁,左肾后肾腺瘤。CT平扫示左肾见实性肿块,密度欠均匀,大小约6.5 cm×6 cm×6 cm,CT值约34 Hu(箭,A),增强扫描皮质期及延迟期呈渐进性不均匀性强化,各期强化程度均匀低于周围正常肾实质(B、C),CT值分别约49、53、63 Hu,坏死区无强化(箭,C);T2WI-FS呈不均匀稍高信号(D),T1WI呈不均匀低信号(E),DWI呈高信号(F);MRI增强扫描示病灶强化特征与CT相同,呈乏血供表现(星号,G、H);病理镜下见肿瘤细胞小而均匀,排列紧密,形成花蕾样结构,胞质稀少(HE,×200,I)
2.2 病理表现 大体上,1例肿块切面呈淡黄色胶冻样,5例呈灰白色或黄白色,切面均匀,质中或质韧,包膜完整,1例伴巨大囊变,1例肿瘤边缘见点状钙化。光镜下,肿瘤细胞呈乳头状或腺管状排列密集,形成花蕾状结构,细胞形态均匀,胞核仁不明显,胞浆稀少,核分裂象罕见(图1F、2I)。免疫组化染色显示:6例WT-1及CD57均为(+),5例波形蛋白(+),5例CK7(-),1例CK7呈局灶(+),Ki-67均低表达(1%~10%)。

图1 男,13岁,左肾后肾腺瘤。CT平扫左肾见一囊实性肿块,边界清楚,以囊性为主,囊壁光滑,并可见结节状软组织影(箭,A),呈稍高密度,CT值约33 Hu,另囊壁见点状钙化灶(箭头,A),增强扫描皮质期实性部分呈不均匀中度强化(箭,B),坏死囊变区无强化(星号,B),髓质期及排泄期实性部分呈持续性强化(C、D),三期CT值分别为68 Hu、80 Hu、89 Hu;MIP示病灶周围有细小分支动脉(箭,E);病理镜下见肿瘤细胞呈腺管状、乳头状紧密排列,瘤细胞体积小,大小一致,未见核分裂象及异型性(HE,×400,F)
2.3 术前诊断及随访 6例病灶术前均被误诊为肾恶性肿瘤,手术病理诊断均为MA。有完整的术后随访,并定期进行超声及CT检查。随访1~44个月,中位随访时间31.5个月,随访截止时间2021年3月25日,无局部复发或转移。
3 讨论
3.1 MA的临床和病理 MA好发于中年女性,可见于任何年龄段,本组病例中除1例13岁患儿外,其余均为成年患者,与文献报道大致相符。MA多无特征性临床症状,常于体检时偶然发现,部分患者可出现腹部肿块、腰酸、阵发性血尿等非特异症状[6],实验室检查多为阴性。有文献报道MA患者可出现真性红细胞增多症[7-8],但本组患者实验室检查均无此表现,可能与样本量较少相关。
大体病理显示MA肿块边界清楚,有或无包膜,常突出于肾轮廓之外,切面均匀,呈灰白色或灰色,瘤内可见出血和坏死,囊变、钙化偶见。光镜下,肿瘤由不同比例的细胞组成,细胞呈小管状或小腺泡状排列,形成肾小球样或花蕾样结构为MA的特征性表现[8-9]。免疫组化染色显示肿瘤细胞CD57、波形蛋白、WT-1呈弥漫阳性,CK7呈局灶阳性,而上皮膜抗原和S-100阴性[10-11]。部分研究表明[12-14],约80%~90%的MA存在BRAF V600E基因突变,VE1抗体是鉴定该基因突变的高度特异性(100%)的标志物[15]。本组6例病理表现典型,但均未行基因检测。
3.2 MA的影像特征 绝大多数MA为单侧单发,呈圆形或类圆形[16]。结合本组6例MA的CT表现和文献报道[17-18],MA典型CT表现为:①单发软组织肿块,边界清,多突出于肾轮廓外。②平扫密度均匀,与肾脏密度相似或稍高,高密度为其特征影像表现,这可能与沙砾体形成、透明间质中存在钙化,以及高核质比有关[19]。此外,MA可伴有坏死囊变及出血,约20%的患者可出现钙化,少数为密集钙化。本组1例MA呈稍高密度,1例边缘伴点状钙化,与文献报道相符。③增强扫描实性部分表现为渐进性或持续性轻中度强化[20],皮质期高于肾髓质而低于皮质,髓质期及排泄期均低于邻近正常皮髓质,提示MA为乏血供肿瘤,这可能与其肿瘤细胞呈管状、腺泡状排列,细胞间质及血管成分少有关。本组6例CT增强均呈渐进性或持续性强化。2例CTA显示MA病灶无明显粗大供血动脉,仅可在周围见到细小的侧支血管,这可能是其相对乏血供强化方式的主要原因。
部分文献报道[21-22],MRI平扫表现为T1WI信号较肾实质低的肿块,T2WI呈均匀等或稍高信号,部分信号不均匀,可见坏死囊变区,增强扫描呈缓慢、渐进性强化,强化程度为轻-中度。MA病灶于DWI均呈高信号,ADC值减低,原因可能是肿瘤细胞排列紧密形成管状或腺泡状结构,核浆比高,肿瘤间质成分减少,从而限制了水分子的自由运动[20]。本组2例患者MRI表现与文献报道相符,其中1例T2WI呈低信号,另1例呈混杂稍高信号,内见少许更高信号的坏死囊变区,DWI均呈高信号。
3.3 鉴别诊断 因MA临床少见且对该疾病认识不足,影像学上常将其误诊为恶性肿瘤,从而造成过度治疗,其需与以下疾病鉴别:①肾细胞癌。肾透明细胞癌多为富血供肿瘤,密度及信号混杂,增强扫描明显不均匀强化,并呈典型“快进快出”表现,CTA示粗大供血动脉,两者较易区分。而乳头状肾癌及嫌色细胞癌等乏血供肾癌增强后呈轻-中度强化,强化方式与MA相似,在影像学上鉴别有时存在困难,需要依靠病理检查及免疫组化染色确诊。研究表明,MA的免疫组化病理表现为CK7、AMACR阴性,WT-1、CD57多呈阳性,而乳头状肾癌与此相反[23]。②嗜酸细胞腺瘤。嗜酸细胞腺瘤常表现为边界清楚的软组织肿块,密度及信号均匀,出血、坏死囊变及钙化少见,增强扫描常呈轻-中度均匀强化,两者影像表现相似,但部分嗜酸细胞腺瘤的节段性增强反转征和中央星芒瘢痕有助于区分[24]。③乏脂肪肾血管平滑肌脂肪瘤。部分乏血供的乏脂肪肾血管平滑肌脂肪瘤含或不含微量不成熟脂肪,平扫呈稍高密度,增强扫描呈轻中度强化,可表现为劈裂征,T2WI呈均匀低信号,与MA鉴别困难,此时可通过反相位信号减低加以区分,但最终确诊仍需依靠病理检测;富血供乏脂肪肾血管平滑肌脂肪瘤病灶强化明显,与MA不难鉴别[25-26]。
3.4 本研究的局限性 ①样本量少,无法完全代表全部完整的影像学特征,未来需要纳入多中心及大数据研究;②所有患者均未行BRAF V600E基因及VE1抗体检测,无法进一步探讨两者于MA的相关性。
总之,MA是一种罕见的肾脏良性肿瘤,当出现以下临床及影像特征时,应考虑MA的可能:①中年女性,单肾单发外生性肿块,病史长,无明显临床症状,可伴有红细胞增多;②CT平扫呈均匀等或稍高密度,T2WI呈等或稍高信号,T1WI等或稍低信号,DWI高信号,增强扫描呈渐进性、持续性轻中度强化。已有文献报道,部分MA术后发生了肺、骨骼和淋巴结转移[27],因此不排除MA有恶性潜能,术后应行长期密切随访和复查。
利益冲突 所有作者均声明不存在利益冲突
